Проникновение свободного т в клетку
 Скачать 46.97 Kb. Скачать 46.97 Kb.
|
|
Введение Андрогены обеспечивают прежде всего регуляцию развития, роста и функцию органов и тканей репродуктивной системы. Биологическое влияние андрогенов на ткани-мишени реализуется через специфические рецепторы и во многом определяется конфигурацией молекулы стероида. Последовательность происходящих реакций под действием Т выглядит следующим образом: проникновение свободного Т в клетку; образование комплекса Т + рецептор; трансформация комплекса в форму, способную связываться ядерным акцептором; связывание с хроматиновым акцептором; избирательная инициация транскрипции специфических мРНК и координированный синтез транспортных и рибосомных РНК; процессинг первичных РНК-транскриптов; транспорт определенных мРНК в цитоплазму; трансляция поступающих мРНК и обеспечение повышенного синтеза белка; посттрансляционные модификации белков. В настоящее время клонирован ген андрогенового рецептора, который всесторонне охарактеризован. Биологические эффекты андрогенов В эмбриональный период Т обеспечивает формирование и развитие семенных пузырьков, придатка семенников и семявыводящего протока. Процесс роста и развития предстательной железы, полового члена, мошонки и наружной уретры контролирует ДГТ, который является метаболитом Т. Он образуется непосредственно в тканях-мишенях с участием фермента 5а-редуктазы. В настоящее время доказано наличие у млекопитающих изоформ (1-й и 2-й тип) данного фермента, кодируемых разными генами. Изоформы имеют различные биохимические и фармакологические свойства, а также различное распределение в тканях. В урогенитальном тракте 2-й тип фермента содержится в мезенхимальных и стромальных клетках, которые обеспечивают формирование и последующий рост репродуктивных органов, таких как предстательная железа. Физиологическая роль изоформы 1-го типа пока неясна. Она обнаружена в коже и печени человека. Во время пуберта- ции андрогены обеспечивают развитие вторичных половых признаков, голосового аппарата, стимулируют рост (за счет повышения секреции гормона роста я усиления продукции инсулиноподобного ростового фактора I). Андрогены необходимы для нормальной половой функции. Т инициирует и поддерживает процесс сперматогенеза, либидо и спонтанные эрекции. Он не влияет на эрекции, обусловленные визуальными стимулами. Кроме этого, для взрослого организма андрогены необходимы для поддержания вторичных половых признаков, кроветворения, мышечной и костной ткани. Они оказывают генерализованное анаболическое действие на белковый обмен (задержка азота, увеличение массы тела, суммарной массы поперечнополосатой мускулатуры и нарастание ее силы). В печени андрогены влияют на синтез различных сывороточных белков, стимулируют выработку почками эритропоэтина. Андрогены оказывают прямое действие на стволовые клетки системы кроветворения. Они стимулируют формирование кости, ее плотность, обеспечивают созревание остеобластов и хондроцитов. Андрогены участвуют в дифференцировке мозга. В их отсутствие его развитие идет по женскому типу. Они влияют на те участки мозга, которые контролируют циклическую регуляцию секреции гонадолиберина гипоталамусом и половое поведение. Т в этом случае действует опосредованно, через ДГТ и эстрадиол, которые образуются из него с участием 5а-редукта- зы и ароматазы в специфических нейронах гипоталамуса. ДГТ, вводимый экзогенно, не воспроизводит эффектов Т, так как его молекула не подвергается ароматизации. Мозг эмбрионов обоего пола защищен от высокого уровня эстрогенов в крови матери а-фетопротеином, обладающим огромной емкостью для связывания эстрогенов. Репродуктивная функция мужского организма В пубертатный период в мужском организме происходит развитие и становление репродуктивной функции, характерной для организма взрослого мужчины. При этом во время пубертатного периода в коре надпочечников начинается секреция адреналовых мужских половых гормонов — андрогенов. В среднем в 11-летнем возрасте у мальчиков в семенниках начинается увеличение количества клеток Лейдига и благодаря их функции уровень секреции тестостерона постепенно достигает плато взрослого мужчины (порядка 6 нг/мл плазмы крови). В течение пубертатного периода происходит рост и развитие тела, изменение в регуляции многих функций организма, в том числе ЦНС и гипоталамуса. Секреция гонадолиберина в гипоталамусе и гонадотропинов (фоллитропина и лютропина) в гипофизе постепенно достигает уровня взрослого мужчины и сохраняется на относительно постоянном уровне в среднем до 50 лет, обусловливая характер синтеза и секреции тестестерона в мужских половых железах. Функции семенников Основными функциями мужских гонад являются сперматогенез и секреция мужских половых гормонов. Активность мужской репродуктивной функции является непрерывной и не имеет циклических проявлений, как в женском организме. Семенники развиваются в брюшной полости плода, но примерно за 2—3 мес до рождения под влиянием нарастающей концентрации тестостерона в плазме крови семенники опускаются в мошонку. В мошонке температура составляет примерно 34 °С и ниже, что является адекватной температурной средой для нормального течения сперматогенеза. Оптимальная для сперматогенеза температура в яичках регулируется в процессе противоточного температурного обмена между притекающей артериальной кровью и оттекающей от тканей яичек венозной кровью, а также при сокращении или расслаблении гладкой мышцы, поднимающей яичко, что изменяет положение последнего относительно области центральной температуры тела. Сперматогенез осуществляется в семенных канальцах, стенки которых выстланы сперматогенным эпителием, содержащим сперматозоиды и предшествующие им клетки — сперматогонии, сперматоциты I и II порядка, а также сперматиды, которые расположены между поддерживающими клетками Сертоли. Плотные контакты между клетками Сертоли создают надежный барьер с кровью (гематотестикулярный), который препятствует развитию аутоиммунных реакций организма на антигены, расположенные на мембране развивающихся половых клеток, а также действию на сперматогенный эпителий токсичных веществ, попадающих в организм из внешней среды. Клетки Сертоли выполняют трофическую функцию в отношении развивающегося сперматозоида, фагоцитируют половые клетки, утратившие способность к делению, а также остатки цитоплазмы делящихся половых клеток. Роль основных андрогенов в мужской репродуктивной функции. Тестостерон. Стимуляция дифференциации: Семявыносящие протоки семенные пузырьки придатки яичек Стимуляция пубертатного роста организма Рост пениса, семенных трубочек Сперматогенез Секреция гонадотропинов Регуляция по механизму обратной связи: гипоталамус-гипофиз—половые железы Формирование вторичных половых признаков: развитие голосового аппарата, мышц, распределение жира Сперматогенез Секреция гонадотропинов Половые стимулы Половое поведение Регуляция по механизму обратной связи: гипоталамус-гипофиз—половые железы Ткани пениса, семенных пузырьков Вторичные половые признаки: голос, мышцы, распределение жира Количество эритроцитов к крови и содержание в плазме крови липидов Дигидротестостерон. Рост волос по мужскому типу Развитие сальных желез, простаты Сперматогенез Секреция гонадотропинов Половые стимулы Половое поведение Наружные половые органы Семенные пузырьки Регуляция по механизму обратной связи: гипоталамус-гипофиз—половые железы Клетки Сертоли синтезируют белок, способный связывать тестостерон. Это поддерживает высокую концентрацию в сперматогенном эпителии гормона, необходимого для стимуляции сперматогенеза. Клетки Лейдига синтезируют мужские половые гормоны андрогены и находятся в соединительной ткани между семенными канальцами. Высокая активность этих клеток и соответственно высокая секреция тестостерона имеет место в поздний период развития плода, что необходимо для развития у него наружных половых органов. После рождения, к концу первого года жизни происходит интенсивная регрессия количества клеток Лейдига и снижение секреции в гонадах ребенка тестостерона в связи со снижением секреции лютропина в гипофизе. В результате до начала пубертатного периода в организме ребенка мужского пола не развиваются первичные и вторичные половые признаки, которые характерны для нормального взрослого организма мужчины. Начало пубертатного периода в развитии мужского организма связано с началом секреции гонадолиберина в гипоталамусе и лютропина в аденогипофизе. Под влиянием этих гормонов, клетки Лейдига дифференцируются во взрослый тип и в них начинается секреция тестостерона и дигидротестостерона, обусловливающих половое развитие мужского организма. Андрогенный дефицитК симптомам андрогенного дефицита относятся следующие признаки: снижение либидо (полового влечения); ухудшение эрекции; снижение объёма эякулята (количества спермы, выделяемой после оргазма); выпадение волос; истончение и дряблость кожи; снижение массы тела; увеличение грудных желёз; постоянная усталость, снижение общей энергии; потеря мышечной массы; резкое увеличение жировых отложений; снижение массы костной системы, возникновение остеопороза — хрупкости костей; немотивированные перепады настроения (депрессия, нарушение внимания, памяти, раздражительность, нарушение сна). 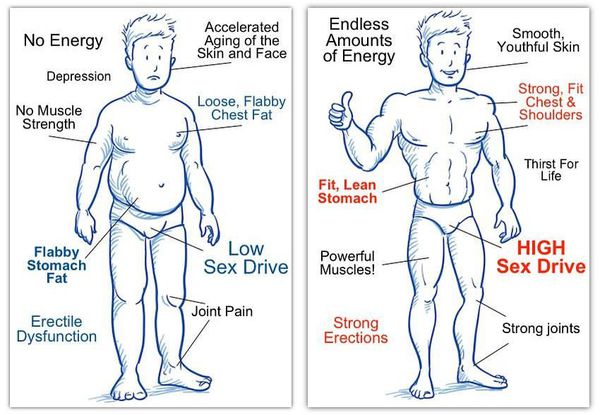 Если андрогенная недостаточность возникла до начала полового созревания, то тело приобретает характерную высокорослость с евнухоидными пропорциями. При этом размах рук превышает длину тела, а ноги оказываются длиннее туловища. В результате, такие пациенты сидя выглядят низкорослыми («сидячая карликовость»), а стоя — очень высокими («стоячий гигантизм»). 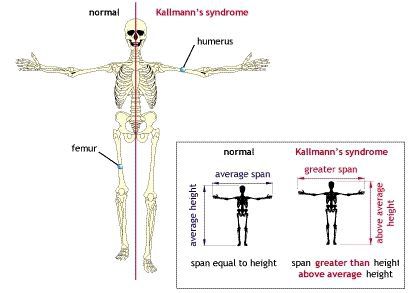 Длительная андрогенная недостаточность приводит к хрупкости костей (остеопорозу), что может сопровождаться патологическими переломами позвонков и бедренных костей, болями в спине. 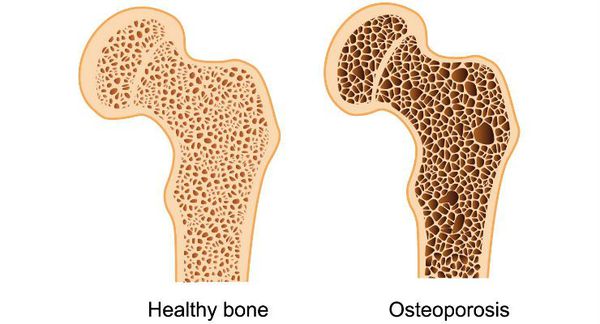 Дефицит андрогенов прямо не ведёт к увеличению подкожной жировой ткани, но распределение жира приобретает женский характер (отложения на бёдрах, ягодицах, нижней части живота). Мышечная масса тела, наоборот, уменьшается. В том случае, если андрогенный дефицит возник до наступления полового созревания, длина гортани не увеличивается и огрубление голоса не происходит. Несмотря на высокий рост, таких пациентов принимают за женщин, особенно по телефону, что порождает у них дополнительные комплексы. Сохраняется прямая граница волос надо лбом, борода не растёт или растёт очень плохо, почти не требует бритья. Оволосение тела очень скудное. Ещё один типичный признак — раннее появление тонких морщин вокруг глаз и рта. Кроме того, в результате отсутствия стимуляции сальных желёз кожа остаётся сухой. Анемия и плохое кровоснабжение определяют сильную бледность кожи. Также важный признак — снижение или полное отсутствие способности различать запахи (вероятность синдрома Кальмана). Такие больные не способны ощущать, например, запах ванилина, лаванды и другие ароматы, но сохраняют способность различать вещества, раздражающие тройничный нерв (нашатырный спирт). Снижение уровня тестостерона может вызвать увеличение грудных желёз у мужчин. В большинстве случаев, гинекомастия бывает двухсторонней, очень редко — односторонней. При выраженном, особенно одностороннем увеличении, пациента направляют на маммографию для исключения рака грудных желёз. 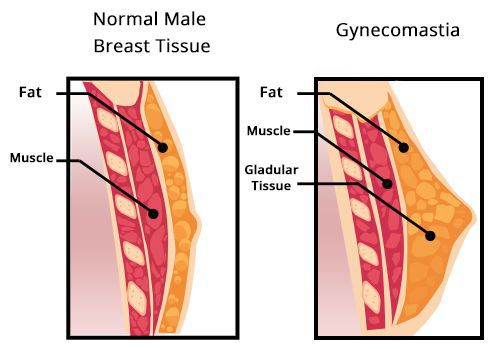 Увеличение груди сопровождается ощущением стеснения в груди и повышенной чувствительностью сосков. Нередко гинекомастия развивается у мальчиков при половом созревании (в возрасте 12–14 лет), но через 2–3 года исчезает. При ожирении картина становится ярче и сохраняется дольше. Иногда увеличение грудных желёз происходит у мужчин при старении. В сочетании с маленькими плотными яичками, гинекомастия типична для синдрома Клайнфельтера.  Быстрое развитие гинекомастии может говорить о наличии гормонально-активной опухоли яичек. Характерная триада симптомов включает гинекомастию, утрату полового влечения и опухоль яичка. Причиной гинекомастии могут быть и общие заболевания: цирроз печени или почечная недостаточность. Патогенез андрогенного дефицитаПатогенез андрогенного дефицита многообразен и зависит от конкретных причин. Рассмотрим основные моменты патогенеза андрогенной недостаточности. Возрастной андрогенный дефицитПатогенетические звенья возрастного андрогенного дефицита у мужчин запускаются, прежде всего, атеросклеротическими факторами, которые постепенно облитерируют (заращивают) заинтересованные сосуды. Это приводит к снижению кровотока в мужских гонадах, соответственно — к уменьшению синтеза тестостерона клетками Лейдига. 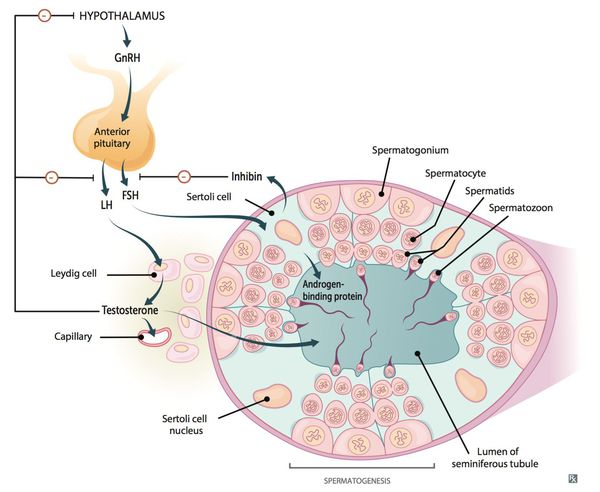 По мере прогрессирования процесса увеличивается чувствительность заднего отдела головного мозга — гипоталамуса — к тестостерону. Параллельно, происходит увеличение концентрации в крови гонадотропинов, что ещё более усугубляет ситуацию. Андрогенный дефицит при синдроме КальманаИнтересен механизм развития патологических нарушений при синдроме Кальмана. В период развития нормального плода предшественники гонадотропин-рилизинг-зависимых гормонов — специальных нейронов — перемещаются из обонятельного эпителия слизистой носа к своей постоянной точке в гипоталамусе. У эмбриона с синдромом Кальмана, сцепленным с Х-хромосомой, это движение нарушается. Предшественники гонадотропин-рилизинг-зависимых гормонов не выходят из обонятельного эпителия и поэтому не влияют на специфические клетки гипофиза. Основная характеристика синдрома Кальмана — незавершённое половое созревание или полное его отсутствие. Средний объём яичек у больных с синдромом Кальмана составляет не более 3 мл. Витаминная недостаточностьСовременные исследования показали огромную значимость недостатка витамина D у мужчин, в развитии андрогенного дефицита и снижения уровня тестостерона. Недостаток витамина D — это новая эпидемия XXI века, которая вызвана значительным снижением пребывания на солнце людей, которые проживают севернее 35-й параллели. По большому счёту, витамин D вовсе не является витамином. Скорее это провитамин, точнее — гормон, который регулирует многие процессы в организме. Понятие «витамин D» подразумевает несколько одинаковых по строению форм витамина D, принадлежащих к классу сексостероидов — D1, D2, D3, D4, D5. Только D3 является истинным витамином D. Витамин D образуется из продуктов питания и под воздействием солнечных лучей (ультрафиолета). Для преобразования в активную форму он должен пройти двухступенчатый процесс гидроксилирования: сначала процесс происходит в печени — витамин D превращается в 25-гидроксивитамин D — 25-(OH)D; затем гидроксилирование происходит в почках с образованием активного 1,25-дигидроксивитамина D — 1,25-(OH)2D (кальцитриола). Последние работы по синтезу тестостерона показали прямую корреляцию (взаимосвязь) между соотношением уровня витамина D и андрогенным недостатком у мужчин. Так, масштабное европейское исследование EMAS (2012) доказало прямые соотношения между концентрациями витамина D и тестостерона у мужчин. Уровень 25-(OH) витамина D3 хорошо соотносился с уровнем общего и свободного тестостерона и недостаточно взаимодействовал с концетрацией эстрадиола и лютеинизирующего гормона (ЛГ), с учётом возраста. Дефицит витамина D достоверно отражал динамику у мужчин с компенсированным и вторичным гипогонадизмом. Сложилось мнение, что дефицит витамина D и связанная с ним андрогенная недостаточность являются важными эндокринологическими механизмами у мужчин, нарушающими соотношение жиросинтезирующих (пролактин, инсулин, кортизол) и жиросжигающих гормонов (гормон роста, катехоламины, половые и тиреоидные гормоны). Данная проблема находится в стадии широкого изучения. Стрессовые факторыВ стрессовых ситуациях в организме происходит перенапряжение симпатоадреналовой системы, в коре надпочечников вырабатывается большое количество различных гормонов и биологически активных веществ: мужские и женские половые гормоны (тестостерон и эстрогены); минералкортикоиды (альдостерон); катехоламины (адреналин, норадреналин, дофамин); глюкокортикоиды (кортикостерон и кортизол). Кортизол синтезируется при стрессовых ситуациях, которые сочетаются с неудовлетворительным питанием и сопутствующими физическими перегрузками, пытается поддержать уровень глюкозы в крови. В случае затяжного хронического стресса образуется повышение его физиологической концентрации, что негативно отражается на основном мужском гормоне — тестостероне — и резко уменьшает его концентрацию в крови. Методы определения андрогенов Для определения содержания андрогенов используют биохимические, химические и радиоиммунологические методы. Решающую роль в понимании синтеза и метаболизма андрогенов сыграли химические методы, включая все варианты хроматографии (бумажная, колоночная, тонкослойная, газожидкостная с масс-спектрометрией и высокоэффективная жидкостная хроматография). Они до сих пор остаются важными приемами для изучения метаболизма андрогенов. Метод определения 17-КС сыграл большую роль в диагностике гормональных нарушений надпочечников и семенников. В последнее время широкое распространение получили радиоиммунологические методы определения уровня андрогенов с использованием высокоспецифических поликлональных и моноклональных антител. Они оказали определяющее влияние на развитие как экспериментальной, так и клинической эндокринологии. Их роль в развитии современной медицины ученые сравнивают с появлением телескопа в XVII веке. Чувствительность метода обеспечивает определение андрогенов в биологических средах в пикограммовых количествах. Для надежного определения Т и ДГТ требуется их предварительное хроматографическое разделение; для определения сульфатных форм андрогенов, например дегидроэпиандростерона, созданы прямые методы иммуноанализа без предварительного сольволиза. В последнее десятилетие созданы альтернативные неизотопные иммунологические методы определения гормонов. Наиболее широкое распространение получили иммуноферментные методы, люминесцентные, методы специфической флюоресценции и усиленной люминесценции. В качестве меченого компонента используются пероксидаза хрена, щелочная фосфатаза, европий, люминол, изолюминол или акридин, комбинация пероксидазы хрена с люминолом. К достоинствам этих методов относятся их высокая производительность и возможность длительного использования. Отпадают все требования и неудобства, связанные с использованием изотопных методов. Лабораторная диагностикаС помощью лабораторных исследований определяются следующие показатели: Тестостерон — основной мужской гормон. В норме его содержание в крови составляет 12-40 нмоль/л. Концентрация тестостерона в сыворотке крови на 20–40% выше в утренние часы, чем в вечерние. Поэтому следует проводить как минимум две пробы на уровень тестостерона. Кратковременные и интенсивные физические нагрузки сопровождаются повышение тестостерона в крови, тогда как длительная тяжёлая работа или изнуряющие тренировки снижают уровень гормона. Тестостерон можно определить и в слюне. Норма — 200-500 пмоль/л. Концентрация гормона в слюне коррелирует с уровнем свободного тестостерона в сыворотке. Особенно это удобно для контроля заместительной терапии тестостероном самим пациентом. ГСПГ (глобулин, связывающий половые гормоны) — белок, с которым связывается тестостерон. На долю свободной фракции тестостерона приходится всего 2%. Поэтому очень важно знать уровень ГСПГ. В норме он равен от 17 до 68 нмоль/л. После чего по специальной формуле рассчитывается уровень свободного и биологически доступного тестостерона. Витамин D — группа биологически активных веществ, скорее провитамины (в том числе холекальциферол и эргокальциферол). В последнее время доказано его большое значение в синтезе тестостерона. Пограничный уровень 25-гидрокси-холекальциферола в крови составляет 30-60 нг/мл (75-150 нмоль/л). Ингибин В — отражает секрецию клеток Сертоли, вырабатывается ими же, участвует в регуляции гипофизарного ФСГ. В норме равен 147-365 пг/мл. ЛГ (лютеинизиирующий гормон) — продукт секреции передней доли гипофиза, стимулирует клетки Лейдига, вырабатывающие тестостерон. В норме равен 1–10 мМЕ/мл. ФСГ (фолликулостимулирующий гормон) — важнейший показатель мужской плодовитости. Его основная функция — сперматогенез, выработка спермы, способной к оплодотворению. Деятельность мужских половых органов невозможна без этого гормона. Норма — 3,5-12,5 мМе. Пролактин — в основном, женский половой гормон. Берётся при условии неясных случаев эректильной дисфункции, увеличении грудных желёз, подозрении на аденому гипофиза. Он влияет на уровень эрекции, продолжительность полового акта, принимает участие в синтезе спермы. Норма — 53-360 мЕд/л. Эстрадиол — женский гормон, образующийся путём трансформации тестостерона и андростендиона, вырабатывается в мужском организме в значительно меньшем количестве, чем в женском, однако имеет свои важные функции. Он также участвует в синтезе спермы, половом акте, отвечает за влечение к противоположному полу. Норма — 10-50 пг/л. ХГ — хорионический гонадотропин, отвечает за половое развитие мужчин, стимулирует работу яичек, отвечает за уровень тестостерона и зрелых сперматозоидов. Норма — 0-5 мЕд/м. ТТГ, Т3, Т4 — показатели работы щитовидной железы (тиреотропный гормон и другие), находятся в тесной связи с тестостероном и другими гормонами. Глюкоза в крови, уровень инсулина, гликозированный гемоглобин, С-пептид, лептин — показатели углеводного обмена, усвояемости глюкозы и промежуточных продуктов. Липидный спектр крови — соотношение липопротеидов высокой, средней и низкой плотности, определяет уровень атеросклероза, важен при старении и ожирении. СПИСОК ЛИТЕРАТУРЫ↑1. Гончаров Н. П., Кация Г. В., Асо Т. и др. // Пробл. эндокринол. - 2018. - № 1. - С. 98-102. ↑2. Клиническая эндокринология: Руководство / Под ред. Н. Т. Старковой. - М., 2019. ↑3. Теппермен Д., Теппермен X. Физиология обмена веществ и эндокринной системы: Пер. с англ. - М., 2019. - С. 177. ↑4. Хефтман Э. Биохимия стероидов: Пер. с англ. - М., 2020. - С. 118. ↑5. Винаров А.З., Роживанов Р.В. Влияние терапии трансдермальным препаратом тестостерона на качество жизни мужчин с андрогендефицитом и хроническим простатитом в условиях рутинной клинической практики // Урология. — 2018. — № 1. — С. 71-76. Тюзиков И.А., Калинченко С.Ю., Ворслов Л.О., Тишова Ю.А. Место андрогенного дефицита в клиническом портрете современного урологического пациента // Андрология и генитальная хирургия. — 2019. — № 2. — С. 48-57. |

