Простыми и сложными белками. Фермент, являющийся сложным белком, называют холоферментом
 Скачать 49.34 Kb. Скачать 49.34 Kb.
|
|
Простые и сложные ферменты. Кофакторы ферментов – ионы металлов Структура молекулы ферментов По строению ферменты могут быть простыми и сложными белками. Фермент, являющийся сложным белком, называют холоферментом. Белковую часть фермента называют апоферментом, небелковую часть – кофактором. Различают два типа кофакторов: 1. Простетическая группа – прочно связана с апоферментом, часто ковалентными связями. 2. Кофермент – небелковая часть, легко отделяемая от апофермента. Часто коферментами служат производные витаминов. К коферментам относятся следующие соединения: производные витаминов (табл. 3.1); 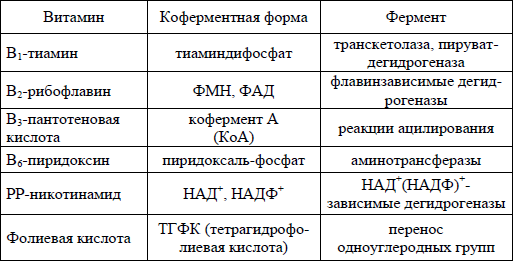 гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов, нуклеотиды; доноры и акцепторы остатка фосфорной кислоты; убихинон, или кофермент Q, участвующий в переносе электронов и протонов в цепи переноса электронов; фосфоаденозилфосфосульфат, участвующий в переносе сульфата; глутатион, участвующий в окислительно-восстановительных реакциях. Простые ферменты состоят только из аминокислот – например, практически все гидролитические ферменты – протеазы, липазы, рибонуклеазы. Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор (ионы металла) или кофермент (органическое соединение). Примером могут быть сукцинатдегидрогеназа (содержит ФАД) (в цикле трикарбоновых кислот), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем). Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофакторы – ионы металлов Более 25% всех ферментов для проявления полной каталитической активности нуждаются в ионах металлов. Рассмотрим их роль в ферментативном катализе. Роль металлов в присоединении субстрата в активном центре фермента Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно, третичной и четвертичной структур. Ионы металлов – стабилизаторы молекулы субстрата. Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-АТФ. В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента. Схематично роль кофактора при взаимодействии фермента и субстрата можно представить, как комплекс E-S-Me, где Е – фермент, S – субстрат, Ме – ион металла. Ионы металлов – стабилизаторы активного центра фермента. В некоторых случаях ионы металлов служат «мостиком» между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Mo2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название «металлоэнзимы». К металлоэнзимам относят, например, фермент пируваткиназу. Роль металлов в стабилизации структуры фермента. Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях рН, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы. Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щелочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы калия. Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Роль металлов в ферментативном катализе Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа. Участие металлов в электрофильном катализе. Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn2+, Fe2+, Mn2+, Cu2+. Ионы щелочных металлов, такие так Na+ и К+, не обладают этим свойством. В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений. Участие металлов в окислительно-восстановительных реакциях. Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон. Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях. |
