РАФИНИРОВАНИЕ ЗОЛОТА. рафинирование золота
 Скачать 0.62 Mb. Скачать 0.62 Mb.
|
|
«РАФИНИРОВАНИЕ ЗОЛОТА» СОДЕРЖАНИЕ ВВЕДЕНИЕ………………………………………………………………………3 1.РАФИНИРОВАНИЕ ДРАГОЦЕННЫХ МЕТАЛЛОВ……….…………..4 2.МЕТОДЫ АФФИНАЖА ЗОЛОТА…………………………………………5 3.ЭЛЕКТРОХИМИЧЕСКОЕ РАФИНИРОВАНИЕ ЗОЛОТА…………….8 ЗАКЛЮЧЕНИЕ………………………………………………………………...21 СПИСОК ЛИТЕРАТУРЫ…………………………………………………….22 ВВЕДЕНИЕ Первое знакомство человека с драгоценным металлом состоялось еще в V тысячелетии до нашей эры, когда далекие предки современного человека начали находить золото в самородном состоянии. Как считают археологи, первыми ювелирами, использовавшими этот металл для создания украшений, были мастера на Ближнем Востоке. Уже оттуда ювелирные изделия поставлялись, например, в Египет, где в гробнице королевы Шумерской цивилизации Зер были обнаружены археологами первые золотые украшения III тысячелетия до нашей эры. Использованию металла в качестве материала для производства украшений способствовали не только привлекательный внешний вид и распространение в самородном состоянии, а и простота обработки. Золото — очень мягкий металл, по шкале Мооса оно приблизительно равно 2,5, что очень близко к твердости ногтя. Оно также и очень пластично. Знаменитое сусальное золото, которым покрываются купола церквей, имеет толщину до 0,1 микрометра (одна миллионная одного метра). При такой толщине металл приобретает прозрачность, в отраженном свете имеет желтый цвет, а в проходящем — с оттенками сине-зеленого. Цвет чистого золота — ярко-желтый, и для придания разных оттенков в состав ювелирного сплава добавляют дополнительные металлы. Так, например, красное золото получается при смешении с медью, а белое — с палладием.  1. РАФИНИРОВАНИЕ ДРАГОЦЕННЫХ МЕТАЛЛОВ Рафинирование (аффинаж)— очистка драгоценных металлов от примесей и отделение их друг от друга. На аффинаж поступают черновые металлы в слитках, концентраты гравитационного передела, осадки цианистого процесса, шламы электролитического рафинирования меди и никеля, шлифовое золото после амальгамации, а также отходы производства и потребления. Для плавки применяют графито-шамотные или графитовые с наклонной осью газовые или электрические печи. Тигли должны быть жаростойкие (1300…1500 °С), термически и химически стойкие по отношению к расплаву и особенно к применяемым флюсам. Шламы от электролиза меди и металлы со свинцовых заводов имеют преимущественно серебряно-золотой состав, с соотношением серебра к золоту 6…8. В сплавах из цианистых осадков и после амальгамации преобладает золото. В результате металлургической переработки полиметаллических руд драгоценные металлы переходят в черновые металлы — никель и медь. Платиновые металлы собираются почти полностью в черновой никель, a Ag и Аu — в черновую медь. При последующем электролитическом рафинировании черновых металлов Ag, Au и платиновые металлы осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж. При рафинировании сплавов, содержащих менее 30 % или более 70 % золота, перерабатывают их раздельно. В большинстве случаев, золотосеребряные сплавы поступающие на рафинирование содержат также платину. 2. МЕТОДЫ АФФИНАЖА ЗОЛОТА Наиболее древними из методов рафинирования являются пирометаллургические, которые эволюционировали от простого расплавления руды на кострах до индукционной и плазменной плавки. Возможно, что купелирование (отделение благородных металлов от свинца окислительным плавлением в пламенных печах при 1000 °С), использовавшееся на заре металлургии драгоценных металлов для разделения серебра и свинца, является прародителем всех окислительных процессов рафинирования. Современное аффинажное производство золота характеризуется высоким уровнем применения электролиза (88 % заводов) и внедрением жидкостной экстракции (12 %). В качестве стандартных операций в технологии рафинирования используют процесс Миллера (40 %), гидрохлорирование (54 %), кислотный аффинаж (46 %) и купелирование (22 %). На рис. 1-4 приведены блок-схемы, характеризующие различные способы аффинажного производства золота. Выбор конкретного способа зависит от многих факторов: состава и качества исходного сырья, вида примесей, существующей инфраструктуры, экологических и финансовых соображений. Часто существенный вклад в себестоимость золота вносят вспомогательные операции, прямо не участвующие в технологии рафинирования. 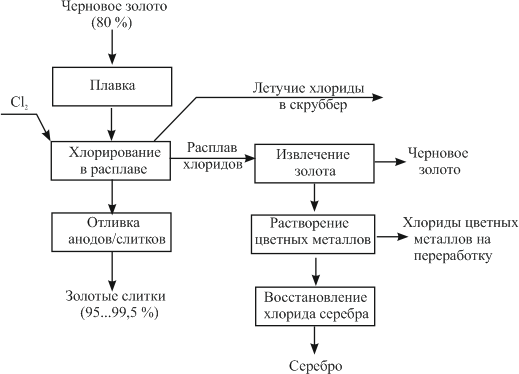 Рисунок 1 - Принципиальная схема процесса Миллера 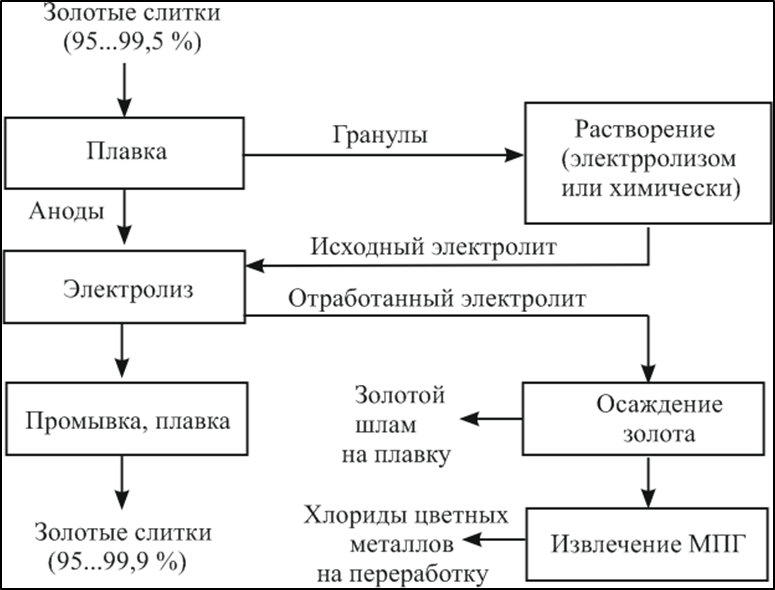 Рисунок 2- Принципиальная схема рафинирования золота электролизом 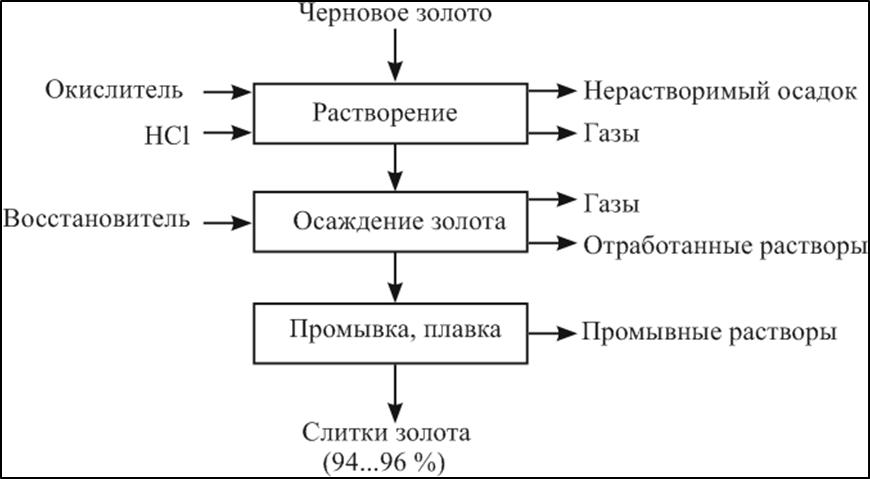 Рисунок 3 - Принципиальная схема рафинирования золота способом растворение-осаждение 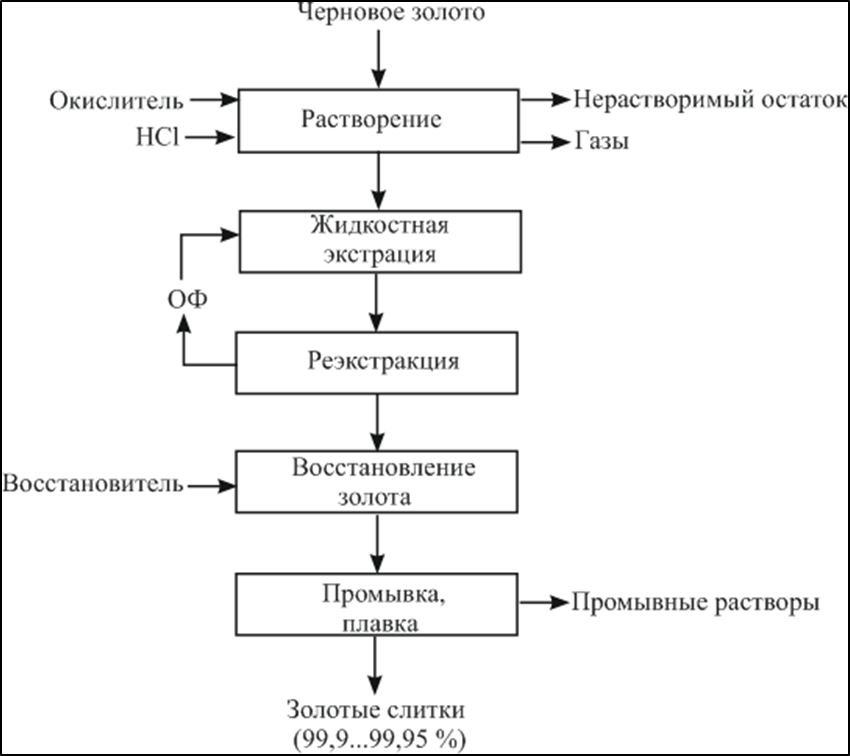 Подборка по базе: физра реферат2.docx, Титульный лист для реферата.docx, Общий доступ Реферат-WPS Office.docx, Акунишников Реферат.docx, генеральный план реферат.docx, Медсестренскоедело реферат.pdf, Руднева реферат.docx, Предпринимательское право. Реферат. Мосиенко К.С..docx, Достижения советских и российских борцов на ОИ реферат Шейнина 2, Реферат по дисциплине «Физическ Реферат по теме_ «Особенности фи UROPRO Prostata bilan muammomi? Bu hiyla erkaklar salomatligini tiklaydi BATAFSIL O'QISH Министерство образования и науки Российской Федерации Федеральное агентство по образованию РОССИЙСКИЙ ХИМИКО - ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ имени Д.И. Менделеева Кафедра Технологии неорганических веществ и электрохимических процессов РЕФЕРАТ: «РАФИНИРОВАНИЕ ЗОЛОТА» Выполнила: студент 5 курса, группы . Проверил: к.т.н., . МОСКВА 2020 СОДЕРЖАНИЕ ВВЕДЕНИЕ………………………………………………………………………3 1.РАФИНИРОВАНИЕ ДРАГОЦЕННЫХ МЕТАЛЛОВ……….…………..4 2.МЕТОДЫ АФФИНАЖА ЗОЛОТА…………………………………………5 3.ЭЛЕКТРОХИМИЧЕСКОЕ РАФИНИРОВАНИЕ ЗОЛОТА…………….8 ЗАКЛЮЧЕНИЕ………………………………………………………………...21 СПИСОК ЛИТЕРАТУРЫ…………………………………………………….22 ВВЕДЕНИЕ Первое знакомство человека с драгоценным металлом состоялось еще в V тысячелетии до нашей эры, когда далекие предки современного человека начали находить золото в самородном состоянии. Как считают археологи, первыми ювелирами, использовавшими этот металл для создания украшений, были мастера на Ближнем Востоке. Уже оттуда ювелирные изделия поставлялись, например, в Египет, где в гробнице королевы Шумерской цивилизации Зер были обнаружены археологами первые золотые украшения III тысячелетия до нашей эры. Использованию металла в качестве материала для производства украшений способствовали не только привлекательный внешний вид и распространение в самородном состоянии, а и простота обработки. Золото — очень мягкий металл, по шкале Мооса оно приблизительно равно 2,5, что очень близко к твердости ногтя. Оно также и очень пластично. Знаменитое сусальное золото, которым покрываются купола церквей, имеет толщину до 0,1 микрометра (одна миллионная одного метра). При такой толщине металл приобретает прозрачность, в отраженном свете имеет желтый цвет, а в проходящем — с оттенками сине-зеленого. Цвет чистого золота — ярко-желтый, и для придания разных оттенков в состав ювелирного сплава добавляют дополнительные металлы. Так, например, красное золото получается при смешении с медью, а белое — с палладием.  1. РАФИНИРОВАНИЕ ДРАГОЦЕННЫХ МЕТАЛЛОВ Рафинирование (аффинаж)— очистка драгоценных металлов от примесей и отделение их друг от друга. На аффинаж поступают черновые металлы в слитках, концентраты гравитационного передела, осадки цианистого процесса, шламы электролитического рафинирования меди и никеля, шлифовое золото после амальгамации, а также отходы производства и потребления. Для плавки применяют графито-шамотные или графитовые с наклонной осью газовые или электрические печи. Тигли должны быть жаростойкие (1300…1500 °С), термически и химически стойкие по отношению к расплаву и особенно к применяемым флюсам. Шламы от электролиза меди и металлы со свинцовых заводов имеют преимущественно серебряно-золотой состав, с соотношением серебра к золоту 6…8. В сплавах из цианистых осадков и после амальгамации преобладает золото. В результате металлургической переработки полиметаллических руд драгоценные металлы переходят в черновые металлы — никель и медь. Платиновые металлы собираются почти полностью в черновой никель, a Ag и Аu — в черновую медь. При последующем электролитическом рафинировании черновых металлов Ag, Au и платиновые металлы осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж. При рафинировании сплавов, содержащих менее 30 % или более 70 % золота, перерабатывают их раздельно. В большинстве случаев, золотосеребряные сплавы поступающие на рафинирование содержат также платину. 2. МЕТОДЫ АФФИНАЖА ЗОЛОТА Наиболее древними из методов рафинирования являются пирометаллургические, которые эволюционировали от простого расплавления руды на кострах до индукционной и плазменной плавки. Возможно, что купелирование (отделение благородных металлов от свинца окислительным плавлением в пламенных печах при 1000 °С), использовавшееся на заре металлургии драгоценных металлов для разделения серебра и свинца, является прародителем всех окислительных процессов рафинирования. Современное аффинажное производство золота характеризуется высоким уровнем применения электролиза (88 % заводов) и внедрением жидкостной экстракции (12 %). В качестве стандартных операций в технологии рафинирования используют процесс Миллера (40 %), гидрохлорирование (54 %), кислотный аффинаж (46 %) и купелирование (22 %). На рис. 1-4 приведены блок-схемы, характеризующие различные способы аффинажного производства золота. Выбор конкретного способа зависит от многих факторов: состава и качества исходного сырья, вида примесей, существующей инфраструктуры, экологических и финансовых соображений. Часто существенный вклад в себестоимость золота вносят вспомогательные операции, прямо не участвующие в технологии рафинирования.  Рисунок 1 - Принципиальная схема процесса Миллера  Рисунок 2- Принципиальная схема рафинирования золота электролизом  Рисунок 3 - Принципиальная схема рафинирования золота способом растворение-осаждение  Рисунок 4 – Принципиальная схема аффинажа золотом способом растворение - жидкостная экстракция 3.ЭЛЕКТРОХИМИЧЕСКОЕ РАФИНИРОВАНИЕ ЗОЛОТА Электрохимическое рафинирование золота. Аффинаж золота электролизом позволяет получать металл высокой чистоты. Аноды отливают из рафинируемого сплава, содержащего в качестве примесей серебро, платиновые металлы и некоторые недрагоценные металлы. Электролитом служит водный раствор золотохлористо-водородной кислоты с добавкой соляной кислоты. Схематически процесс можно представить следующим образом: Золотохлористоводородная кислота является сильной и полностью диссоциирует на ионы В свою очередь, анионы АuСl—4 частично диссоциирует с образованием катионов Аu+3 Однако константа диссоциации Кд этого комплекса очень мала(Кд=5·10-22), т. е. равновесие реакции смещено влево.В водном растворе ионы АuСl- могут подвергаться гидролизу но в кислом растворе гидролиз практически не идет. Таким образом, можно считать, что золото в электролите находится в форме аниона АuСl—4 . Основной катодный процесс при электролитическом рафинировании золота представляет собой восстановление анионов металлического золота АuСl—4 до Стандартный потенциал этого процесса равен +0,99 В, поэтому конкурирующий с ним процесс восстановления водорода практически исключен. На аноде происходит растворение рафинируемого сплава с переходом золота в раствор: Так как стандартные потенциалы хлора и кислорода значительно электроположительное, чем потенциал золота, то выделение их на аноде в нормальных условиях электролиза невозможно 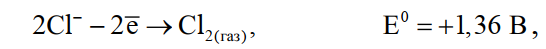 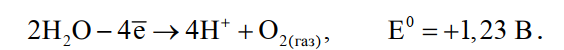 Однако характерная и весьма важная особенность анодного поведения золота — его склонность к пассивированию. При переходе золота в пассивное состояние растворение анода прекращается, потенциал его смещается в положительную сторону и достигает такой величины, при которой становится возможным выделение газообразного хлора. Явление пассивирования крайне нежелательно: на аноде вместо полезного процесса растворения золота происходит вредный процесс — окисление ионов хлора, что приводит к обеднению электролита золотом и ухудшению атмосферы в цехе. Во избежание пассивирования анода и выделения на нем хлора необходимо иметь достаточно высокую кислотность и температуру электролита. При этом, чем выше анодная плотность тока, тем больше должно быть в электролите соляной кислоты и тем выше должна быть его температура. Повышение концентрации соляной кислоты и температуры, помимо устранения пассивации золота, ведет к увеличению электропроводности электролита и, следовательно, к уменьшению расхода электроэнергии. Другой, весьма существенной особенностью электролиза золота является то, что при растворении анода золото переходит в раствор не только в виде аниона АuСl—4 , но и в виде аниона АuСl—2 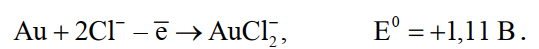 Но так как электрохимический эквивалент одновалентного золота больше, чем трехвалентного, то анодный выход по току в расчете на трехвалентное золото оказывается выше 100 %. Подобно тому, как это происходит в известном процессе электролиза меди, между анионами новесие АuСl—4 , и АuСl—2 устанавливается равновесие Однако константа равновесия этой реакции в отличие от константы равновесия аналогичной реакции между ионами Сu+2 и Сu+ имеет значительно меньшую величину. Поэтому концентрация анионов АuСl—2 в электролите довольно значительна и вполне соизмерима с концентрацией анионов АuСl—4 . Это приводит к тому, что на катоде существенное развитие получает процесс восстановления АuСl—2 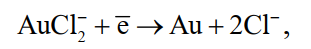 вследствие чего катодный выход по току в расчете на трехвалентное золото также превышает 100 %. В реальных условиях электрохимического рафинирования концентрация образующихся на аноде анионов АuСl - превышает равновесную величину, вследствие чего равновесие приведенной выше реакции диспропорционирование смещается вправо и часть золота в виде тонкого порошка выпадает в анодный шлам. Извлечение золота из шлама требует дополнительных операций, поэтому необходимо предотвратить образование порошкового золота. Практикой установлено, что переход золота в шлам уменьшается с повышением плотности тока. И, наконец, третьей характерной особенностью электрохимического рафинирования золота является то, что его обычно проводят при переменном асимметричном токе (процесс Вольвилля). Для этого последовательно с источником постоянного тока включают источник переменного тока с ЭДС, немного превышающей ЭДС постоянного тока. Необходимость применения асимметричного тока вызвана специфическим поведением серебра при растворении анодного сплава. Будучи значительно отрицательнее золота, серебро легко окисляется на аноде, образуя нерастворимый хлорид серебра. 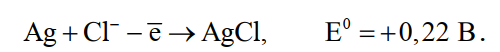 Если процесс электролиза вести с применением постоянного тока, хлористое серебро покроет анод толстой коркой, вследствие чего прекратится растворение золота и на аноде начнет выделяться газообразный хлор. Применение асимметричного тока позволяет избежать этих трудностей. При использовании асимметрического тока на аноде чередуются полупериоды положительного знака с более короткими полупериодами отрицательного знака. При анодной поляризации происходит растворение сплава и образование пленки хлористого серебра. Применяя асимметричный ток, можно вести электролиз сплавов, содержащих до 20 % Аg. При этом отношение напряжения переменного тока к напряжению постоянного тока (Uпер/Uпост.) должно быть тем больше, чем больше содержание серебра в анодах. Если содержание серебра в анодах невелико (менее 6 %), то электролиз золота можно вести, применяя обычный постоянный ток. В этом случае хлористое серебро легко падает в анодный шлам, не образуя прочной пленки. Кроме серебра в золотых анодах присутствуют медь, свинец, висмут, теллур, железо, олово, мышьяк, сурьма, платина и палладий. Механизм растворения такого многокомпонентного сплава очень сложен. Медь, значительно более электроотрицательная, чем золото, переходит в раствор, и ее накопление в электролите, после известного предела, создает опасность совместного разряда меди и золота. Поэтому при большом содержании меди в анодах (свыше 2 %) необходимо менять электролит. Допустимое содержание меди в электролите составляет 90 г/л. Еще более электроотрицателен свинец. Растворяясь на аноде в первую очередь, он остается в электролите в концентрациях, определяемых растворимостью РbСl2. При насыщении электролита хлоридом свинца на аноде может образоваться пленка твердой соли РbСl2, которая будет отлагаться совместно с хлоридом серебра, вызывая пассивирование анода. Если содержание серебра и свинца в сумме не превышает 13 %, аноды не пассивируются. Висмут, как и свинец, легко растворяется на аноде и содержание его в сплаве до 0,3 % не вызывает затруднений. При совместном присутствии в золотом сплаве 0,6 % Ві; 0,9 % Рb и 12 % Аg анод пассивируются плотной пленкой, которая образуется из солей этих металлов. В присутствии серы небольшие количества свинца и висмута вызывают частичную или даже полную пассивацию анода. Так, установлено, что сплавы, в которых присутствует 3,6…10,1 % Рb и 2,16…6,87 % S, при электрохимическом растворении покрываются плотной пленкой сернистых соединений, сильно затрудняющей растворение. Сплавы с 13 % Рb, 3 % Ві, 12 % S совсем нерастворимы при пропускании тока. При содержании в сплавах сульфидов свинца и висмута рекомендуется предварительно окислить сплав, добавляя марганцевокислый калий в расплавленный металл в количестве, в 3…5 раз превышающем теоретически необходимое для реакции окисления серы. При плавке в качестве покровного флюса добавляют соду. Теллур растворяется на аноде и накапливается в электролите. При значительном содержании теллура в электролите ухудшается качество катодных осадков. Вредной примесью при электролизе является железо. Переходя в раствор в виде ионов Fе+2, оно восстанавливает из электролита золото и повышает его содержание в шламе. Олово, мышьяк и сурьма, находясь в сплаве в небольших количествах (до 0,05 %), хорошо растворяются и затруднений не вызывают. Платина и палладий растворяются на аноде, образуя платинохлористоводородную кислоту и хлористый палладий. Так как стандартные потенциалы этих металлов близки к стандартному потенциалу золота: то при чрезмерном накоплении в растворе их осаждение может начаться на катоде совместно с золотом. Предельно допустимая концентрация платины в электролите составляет 50 г/л, палладия 15 г/л. Рутений, родий, осмий и иридий (если они присутствуют в анодах) полностью переходят в шлам. Электролиз золота ведут в небольших ваннах из фарфора или винипласта вместимостью 20…65 л 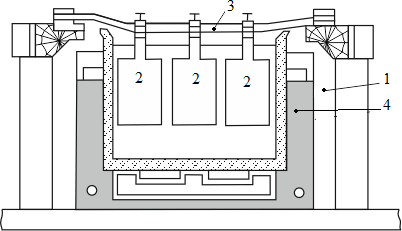 Рисунок 5- Ванна для электролиза золота В отечественной практике применяют фарфоровые ванны вместимостью 25 л. В качестве катодов используют золотую жесть толщиной 0,1…0,25 мм, изготовляемую прокаткой чистого электролитного золота. Для придания катодам жесткости их подвергают рифлению на специальном прессе. В ванны подвешивают 18 катодов на шести штангах (по три катода в ряд) и 15 анодов на пяти штангах (по три анода в ряд). Масса одного анода составляет примерно 2 кг. Аноды подвешивают к штангам с помощью золотых ленточек, вплавленных в металл при отливке анодов. Для поддержания необходимой температуры электролита ванна устанавливается в водяной бане. Электролит перемешивается сжатым воздухом, подаваемым в ванну по стеклянным трубкам. Так как при электролизе выделяется хлор, ванны помещают в специальном вытяжном шкафу. Ток подводят снаружи шкафа по медным шинам, а внутри — серебряным как более стойким в атмосфере хлора материалом. Из серебра же делают штанги для подвески электродов. Электролит содержит 70…200 г/л Аu и 40…100 г/л HCl. Температура электролита 50…60 °С. Электролиз ведут асимметрическим током плотностью 600…1500 А/м2. Сила переменного тока обычно на 10 % выше, чем постоянного. Напряжение на ванне 0,5…1 В. Золото осаждается на катоде в виде плотного блестящего осадка. Катоды разгружают 3…4 раза в сутки в зависимости от плотности тока. Катодное золото промывают горячей водой, очищают щетками, обрабатывают соляной кислотой или аммиаком (для растворения случайно приставших частиц хлорида серебра), снова промывают водой, сушат и плавят в индукционной печи в слитки. Чистота катодного золота 99,98…99,99 %. Основными примесями в нем являются серебро, медь и железо. Анодный шлам выгружают из ванн и отмывают водой от электролита. Промывные воды используют для доливки ванн. Шлам загружают в сетчатый серебряный барабан, помещенный в наполненную водой ванну. При вращении барабана хлорид серебра через отверстия смывается в ванну, а более крупные частицы золотого анодного скрапа и дендриты катодного золота остаются в барабане. Золотые остатки сушат и возвращают в плавку на аноды. Хлористое серебро восстанавливают железным скрапом или порошком в солянокислой среде, промывают водой и плавят в аноды для серебряного электролиза. Выход анодного скрапа при электролизе золота зависит от чистоты анодов и колеблется от 10 до 20 % от массы исходных анодов. Так же, как и шлам, остатки анодов отмывают в сетчатом барабане от хлорида серебра и электролита, сушат и плавят в аноды. В процессе электролиза электролит обогащается примесями и обедняется по золоту. При работе на грязном электролите возможно загрязнение катодных осадков вследствие осаждения примесей. Помимо этого, при загрязнении электролита на катоде начинается рост дендритов, что приводит к замыканию электродов, а на аноде – кристаллизация солей, ведущая к пассивации анодов. Электролит не годен к дальнейшему использованию, если концентрация золота в нем ниже 100 г/л, а концентрация примесей выше следующих пределов, г/л: 90 – Сu; 50 – Pt; 15 – Pd; 1,5 – Pb; 4 – Те; 2 – Fe. Для переработки отработанный электролит заливают в специальные ванны, где электролизом с нерастворимыми анодами из него извлекают большую часть золота. Катодами служат тонкие золотые пластины, аноды изготавливают из графита. Процесс ведут при постоянном токе плотностью 200…500 А/м2. Из полученного раствора хлористым аммонием осаждают платину и палладий, а затем с помощью раствора хлористого железа осаждают остатки золота. Медь цементируют железом. 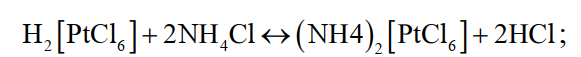 Возможны и другие методы переработки отработанного электролита, в частности с применением ионообменных смол. Свежий электролит готовят электрохимическим растворением относительно чистых сплавов золота, получаемых чаще всего в результате обработки анодного шлама серебряного электролиза. Растворение ведут в специальных ваннах круглой формы, снабженных диафрагмами из пористого фарфора, глины или ионообменной пленки. В диафрагму завешивают 6…8 анодов и заливают соляную кислоту плотностью 1190 кг/м3 разбавленную водой в отношении 3:1. По обе стороны от диафрагмы подвешивают катоды – тонкие пластины из золота или графита. В катодное пространство заливают более разбавленную (1:3) соляную кислоту. При пропускании постоянного тока на аноде растворяется золото, на катоде — восстанавливается водород. Суммарная реакция выражается следующим уравнением 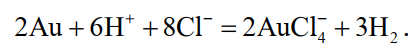 Процесс ведут с помощью постоянного тока плотностью 800…2000 А/м2. Напряжение на ванне для диафрагмы из ионообменной пленки составляет до 4 В, для диафрагмы из глины — до 14 В. Температура электролита 60…90 °С. Полученный раствор содержит 200…300 г/л Аu и 45…80 г/л соляной кислоты. Его разбавляют водой и заливают в ванны основного электролиза. Свежий электролит можно также готовить растворением катодного золота в соляной кислоте при пропускании газообразного хлора. Достоинством процесса электролитического рафинирования золота является не только возможность получения высокочистого металла, удовлетворяющего требованиям современной техники, но и попутное извлечение металлов платиновой группы, теряемых при аффинаже хлорированием. В ЮАР электролитическому рафинированию подвергают часть золота, прошедшего аффинаж хлорированием. При этом на электролиз предпочтительнее направлять те партии золота, в которых содержатся металлы платиновой группы. На рис. 9 представлена описанная выше технологическая схема электролитического разделения серебряно-золотого сплава с содержанием золота в нем менее 30 % методом двойного электролиза. 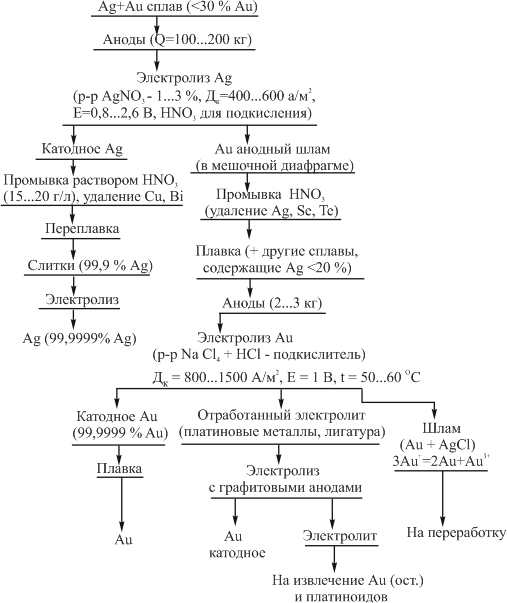 Рисунок 6 – Технология электролитического разделения серебрянозолотого сплава Кислотные методы аффинажа применяют при обработке сплавов драгоценных металлов различными кислотами, причем примеси и один из драгоценных металлов переходят в раствор, а второй остается в нерастворимом остатке. Способ очистки при помощи азотной кислоты основан на избирательном растворении серебра. Для полного разделения металлов необходимо, чтобы содержание серебра в сплаве, по меньшей мере, в два (а лучше в три) раза превышало содержание золота. При этом условии обработка сплава горячей азотной кислотой позволяет полностью перевести серебро в раствор, а золото оставить в нерастворимом остатке. Перешедшее в раствор серебро осаждают в виде хлорида, восстанавливают металлическим железом или цинком и переплавляют в слитки. Золотой остаток промывают, сушат и плавят в слитки чистотой до 99,8 %. Гранулированный или отлитый в тонкие пластины сплав загружают в чугунные котлы и заливают концентрированной серной кислотой. При нагревании серебро, медь и другие недрагоценные металлы переходят в раствор. Золото остается в нерастворимом остатке. По окончании процесса сернокислый раствор сливают, а оставшийся золотой осадок для окончательной очистки обрабатывают новой порцией концентрированной серной кислоты. Полученное в результате этих операций золото промывают, сушат и переплавляют в слитки 99,6…99,9 %. Из сернокислого раствора, содержащего серебро, медь и небольшое количество других металлов, с помощью металлической меди при нагревании осаждают серебро. . ЗАКЛЮЧЕНИЕ Кислотные методы аффинажа громоздки, дороги и не позволяют получать драгоценные металлы той степени чистоты, которая необходима для современной промышленности. Из-за этих недостатков кислотные методы в настоящее время применяются ограниченно. Иногда их используют для предварительного разделения драгоценных металлов перед окончательным аффинажем их электрохимическим методом. СПИСОК ЛИТЕРАТУРЫ Звягинцев O.Е. Аффинаж золота, серебра и металлов платиновой группы М.: 1945. – 244 с. Зырянов М.Н., Леонов С.Б. Хлоридная металлургия золота М.: 1974-448c. Карпухин А.И. Кислотно-солевой аффинаж золота и серебра., Иркутск: Иргиредмет, 2003-506с. Чугаев Л.В. Металлургия благородных металлов Изд: Металлургия 1987- 432 с. |
