Расчёт распределения марганца и фосфора между металлом и шлаком в электросталеплавильном процессе
 Скачать 45.63 Kb. Скачать 45.63 Kb.
|
|
Министерство образования и науки РФ ФГАОУ ВПО Уральский федеральный университет имени первого Президента России Б.Н. Ельцина Институт материаловедения и металлургия «Металлургия железа и сплавов» ОТЧЕТ По практической работе №2 На тему «Расчёт распределения марганца и фосфора между металлом и шлаком в электросталеплавильном процессе» Преподаватель Некрасов И.В Студент Дресвянкин К.А Группа 372202 2020 г. Цель работы Задание. Рассчитать значения активностей (FeO), (MnO) и (P2O5) в шлаке. Рассчитать значения коэффициентов активности [Mn] и [Р] в металле. Рассчитать значение константы равновесия реакции окисления [Mn]. Для фосфора – принять значение константы равновесия 0,0229. Рассчитать значения равновесных концентраций [Mn] и [Р] в металле. Краткая теоретическая часть. Для заданного состава металла (фактические данные пробы, отобранной из ДСП Первоуральского новотрубного завода) рассчитать концентрацию марганца и фосфора в металле, равновесную со шлаком окислительного периода плавки в основной электродуговой печи при температуре 16000С. 2. Исходные данные. Состав шлака нужно брать из 1-го задания. Состав металла задан в excel-файле «2 задание». Параметры взаимодействия компонентов металлического расплава – в том же файле. 2.1. Краткое изложение теории. Распределение марганца между металлом и шлаком определяется равновесием реакции [Mn] + (FeO) = (MnO) + [Fe]. 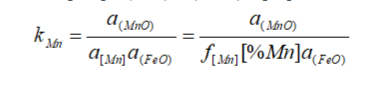 lg kMn = 7572/T – 3,599 Распределение фосфора между металлом и шлаком согласно В.А.Кожеурову описывается равновесием реакции 2[P] + 5(FeO) = (P2O5) +5[Fe]. 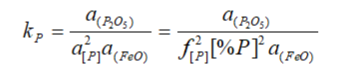 По данным В.А.Кожеурова для интервала температур 1550-17100С значение kP изменяется незначительно и принимается постоянным: kP = 0,0229. 2.2. Составы шлака и металла, активности компонентов. Расчет активностей компонентов шлака произвести по теории регулярных ионных растворов В.А.Кожеурова. Расчет коэффициентов активности Mn и Р в металле произвести по методу Вагнера. Порядок выполнения работы Рассчитать значения активностей (FeO), (MnO) и (P2O5) в шлаке. Рассчитать значения коэффициентов активности [Mn] и [Р] в металле. Рассчитать значение константы равновесия реакции окисления [Mn]. Для фосфора – принять значение константы равновесия 0,0229. Рассчитать значения равновесных концентраций [Mn] и [Р] в металле. Расчетная часть
Ход работы Переход к шестикомпонентной системе FeO SiO2 MnO CaO P2O5 MgO Сделали перерасчет (сумма этих оксидов составляет 100%) Посчитали число молей оксида в 100 г шлак (содержание поделили на молярную массу оксида) Посчитали ионную доли ( ni поделили на сумму ni умноженную на число частиц не кислородного элемента в молекуле оксида, который образует данный катион (для FeO n = 1, для P2O5 n = 2)) Выполнили расчет коэффициента активности по формулам Согласно Кожеурову для шестикомпонентной системы FeO, MnO, CaO, MgO, SiO2, P2O5 LggFe = 1000/T*(2,18XMnXSi + 5, 90(XCa + XMg) XSi + 10,50XCaXP) LggMn = lggFe – 2180/T*XSi LggP = lggFe – 10500/T*XCa Выполнили расчет активностей для катионов Fe, Mn, P (умножили ионную долю на коэффициент активности) Рассчитали значения коэффициентов активности [Mn] и [Р] в металле. (использовали метод Вагнера) Рассчитатали значение константы равновесия реакции окисления [Mn]. (по формуле lg kMn = 7572/T – 3,599 Для фосфора – приняли значение константы равновесия 0,0229. Рассчитали значения равновесных концентраций [Mn] в металле (активность оксила MnO поделили на произведение коэффициента активности на активность FeO на константу равновесия между металлом и шлаком Рассчитали значения равновесных концентраций [P] ( активность оксида P2O5 поделили на корень из произведения удвоенного коэффициента активности P на активность FeO на константу равновесия меджу металлом и шлаком P Вывод При выполнении работы мы рассчитали значение активностей (FeO), (MnO) и (P2O5) для шлака сверхмощной электропечи получили 0,536332 0,057067 1,7E-05 соответственно. Получили значение коэффициентов активности [Mn] и [Р] в металле 0,9795464 1,0489636 соответственно. Рассчитали значение константы равновесия реакции окисления [Mn] получили 13,59878. Для фосфора – приняли значение константы равновесия 0,0229. Рассчитали значения равновесных концентраций [Mn] и [Р] в металле 0,007988 0,03594 соответственно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
