вариант 2 МИрзосалиев. Расчет ректификационной установки
 Скачать 295.68 Kb. Скачать 295.68 Kb.
|
Курсовая работа на тему: «Расчет ректификационной установки» Студент: Мирзосалиев Г.М. Группа: ЗХТ-1-19 Казань, 2022 Исходные данные- Ацетон-вода. Легколетучему компоненту присваивается номер 1, а другому компоненту – номер 2; - расход исходной смеси F=8, кг/с и ее состав 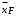 = 8 в массовых долях; = 8 в массовых долях;- концентрация 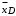 =92 легколетучего компонента в дистилляте, массовые доли; =92 легколетучего компонента в дистилляте, массовые доли;- концентрация 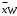 =2 легколетучего компонента в кубовом остатке, массовые доли; =2 легколетучего компонента в кубовом остатке, массовые доли;- Колпачковая; - давление (абсолютное) греющего водяного пара, 0,6 МПа; - температура исходной смеси=12 перед подогревателем, температура дистиллята и кубового остатка из холодильников=20 ВведениеРектификация известна с начала XIX века как один из важнейших технологических процессов главным образом спиртовой и нефтяной промышленности. В настоящее время ректификацию все шире применяют в самых различных областях химической технологии, где выделение компонентов в чистом виде имеет весьма важное значение (в производствах органического синтеза, изотопов, полимеров, полупроводников и различных других веществ высокой чистоты). Ректификационные установки по принципу действия делятся на периодические и непрерывные. В установках непрерывного действия разделяемая сырая смесь поступает в колонну и продукты разделения выводятся из нее непрерывно. В установках периодического действия разделяемую смесь загружают в куб одновременно и ректификацию проводят до получения продуктов заданного конечного состава [1]. При разработке ректификационной колонны с ситчатыми тарелками необходимо, как правило, решать задачи: 1) рассчитать материальный баланс колонны и определить рабочее флегмовое число; 2) анализ тепловых процессов, осуществляющихся в греющем паре куба колонны; 3) конструирование ректификационной колонны с ситчатыми тарелками. 1. Общие сведения о ректификацииРектификация - массообменный процесс разделения однородной смеси летучих компонентов, осуществляемый путем противоточного многократного взаимодействия паров, образующихся при перегонке, с жидкостью, образующейся при конденсации этих паров. Разделение жидкой смеси основано на различной летучести веществ. При ректификации исходная смесь делится на две части: дистиллят - смесь, обогащенную низкокипящим компонентом (НК), и кубовый остаток - смесь, обогащенную высококипящим компонентом (ВК). Процесс ректификации осуществляется в ректификационной установке основным аппаратом, которой является ректификационная колонна, в которой пары перегоняемой жидкости поднимаются снизу, а навстречу парам стекает жидкость, подаваемая в виде флегмы в верхнюю часть аппарата. Процесс ректификации может протекать при атмосферном давлении, а также при давлениях выше и ниже атмосферного. Под вакуумом ректификацию проводят, когда разделению подлежат высококипящие жидкие смеси. Повышенное давление применяют для разделения смесей, находящихся в газообразном состоянии при более низком давлении. Атмосферное давление принимают при разделении смесей, имеющих температуру кипения от 30 до 150°С. Степень разделения смеси жидкостей на составляющие компоненты и чистота получаемых дистиллята и кубового остатка зависят от того, насколько развита поверхность контакта фаз, от количества подаваемой на орошение флегмы и устройства ректификационной колонны. В промышленности применяют тарельчатые, насадочные, пленочные трубчатые и центробежные пленочные аппараты. Они различаются в основном конструкцией внутреннего устройства аппарата, назначение которого - обеспечение взаимодействия жидкости и пара. ацетон вода ректификационная колонна Преимущественное использование тарельчатых колонн в процессах перегонки объясняется их значительно большей производительностью по сравнению с насадочными. При выборе ректификационной колонны для проектируемого разделения следует иметь ввиду, что тарельчатые колонны очень малого диаметра значительно дороже соответствующих насадочных колонн, однако по мере увеличения диаметра стоимость насадочных колонн возрастает значительно быстрее. Приблизительно можно считать, что стоимость насадочной колонны растет пропорционально квадрату диаметра, а колпачковой - диаметру в первой степени. Следовательно, за пределами некоторого граничного значения диаметра использование тарельчатых колонн должно быть более экономичным. Длительный опыт промышленной эксплуатации насадочных колонн показал целесообразность их использования при диаметрах не более 0,8 м. При дальнейшем увеличении диаметра насадочной колонны ухудшается равномерное распределение флегмы по насадке, образуются каналы, по которым преимущественно устремляется флегма, и эффективность колонны резко снижается. Наиболее распространены колпачковые тарельчатые колонны, хотя в последнее время получили преимущество ситчатые, клапанные, чешуйчатые и другие более эффективные виды барботажных устройств, главным назначением которых является максимальное развитие межфазного контакта, что способствует интенсификации массообмена между парами и флегмой. Помимо этого выбор типа контактного устройства определяется и такими факторами, как экономия материала, стоимость, легкость изготовления, чистки и ремонта, стойкость к коррозии, малое падение напора при прохождении паров, широта диапазона устойчивой работы тарелки [1]. Ректификационная колонна - аппарат, предназначенный для разделения жидких смесей, составляющие которых имеют различную температуру кипения. Классическая колонна представляет собой вертикальный цилиндр с контактными устройствами внутри. Ректификация известна с начала XIX века как один из важнейших технологических процессов главным образом спиртовой и нефтяной промышленности. В настоящее время ректификацию все шире применяют в самых различных областях химической технологии, где выделение компонентов в чистом виде имеет весьма важное значение (в производствах органического синтеза, изотопов, полимеров, полупроводников и различных других веществ высокой чистоты). В ректификационную колонну подаются пары перегоняемой жидкости. Они поднимаются снизу, а в режиме противотока навстречу парам идёт жидкость, сконденсировавшаяся наверху в холодильнике. В случае, если разгоняемый продукт состоит из двух компонентов, конечными продуктами являются дистиллят, выходящий из верхней части колонны и кубовый остаток (менее летучий компонент в жидком виде, вытекающий из нижней части колонны). Ситуация усложняется, если необходимо разделить смесь, состоящую из большого количества фракций. В этом случае используются аппараты, подобные изображенному на картинке. Ректификационные установки по принципу действия делятся на периодические и непрерывные. В установках непрерывного действия разделяемая сырая смесь поступает в колонну и продукты разделения выводятся из нее непрерывно. В установках периодического действия разделяемую смесь загружают в куб одновременно и ректификацию проводят до получения продуктов заданного конечного состава. Промышленные ректификационные колонны могут достигать 60 метров в высоту и 6 метров диаметре. В ректификационных колоннах в качестве контактных устройств применяются тарелки, которые дали название химическому термину, и насадки. Насадка, заполняющая колонну, может представлять из себя металлические, керамические, стеклянные и другие элементы различной формы. Конденсация осуществляется на развитой поверхности этих элементов. 2. Свойства бинарной смеси1. Ацетон (диметилкетон, систематическое наименование: пропаноон-2) - простейший представитель кетонов. Формула: CH3 -C (O) - CH3 . Бесцветная легкоподвижная летучая жидкость с характерным запахом. Он полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, жиры, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Является одним из метаболитов, производимых человеческим организмом. Мировое производство ацетона составляет более 3-х миллионов тонн в год. В промышленности получается напрямую или косвенно из пропена. Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Алкилированием бензолапропеном, окислением полученного кумола до гидропероксида с последующим разложением его на фенол и ацетон. C6 H6 + CH3 CH=CH2 → C6 H5 CH (CH3 ) 2 C6 H5 CH (CH3 ) 2 + O2 → C6 H5 C (OOH) (CH3 ) 2 C6 H5 C (OOH) (CH3 ) 2 → C6 H5 OH + OC (CH3 ) 2 Прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при 50-120°C и 50-100 атм. CH3 CH=CH2 + PdCl2 + H2 O → CH3 C (O) CH3 + Pd + 2HCl Pd+2HCl + 0.5O2 → PdCl2 + H2 O Некоторое значение имеет метод брожения крахмала под действием Bacyllus acetobutylicus с образованием ацетона и бутанола. Метод характеризуется малыми выходами. Используется также методы получения из изопропилового спирта и ацетилена. Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение CH3 C (O) CH3 + NaHSO3 → (CH3 ) 2 C (OH) - SO3 Na Вступает в альдольную самоконденсацию под действием щелочей, с образованием диацетонового спирта. 2CH3 C (O) CH3 → (CH3 ) 2 C (OH) CH2 C (O) CH3 Восстанавливается цинком до пинакона. 2CH3 C (O) CH3 + Zn → (CH3 ) 2 C (OH) C (OH) (CH3 ) 2 При пиролизе (700°C) образует кетен. CH3 C (O) CH3 → CH2 =C=O Легко присоединяет циановодород с образованием ацетонциангидрина. CH3 C (O) CH3 + HCN → (CH3 ) 2 C (OH) CN Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ). Ацетон, как и другие кетоны, в щелочной среде способен изомерироваться в пропаналь, последний - до пропенового спирта. В кислой среде и в присутствии ионов двухвалентной ртути, пропеновый спирт изомерируется сразу в ацетон. Между этими веществами всегда существует таутомерное равновесие: CH3 C (O) CH3 ↔ С2 Н5 СОН ↔ СН2 =С (ОН) - СН3 В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи - 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое - с мочой. Сырьё для синтеза многих важных химических продуктов: уксусного ангидрида, кетена, диацетонового спирта, окиси мезитила,метилизобутилкетона, метилметакрилата, дифенилпропана, изофорона, бифенола А и др.; (CH3 ) 2 CO + 2 C6 H5 OH → (CH3 ) 2 C (C6 H4 OH) 2 + H2 O 2. Вода - оксид водорода - одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, - она всегда содержит примеси. Получают чистую воду методом перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода. Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0° С (1 г/см3 ). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0° С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода - хороший растворитель. Молекула воды имеет угловую форму атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды - диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, - отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы. В жидкой воде наряду с обычными молекулами Н2 0 содержатся ассоциированные молекулы, т.е. соединенные в более сложные агрегаты (Н2 О) x благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4° С, высокая температура кипения (в ряду Н2 0-Н2 S - Н2 Sе) аномально высокая теплоемкость [4,18 кДж/ (г К)]. С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар. Вода - весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты. Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из других осушающих веществ можно указать Р2 05 , СаО, ВаО, металлический Ма (они тоже химически взаимодействуют с водой), а также силикагель. К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения []. Таблица 1. Равновесный состав смеси ацетон-вода
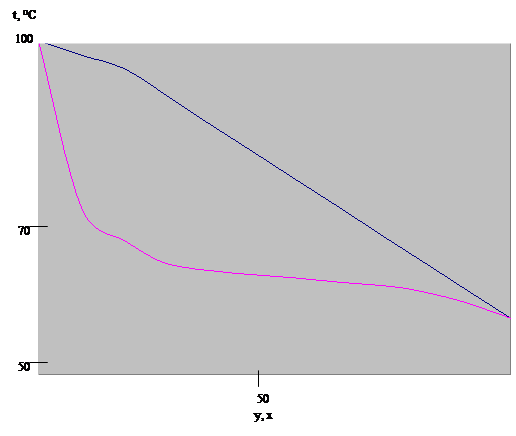
Рис.1. Диаграмма t-x,yдля смеси ацетон - вода. 3. Материальный баланс колонны3.1 Производительность колонны по дистилляту и кубовому остаткуТаблица 2. Температуры кипения и молекулярные массы разделяемых компонентов
Обозначим массовый расход дистиллята GD кг/с, кубового остатка через GW кг/с, тогда  6 гк/c, GD*0.92+GW*0.02=0,35*8 кг/с 6 гк/c, GD*0.92+GW*0.02=0,35*8 кг/с 8*(0.92-0.08)/(0.92-0.02)=7.46 , 8*(0.92-0.08)/(0.92-0.02)=7.46 , 8-7.46=0.54 кг/c 8-7.46=0.54 кг/cПитание:  (80/58)/(20/58+(100-20/18))=1.35/4.78= (80/58)/(20/58+(100-20/18))=1.35/4.78==0.28 Дистиллят:  (90/58)/(90/58+((100-90)/18)=1.55/0.55= (90/58)/(90/58+((100-90)/18)=1.55/0.55==0.73 Кубовый остаток:  (20/58)/(20/58)+((100-20)/18)= (20/58)/(20/58)+((100-20)/18)==0.3/4.74=0.06 Относительный мольный расход питания  (0.73-0.06)/(0.28-0.06)=0.67/0.22=3.04 (0.73-0.06)/(0.28-0.06)=0.67/0.22=3.043.2 Расчет оптимального флегмового числа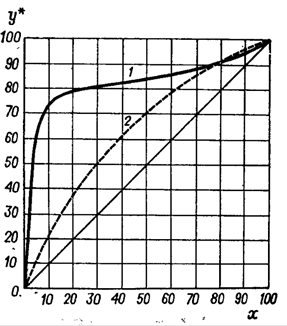 Рис.2. Кривые равновесия при П=760 мм рт. ст.: 1 - ацетон-вода; 2 - четыреххлористый углерод-ацетон. Минимальное число флегмы  (0.90-0.76)/(0.76-0.08)=0.2058 (0.90-0.76)/(0.76-0.08)=0.2058Где  1.3*0.2058+0.3=0.56 1.3*0.2058+0.3=0.56Уравнения рабочих линий а) верхней (укрепляющей) части колонны  ((0.56/0.56+1)*x)+(0.90/0.56+1)=0.3589x+0.5769 ((0.56/0.56+1)*x)+(0.90/0.56+1)=0.3589x+0.5769y=0.3589x+0.5769 б) нижней (исчерпывающей) части колонны 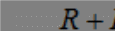 ((0.56+8)/(0.56+1)*x)-(8-1)/(0.56+1) ((0.56+8)/(0.56+1)*x)-(8-1)/(0.56+1)y=5,481x-0,001 4. Определение скорости пара и диаметра колонны4.1 Определение скорости пара в колоннеСредние концентрации жидкости а) в верхней части колонны  (0.28+0.73)/2=0.505 (0.28+0.73)/2=0.505б) в нижней части колонны  (0.28+0.002)/2=0.141 (0.28+0.002)/2=0.141Средние уравнения пара находим по уравнениям рабочих линий: а) в верхней части колонны y`cp=0.3589x+0.5769=0.3589*0,505+0.5769=0.758 б) в нижней части колонны y``ср=5,481xср``-0,001=5,481*0.141-0,001=0.772-0.001=0.771 Средние температуры пара определяем по диаграмме t-x,y: а) при y`cp=0.758 б) при y``ср=0.771 Средние мольные массы и плотности пара: а)M`ср=0.505*58+0.758*18= 29.29+13.644=13.644 кг/кмоль  (13.644*273)/(22.4*332)=0.500 кг/м(3) (13.644*273)/(22.4*332)=0.500 кг/м(3)б) M``ср=0.141*58+0.771*18=8.178+13.878=22.056 кг/моль  (22.056*273)/(22.4*343)=6021.2/7683.2=0.783 кг/м(3) (22.056*273)/(22.4*343)=6021.2/7683.2=0.783 кг/м(3)Средняя плотность пара в колонне  (0.500+0.783)/2=0.641 (0.500+0.783)/2=0.641Температура в верху колонны при xD=0,92 равняется 57о С, а в кубе-испарителе при xW=0,002 она равна 97о С. Плотность жидкого ацетона при 57о С Принимаем среднюю плотность жидкости в колонне Определяем скорость пара в колонне 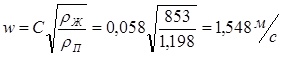 , ,где С - коэффициент, зависящий от конструкции тарелок, расстояния между тарелками, рабочего давления в колонне, нагрузки колонны по жидкости. Объемный расход проходящего через колонну пара при средней температуре 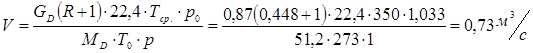 Где М D- мольная масса дистиллята, равная: 4.2 Определение диаметра колонныДиаметр колонны 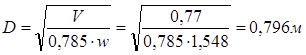 По каталогу-справочнику "Колонные аппараты" [4] D=800 мм. Тогда скорость пара в колонне будет 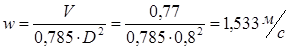 По ОСТ 26-01-108-85 определяем: Диаметр колонны - 800 мм. Расстояние между тарелками - 300 мм. Высота сливного порога - 25 мм. Диаметр отверстия - 5 мм. Шаг - 15 мм. Исполнение - 1. Материал для изготовления - углеродистая сталь ВСт3сп. Гидравлический расчет ректификационной колонны с колпачковыми тарелкамиРасчет максимальной скорости пара в колонне 1. Расстояние между тарелками принимается равным 450 мм. Максимальную скорость паровой фазы по А и Б секциям находится по формуле (5.18) - (5.20). В соответствии с рис. 5.3 находится значение С1=560. Определяется значение коэффициента 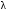 для А и Б секций колонны по формуле (5.20): для А и Б секций колонны по формуле (5.20):а) 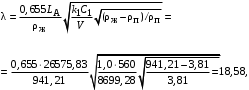  , ,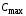 =8,47×10-5[k1C1-k2(l-35)]=8,47∙10-5[1,0×560-4(18,58-35)]=0,053, =8,47×10-5[k1C1-k2(l-35)]=8,47∙10-5[1,0×560-4(18,58-35)]=0,053,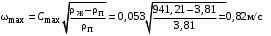 . .б) 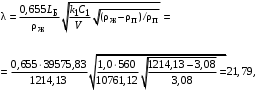 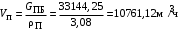 , ,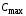 =8,47×10-5[k1C1-k2(l-35)]=8,47∙10-5[1,0×560-4(21,79-35)]=0,0519, =8,47×10-5[k1C1-k2(l-35)]=8,47∙10-5[1,0×560-4(21,79-35)]=0,0519,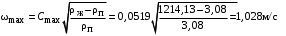 . .Определение диаметра аппарата 1. По значению wmax рассчитываются диаметры А и Б - секций колонны (5.21): 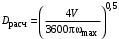 ; ;а) Dрасч= 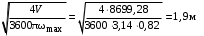 , ,б) Dрасч= 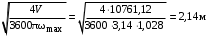 . .В соответствии с нормальным рядом диаметров колонн примем Dк=2 м (табл. 13 прил.). 2. По значению выбранного диаметра уточняется значение рабочей скорости пара в секциях колонны (5.22): 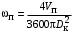 ; ;а) 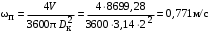 , ,б) 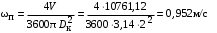 . .Конструктивные параметры заданного типа контактного устройства Расчет гидравлического сопротивления колпачковой тарелки 1. Рассчитывается сопротивление сухой тарелки, Па (5.23): 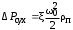 , ,где x=4,0-5,0 для колпачковой тарелки. Определяем скорость пара в отверстиях тарелки а) для верхней части колонны: 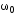 = =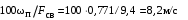 , ,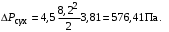 б) для нижней части колонны: 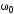 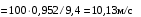 , ,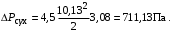 2. Определяется расход жидкости на единицу периметра слива (5.25) а) для верхней части колонны: 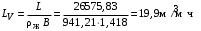 . .б) для нижней части колонны: 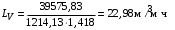 . .3. Коэффициент К2, учитывающий сжатие потока жидкости: а) В/D=1,418/2=0,709; б) В/D=1,418/1,8=0,709; К2=1,1, К2=1,1. 4. Подпор жидкости над сливным устройством находится по формуле (5.26): а) для верхней части колонны: 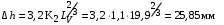 . .б) для нижней части колонны: 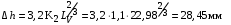 . .5. Определяется сопротивление слоя жидкости на колпачковой тарелке (5.29): 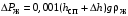 ; ;а) для верхней части колонны: 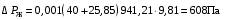 . .б) для нижней части колонны: 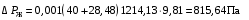 . .6. Определяется общее гидравлическое сопротивление колпачковой тарелки, Па (5.30): 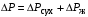 ; ;а) для верхней части колонны: 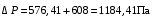 . .б) для нижней части колонны: 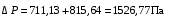 . .Общее гидравлическое сопротивление колонны составит (5.31) а) для верхней части колонны: 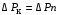 =1184,41×15=17766,15 Па. =1184,41×15=17766,15 Па.б) для нижней части колонны: 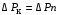 =1526,77×35=53436,95 Па. =1526,77×35=53436,95 Па.Расчет межтарельчатого уноса жидкости 1. Рассчитывается коэффициент m, используемый в формуле для уноса жидкости (5.32) 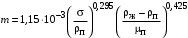 ; ;а) для верхней части колонны: 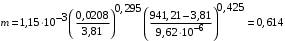 . .б) для нижней части колонны: 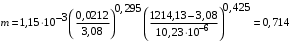 . .2. Унос жидкости с тарелки, кг/кг, находится по формуле (5.33): 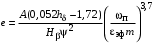 ; ;а) для верхней части колонны: 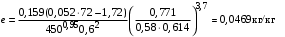 . .б) для нижней части колонны: 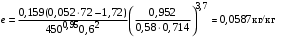 . .Проверка работоспособности тарелок 1. Сопротивление движению жидкости в переливе, Па, (5.35): 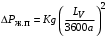 ; ;а) для верхней части колонны: 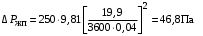 . .б) для нижней части колонны: 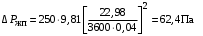 . .2. Высота слоя невспененной жидкости в сливном устройстве, мм, находится по формуле (5.36): 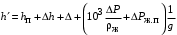 ; ;а) для верхней части колонны: h¢= 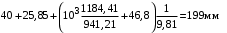 . .б) для нижней части колонны: h¢= 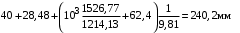 . .3. Определяется величина вылета ниспадающей струи в переливе (5.37); 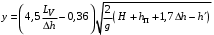 ; ;а) для верхней части колонны: 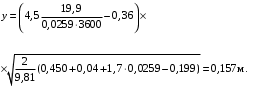 б) для нижней части колонны: 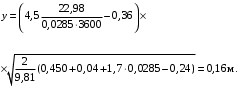 4. Высчитывается высота парожидкостного слоя в переливе, мм (5.38); а) для верхней части колонны: 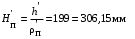 . .б) для нижней части колонны: 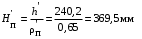 . .5. Определяется максимальная ширина сливного устройства, м (5.39): 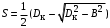 ; ;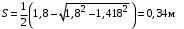 . .6. Минимальная допустимая скорость пара, м/с в А и Б – секциях для колонны с колпачковыми тарелками находится по формуле (5.43): 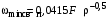 ; ;а) для верхней части колонны: 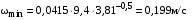 . .б) для нижней части колонны: 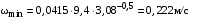 . .Проверяются условия работоспособности колпачковых тарелок. По результатам гидравлического расчета выбранные колпачковые тарелки диаметром 2,0 м обеспечивают выполнение условий работоспособности контактных устройств в А и Б секциях: - высота парожидкостного слоя H¢п в переливе меньше расстояния между тарелками; - вылет струи y меньше ширины перелива S; - диапазон устойчивой работы колпачковых тарелок N 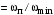 находится около четырех. Следовательно производительность колонны может быть уменьшена почти в четыре раза без значительного снижения эффективности разделения смеси. находится около четырех. Следовательно производительность колонны может быть уменьшена почти в четыре раза без значительного снижения эффективности разделения смеси.Расчет числа реальных колпачковых тарелок 1. По справочным данным или расчетным путем находится мольный объем 1-го компонента u1, см3/моль. 2. Рассчитывается коэффициент диффузии в жидкой фазе (5.44) 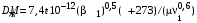 ; ;Dж= 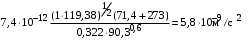 . .3. Находится средний КПД колпачковой тарелки (5.45), (5.46): 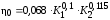 , ,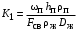 ; ; 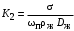 . .а) 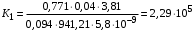 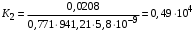 , ,КПД в верхней секции 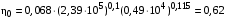 . .б) 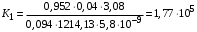 , ,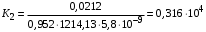 , ,КПД в нижней секции 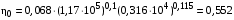 . .4. Рассчитывается число реальных тарелок 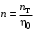 ; ;а) для верхней части колонны: 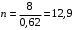 . .б) для нижней части колонны: 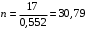 . .Число реальных тарелок с запасом 20 % в верхней секции – 15, в нижней – 35, всего – 50. 5. Вычисляется высота обечайки аппарата Ноб: Ноб=(n-1)Н=(50-1)0,45=22,05 м. Выводы Судить об эффективности использования ситчатых, клапанных или колпачковых тарелок можно, сравнив технические характеристики колонн, приведенные в табл. 5.3. Таблица 5.3. Характеристики колонн с ситчатыми, клапанными и колпачковыми тарелками
Как следует из представленных результатов колонна с клапанными тарелками имеет меньшие габариты, чем остальные. Окончательный выбор конструктивного исполнения ректификационных колонн обычно производится после всестороннего технико – экономического анализа и некоторых особенностей разделения различных смесей (наличия ПАВ, механических примесей, полимерообразования и т.д.). Список использованной литературы1. Иоффе И.Л. Проектирование процессов и аппаратов химической технологии. - Л.: Химия, 1991. - 352с. 2. Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов химической технологии. - Л.: Химия, 2006. - 576с. 3. Плановский А.Н., Рамм В.М., Каган С.З. Процессы и аппараты химической технологии. М.: Госхимиздат, 1962. - 546 с. 4. Электронный ресурс - http://spetsmashservis. narod.ru/katalog_kolon.html | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||