Азеоп, перегонка. Рассмотрели общие свойства идеальных (очень разбавленный) растворов неэлектролитов, которые испаряются растворителем
 Скачать 48.9 Kb. Скачать 48.9 Kb.
|
|
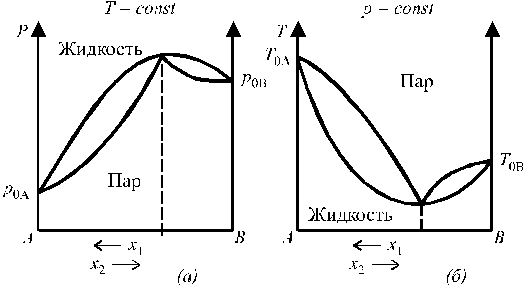
Рассмотрели общие свойства идеальных (очень разбавленный) растворов неэлектролитов, которые испаряются растворителем. Возможны три случая взаимной растворимости жидкостей: 1. жидкости смешиваются друг с другом в любых соотношениях, образуя однородную, однофазную систему (вода + этиловый спирт); 2. обладают ограниченной взаимной растворимостью (вода + эфир); 3. практически нерастворимы друг в друге (вода+ртуть) Первый случай представляет собой один из вариантов образования истинного раствора. Он не имеет особых специфичных свойств, поэтому здесь разбираться не будет. Определенный интерес представляет случай с ограниченной растворимостью жидкостей. При смешивании малорастворимых друг в друге жидкостей образуется неустойчивая эмульсия, которая после некоторого отстаивания образует два слоя из насыщенных растворов. Для нашего примера это будут: внизу слой воды, насыщенный эфиром и сверху слой эфира, насыщенный водой. Взаимная растворимость таких жидкостей зависит от температуры, повышение которой может привести к неограниченному смешиванию этих жидкостей. Проанализировать влияние температуры на взаимную растворимость жидкостей можно с помощью кривой расслоения. Общий вид кривой расслоения для ограниченно растворимых друг в друге жидкостей А и В показан на рис. 5.6. 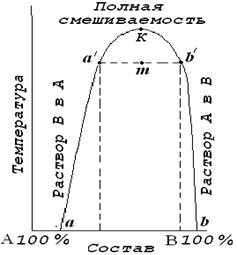 Рис. 5.6. Диаграмма взаимной растворимости жидкостей А и В при различных температурах. Рис. 5.6. Диаграмма взаимной растворимости жидкостей А и В при различных температурах.Кривые аа′К и Кb′b представляют собой кривые взаимной растворимости жидкостей (их называют также кривыми расслоения): В в А и А в В соответственно. Обе кривые сходятся в точке К, которая отвечает некоторой критической температуре растворения этих жидкостей. Область, находящаяся выше этой точки, представляет собой зону, где жидкости неограниченно смешиваются между собой. Любые точки, расположенные вне области аа′Кb′b отвечают гомогенным ненасыщенным растворам. Точки, находящиеся внутри области аа′Кb′b, соответствуют системе, состоящей из двух слоев растворов, составы которых в свою очередь определяются точками пересечения соответствующей изотермы с кривой аа′Кb′b. Например, смесь состава m будет расслаиваться на насыщенные растворы, составы которых отвечают точкам а′ и b′. Соотношения между составами равновесных растворов и их паров, а также общим давлением пара над раствором были установлены Д.П. Коноваловым в 1881 году и носят название законов Коновалова. Первый закон Коновалова гласит: общее давление пара над раствором растёт с ростом доли в растворе легколетучего компонента. На этом явлении основана фракционная перегонка (ректификация), позволяющая разделить смесь взаимнорастворимых жидкостей. Второй закон Коновалова касается более частных случаев. Для некоторых реальных растворов с большими отклонениями от закона Рауля на кривых «общее давление пара – состав» могут появляться минимумы или максимумы. Второй закон Коновалова можно сформулировать следующим образом: в точках экстремумов на кривых общего давления насыщенного пара (или температур кипения) составы пара и сосуществующего с ним в равновесии жидкого раствора совпадают. Диаграммы состояния бинарных систем с максимумом на кривой давления пара и минимумом на кривой температур кипения представлены на рис. 6.
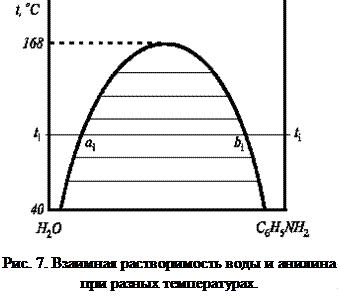
Рис. 6. Диаграммы состояния бинарных систем с максимумом на кривой давления пара (а) и минимумом на кривой температур кипения (б). Растворы, у которых состав жидкой фазы и пара одинаковы, называются азеотропными, или нераздельнокипящими. Путём перегонки азеотропные растворы не разделяются (составы фаз равны). Но их можно разделить следующими методами: - путём химического связывания одного из компонентов; - путем добавления в систему третьего компонента; Простая перегонка жидких смесей. Для разделения смесей жидкостей на практике часто используют метод перегонки, который основан на различии в составах пара и жидкости, из которой пар получен. Рассмотрим диаграмму кипения двухкомпонентной системы, состоящей из двух неограниченно смешивающихся жидкостей А и В. 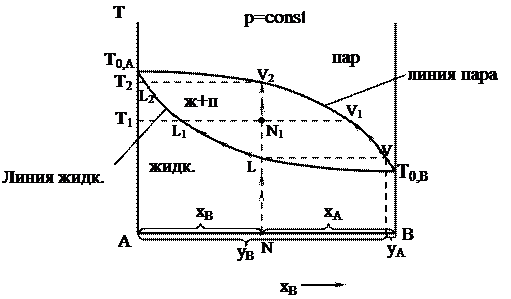 T0,A > T0,B Возьмем жидкость определенного состава, характеризующегося точкой N, и начнем её постепенно нагревать при p=const. Этому процессу соответствует перемещение фигуративной точки по вертикальной прямой NL. В фазовой точке L (от liquid – жидкость), лежащей на кривой жидкости, начинается переход жидкости в пар. Здесь видно, что уВ > хВ (компонента В в паре больше, чем в жидкости), т.е. в соответствии с первым законом Коновалова, пар, по сравнению с жидкостью, обогащен более летучим компонентом В. При дальнейшем повышении температуры фигуративная точка суммарного состава всей смеси будет подниматься вверх по той же вертикали, а фазовые точки пара и жидкости смещаются соответственно по кривым пара и жидкости. При этом количество жидкости уменьшается, а количество пара - возрастает (в соответствии с правилом рычага). При температуре Т1 состав пара характеризуется точкой V1, а состав жидкости - точкой L1, а суммарный состав смеси - фигуративной точкой N1, лежащей на ноде L1N1V1. При температуре Т2 жидкость полностью переходит в пар состав пара соответствует точке V2, т.е. он имеет такой же состав, как и состав исходной жидкости (точка N). При дальнейшем повышении температуры (выше Т2) фазовое состояние системы не изменяется. В результате простой перегонки в остатке можно получить некоторое количество (обычно небольшое) почти чистого труднолетучего компонента А, а хорошо испаряющийся компонент (В) в результате простой перегонки в чистом виде не выделяется. Существуют жидкости, практически не растворимые одна в другой или растворимые в ограниченных пределах концентраций. Жидкости ограниченно растворимые друг в друге Если смешивать две жидкости с ограниченной растворимостью, то в некотором интервале температур они будут неограниченно смешиваться друг с другом с образованием одной гомогенной фазы (раствора). В другом интервале температур система будет распадаться на две гомогенные фазы: раствор первого компонента во втором и второго компонента в первом. Система в целом гетерогенна, при неизменной температуре состав каждого из равновесных слоев остается постоянным и не зависит от количества той или иной жидкости в смеси. Температура, выше или ниже которой имеет место неограниченная взаимная растворимость компонентов, называется критической. Существуют следующие системы ограниченно растворимых друг в друге жидкостей: 1. Системы с верхней критической температурой растворения (фенол–вода, анилин–вода). В этом случае повышение температуры ведет к увеличению взаимной растворимости жидкостей, так что при некоторой температуре достигается полная взаимная растворимость жидкостей, например при Т =1680С для системы вода–анилин (рис. 7). Кривая abc является кривой расслоения (ликвации). Прямая, соединяющая точки равновесных слоев (сопряженных фаз), например прямая aibi, называется нодой.
2. Системы с нижней критической температурой растворения (триэтиламин–вода). Повышение температуры в этом случае ведет к уменьшению взаимной растворимости жидкостей. 3. Системы с верхней и нижней критическими температурами растворения (вода–никотин). Между двумя критическими температурами существует область, в которой система гетерогенна. Взаимно нерастворимые жидкости. Если жидкости практически не растворимы друг в друге, то система кипит при более низкой температуре, чем температура кипения для каждой отдельной жидкости. Давление насыщенного пара над каждой из таких жидкостей зависит только от температуры: Общее давление пара над системой, состоящей из взаимно нерастворимых жидкостей, равно: Оно превышает давление пара над любой отдельно взятой жидкостью. В результате давление пара над системой становится равным внешнему давлению при более низкой температуре по сравнению с температурами кипения чистых жидкостей. На этом явлении основан метод перегонки с водяным паром. В этом случае, мало летучая жидкость может быть переведена в пар при температуре более низкой, чем температура её кипения, путём совместного кипения с несмешивающейся и химически не взаимодействующей с ней более летучей жидкостью. |