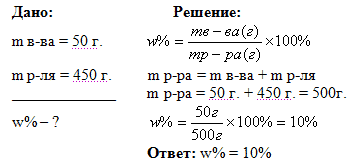|
|
КСП. Урок 1. Растворы. Растворение веществ в воде Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу)
Раздел
|
|
ФИО педагога
|
Кулдошина О.А.
|
Дата
|
14.02.2023
|
Класс
|
Количество присутствующих:
|
отсутствующих:
|
Тема урока
|
Растворы. Растворение веществ в воде
|
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу)
|
8.3.4.1 -классифицировать вещества растворимости в воде
8.3.4.2 -объяснять роль растворов в природе и повседневной жизни
|
Цель урока
|
сформировать представление о растворении как физико-химического процесса, классификации растворов, изучить зависимость растворимости веществ от различных условий.
|
Критерии успеха
|
Учащийся достиг цели обучения, если:
Умеет классифицировать вещества согласно их степени растворимости в воде
Знает знать, что такое растворы и их значение
Определяет состав раствора соли путем выпаривания
Научаться определять насыщенные растворы
|
Ход урока
|
Этапы урока
|
Деятельность учителя
|
Деятельность обучающихся
|
Оценивание
|
Ресурсы
|
Орг. момент
|
Перед началом урока деление на группы.
Приветствие. Отметка отсутствующих. Активизация класса на усвоение новой темы.
Мы приступаем к изучению нового раздела химии. Тему сегодняшнего урока вы назовёте сами, если внимательно прослушаете стихотворение.
Утром встал я спозаранку.
Чай налил, нашёл баранку.
Подмешал я сахарку,
Ложку, две и три – люблю.
Но здесь какой-то непорядок.
И на дне лежит осадок.
А, это третья ложка –
ну, подумайте немножко!
- Тема нашего урока «Растворение. Растворимость веществ в воде». Запишем тему урока в тетрадь
|
Настраиваются на положительный настрой урока.
Формулируют
Цели обучения, критерии оценивания
|
|
Презентация
Слайд 1
Слайд 2
|
Изучение нового материала
|
1. Слово учителя. Растворы играют важную роль в природе, науке и технике. Особую роль на нашей планете играет вода.
Продолжает учитель.
Согласно теории эволюции жизнь на Земле зародилась (?) да, в воде. Главное доказательство этого – сходный химический состав морской воды и крови человека.
А знаете ли вы, что в 1м3 морской воды растворено 0,01мг золота. Общее количество золота в морях и океанах огромно. Если бы его удалось извлечь, то на каждого жителя нашей планеты пришлось бы более 1 тонны золота.
Часто понятие раствор мы связываем, прежде всего, с водой. Но есть и другие растворы: лекарственные настойки, органические растворители (ацетон). Это жидкие растворы. Но есть и твёрдые растворы – сплавы, золотые украшения, газообразные растворы – воздух.
Так что же такое раствор?
Задание 1:
Растворы имеют свою классификацию по содержанию растворенного вещества: 1 группа нам представит эту классификацию.
Задание 2:
Растворы имеют свою классификацию по растворимости: 2 группа нам представит эту классификацию.
Задание 3.
Изучение свойств растворов занимает важное место в современной науке. В химии процессы растворения рассматриваются с позиций трёх теорий:
Физической
Химической
Физико-химической.
3 группа - давайте представим себя в роли сторонников этих теорий. Через несколько минут вы должны объяснить основную идею каждой теории и назвать имена учёных, сторонников этой теории (раздаточный материал)
Также (раздаточный материал)
Задание для группам
Задание для группы 1:
Приведите примеры влияния металлов на организм человека.
Действительно ли металлы и их ионы так опасны для человека? И если удалить металлы из организма, как это отразиться на здоровье человека?
Что нужно сделать, чтобы вернуть металлы в организм человека?
1 группа - натрий и калий
2 группа – кальций и магний
3 группа – алюминий и цинк
4 группа – железо и медь
Презентация каждой группы – защита постера.
Формативное оценивание «Две звезды и желание»
1 группа.
Растворы имеют огромное значение в природе, технике, быту, жизни растений, животных, людей. Растения усваивают питательные вещества, необходимые для их роста и развития в виде растворов из почвы с помощью корневых волосков. Усвоение пищи человеком и животными тоже связано с переводом питательных веществ в раствор.
Все природные воды, а также важнейшие физиологические жидкости-
кровь, плазма - являются растворами. Крови в нашем организме содержится около 5 литров, что составляет 1/10части всей жидкости.
Основная её функция – транспортная - перенос кислорода и питательных веществ по всему организму. Многие реакции также протекают в растворах.
-Что же такое растворы? Из чего они состоят?
(Беседа по плакату «Растворы»)
Растворы - однородные системы, состоящие из частиц растворённого вещества, растворителя.
РАСТВОР = РАСТВОРИТЕЛЬ + РАСТВОРЁННОЕ ВЕЩЕСТВО.
(ВОДА) (ТВЁРДОЕ ВЕЩЕСТВО, ГАЗ,
ЖИДКОСТЬ.)
Перед вами представлены различные растворы (минеральная вода, стакан с водопроводной водой, йодная настойка, нашатырный спирт, туалетная вода, лекарственные препараты).
-Какие ещё вещества, кроме воды, могут выступать в качестве растворителей?
(Спирт, ацетон, бензин).
Все эти примеры жидких растворов.
Существуют растворы и газообразные (воздух), и твёрдые (золотые украшения представляют собой растворы, например, золотые изделия
583 - ой пробы содержат: 58,3% золота, 23,5% меди, 12,2% никеля, 6% цинка; 750 – ой пробы содержат 75% золота, 15% меди, 7,5% никеля, 2,5% цинка). А также всевозможные сплавы.
Но любой раствор состоит из растворённого вещества (одного или нескольких) и растворителя.
Сделайте вывод: какие бывают растворы? (Жидкие, газообразные, твёрдые)
Мы будем рассматривать только водные растворы:
РАСТВОР= Н2О + РАСТВОРЁННОЕ ВЕЩЕСТВО.
(Сообщение ученика о природных водных растворах – Приложение №1).
Проблемный вопрос: А ещё, какие бывают растворы? Работа с учебником - стр.189-190
насыщенные
РАСТВОРЫ ненасыщенные
пересыщенные.
2 группа
Проблемный вопрос:
- Как вы думаете, к каким явлениям - физическим или химическим - относится процесс растворения?
  РАСТВОРЕНИЕ РАСТВОРЕНИЕ
ФИЗИЧЕСКОЕ ЯВЛЕНИЕ
|
ХИМИЧЕСКОЕ ЯВЛЕНИЕ
|
1. Демонстрация растворения КМпО4 в воде.
- За счёт кого процесса происходит
растворение? (диффузии).
Вещество из области более высокой
его концентрации переходит в область
более низкой концентрации.
Процесс завершается выравниванием концентрации.
- К каким явлениям относится диффузия?
(физическим).
- Какие выводы можно сделать по данному эксперименту?
|
2) Мы уже вспоминали о признаках химических реакций. Подумайте, можем ли мы пронаблюдать хотя бы один из этих признаков при растворении? (выдвижение версий).
Демонстрация растворения
Н2SО4(конц.) и NН4NО3 в воде.
(Наблюдается выделение и поглощение теплоты). Как называются подобные реакции (экзотермические и эндотермические).
3) Демонстрация растворения безводных СuСl2 или СuSО4 в воде. (Происходит изменение цвета).
- Какие выводы можно сделать по данным экспериментам?
|
Выводы:
1.Растворение результат диффузии.
2.Растворы - это однородные
смеси.
Значит, растворение - это физическое явление.
|
Выводы:
1.Растворение- это химическое взаимодействие растворённого вещества с водой, называемое гидратацией.
2.Растворы - химические соединения.
Значит, растворение - это химическое явление.
|
Растворение, как и любой химический процесс, можно выразить уравнением реакции. Поэтому более правильно:
РАСТВОР = Н2О + Р.В. + ГИДРАТЫ (продукты взаимодействия Н2О с
растворёнными веществами).
- Ребята, сделайте вывод, к каким же явлениям относится растворение?
Растворение- это физико - химический процесс.
3 группа.
Как вы уже знаете, солёность морской и океанской воды равна 35% . Эта вода непригодна для нужд человека. Пресной же водой, пригодной для питья человеку и животным, считается вода с солёностью менее 1%.
(Стакан с водопроводной водой).
- Какие вещества могут быть растворены в этой воде?
(различные соли, О2, СО2 и другие газы и т. д.)
Рассказ по таблице « Растворы».
- Подберите характеристику воды как растворителю. Это какой растворитель? (Универсальный).
Н2О - универсальный растворитель + твёрдые вещества (соль, сахар…)
+ жидкости (спирт, кислоты…)
+ газы (О2, СО2, аммиак, Н2).
( Демонстрация опытов по растворимости различных веществ).
- Как узнать о растворимости различных веществ в воде? Какие вещества растворимы в воде, а какие – нет?
(По таблице растворимости).
Таблица 9 «Растворимость некоторых солей в воде» стр191, «Таблица растворимости».
- Что можно сказать о растворимости веществ в воде?
( Растворимость веществ в воде разная).
- А что вы можете сказать о веществах, практически нерастворимых в воде? (Практически нерастворимых веществ в воде нет).
Сообщение ученика о практически нерастворимых веществах – Приложение №2.
Вы знаете, что стекло в воде не растворяется, и спокойно пьёте воду из стеклянного стакана. Растолчём в ступке кусок стекла, поместим в пробирку с водой, прибавим несколько капель фенолфталеина. Появление окраски укажет, что некоторое количество вещества перешло в раствор.
(Если окраска сразу не появится, то проводим нагревание).
Обычно мы этого просто не замечаем из-за очень малой величины растворимости стекла в воде и медленности процесса растворения.
Теперь ответьте вопросы:
1.Зачем в опыте по растворимости стекла, мы его измельчали?
2.Зачем нагревали вещества?
Задача 1. Вычислите массовую долю раствора в %, который получится, если 50 г. вещества растворили в 450 г. воды.
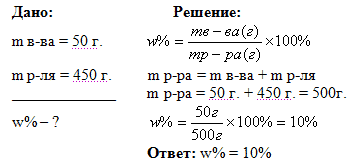
Задача 2. Вычислите массу воды и массу соли, которые необходимо взять, чтобы приготовить 300г раствора с массовой долей 15%.

Индвидуальное работа
Задача 1. Для того, чтобы обработать цветы, Винни-Пуху нужно приготовить 2 кг.2%-ного раствора нитрата натрия. Помогите ему вычислить массу воды и массу соли, которые ему нужно взять?
Задача 2. Героям этого мультфильма нужно обработать музыкальные инструменты некоторым 20%-ным секретным раствором. У них есть 700 г. этого раствора с концентрацией 45%. Сколько воды им нужно долить, чтобы получить то, что нужно?
Задача 3. Выполните задание тетушки Совы. Вычислите массовую долю раствора, который получится, если 120 г. соли растворить в 1,4 кг. воды.
Задача 4. Знахарь смешал два раствора: 150 г. 25% -ного раствора и 400 г. 42%-ного раствора. Помогите ему вычислить массовую долю полученного раствора.
Задача 5. Машенька для бульона взяла 700 г. воды, добавила 1,5 чайных ложки соли (15 г.), попробовала – раствор показался ей слишком соленым, и она добавила 500 г. воды. Раствор с какой массовой долей соли получился у Машеньки в итоге?
Задача 6. Мыши помогли Золушке приготовить волшебный раствор. Они взяли два раствора: 200 г. 10%-ного раствора секретного вещества и 250 г. 25%-ного раствора этого же вещества. Затем они добавили к полученному раствору 30 г вещества. Сколько воды нужно долить Золушке, чтобы массовая доля раствора была равна 15%?
|
Сообщение делает ученик.
Из всех жидкостей вода служит наилучшим растворителем, обладает наибольшей теплоёмкостью. Воды океанов и морей являются аккумуляторами тепла и способны даже изменять климат на планете. Если всю воду равномерно распределить по земному шару, то глубина «мирового океана» составит 4 км.
Вода входит в состав клеток и тканей всех животных и растений. Например: тело человека трёхдневного зародыша на 97% состоит из воды. Тело взрослого- на 60-80%. В таких овощах как огурцы, помидоры , морковь – 90-95% воды, в хлебе – 40%, молоке – 80%, тело медузы на 98% состоит из воды. Процесс пищеварения у человека протекает при участии 9-10 литров воды в сутки .
Презентация каждой группы – защита постера.
Ученики показывают умение обосновывать свое понимание
|
Словесная оценка учителя.
Формативное оценивание «Две звезды и желание»
|
ИКТ
Учебник, маркеры, флипчарт, стикеры
Карточки с заданиями
|
Закрепление
Подведение итогов урока (5 мин)
|
Тестовое задание.
К растворителям относят: А) Ацетат натрия; В) Вода; С) медный купорос;
Выберите формулу хорошо растворимого вещества:
A) NaOH B) Cu(OH)2 C) H2O
Выберите формулу нерастворимого вещества:
A) Са(OH)2 B) Cu(OH)2 C) H2O
Выберите формулу малорастворимого вещества:
A) Са(OH)2 B) Cu(OH)2 C) H2O
По растворимости вещества делятся на:
А) насыщенные, ненасыщенные, перенасыщенные
В) растворимые, нерастворимые, малорастворимые
С) гидраты, кристаллогидраты, растворы
Рефлексия
Стратегия «Химический светофор»
Дает инструкцию: 1.В на столах стикер. На доске рефлексивный лист «Химический светофор» приклейте ваш стикер на понимание темы.
Домашнее задание:
1.читать § 38, выполнить задание А;
2. Написать эссе по теме «Вода- растворитель»
|
Заполняют бланк ответов
Записывают д.з. в дневники
|
Рефлексия «Химический светофор»
|
Бланк ответов
Постер «Химический светофор»
Учебник
стикеры
|
Задание 1.
Представьте классификацию раствора по содержанию растворенного вещества (дополнительный материал).
Задание 2.
Представьте классификацию раствора по растворимости в воде (дополнительный материал)
Задание 3.
Объясните основную идею каждой теории (физической, химической и физико-химической), назовите имена учёных, сторонников этой теории (дополнительный материал).
|
|
|
 Скачать 39.51 Kb.
Скачать 39.51 Kb.
 РАСТВОРЕНИЕ
РАСТВОРЕНИЕ