Редоксиметрия (1). Редоксиметрия Ответьте письменно на контрольные вопросы
 Скачать 24.69 Kb. Скачать 24.69 Kb.
|
|
«Редоксиметрия» Ответьте письменно на контрольные вопросы: Какие реакции называют окислительно-восстановительными? это реакции, в которых происходит изменение степеней окисления атомов элементов. В овр происходит переход электронов от одних атомов к другим, одновременно протекают два противоположных процесса: окисление и восстановление. Окисление восстановитель Окисление: N+ 1− 4 e− → N+ 5, O− 2− 2 e− → O 0, C− 4− e− →. C+ 2, N+ 1, O− 2, C− 4 — восстановители. Восстановление — процесс принятия электронов. Дайте определение понятиям: «окисление», «восстановление», «окислитель», «восстановитель». Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления. Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления. Окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Определите молярную массу эквивалента калия перманганата, калия дихромата, железа(II) сульфата, водорода пероксида, натрия нитрита, щавелевой кислоты в вышеперечисленных реакциях. Эквивалентная масса (Э) - масса одного моль-эквивалента - окислителя или восстановителя определяется делением молярной массы окислителя или восстановителя на число принятых или отданных электронов соответственно. Эквивалентная масса перманганата калия будет различной в зависимости от реакции среды: M(KMnO4) = 158 г/моль, в кислой среде: 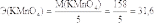 г/моль-экв; г/моль-экв;в нейтральной среде: 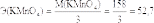 г/моль-экв; г/моль-экв;в сильнощелочной среде:  г/моль-экв. г/моль-экв.Дихромат калия (K2Cr2O7) обычно используется при окислительно-восстановительном титровании в кислой среде; он известен как один из самых сильных окислителей, кроме KMnO4. Полуреакция дихромата калия в кислой среде : Cr2O7 2-(aq)+14 H + (aq)+6e- → 2 Cr3 + (aq) + 7 H2O(l) Как видно из реакции, K2Cr2O7 получает 6 электронов во время окислительно-восстановительной реакции. Чтобы узнать эквивалентную массу K2Cr2O7, используйте формулу: Эквивалентная масса = молекулярная масса/количество вовлеченных электронов. Поскольку участвуют 6 электронов, а K2Cr2O7 имеет молекулярную массу = 294,26, таким образом, эквивалентная масса K2Cr2O7 = 294,26/6 = 49 г/эквивалент. В основе определения пероксида водорода методом перманганатометрии лежит следующее уравнение реакции: 5 Н2О2 + 2 KMnO4 + 3 H2SO4 → 5 O2 + 2 MnSO4 + K2SO4 + 8 H2O Н2О2 - 2е → O2 + 2 Н+ | 5 окисление, восстановитель MnO4 - + 8 Н+ + 5 е → Mn2+ + 4 H2O | 2 восстановление, окислитель В основе определения щавелевой кислоты методом перманганатометрии лежит следующее уравнение реакции: 5 Н2C2О4 + 2 KMnO4 + 3 H2SO4 → 10 CO2 + 2 MnSO4 + K2SO4 + 8 H2O C2О42- - 2е → 2 CO2 | 5 окисление, восстановитель MnO4 - + 8 Н+ + 5 е → Mn2+ + 4 H2O | 2 восстановление, окислитель Почему стандартный раствор калия перманганата не может быть приготовлен по навеске с точно известной массой? (Стандартный раствор перманганата калия по точной навеске приготовить невозможно, так как препарат содержит примеси диоксида марганца, а в дистиллированной воде растворено некоторое количество органических веществ, которые восстанавливают ионы перманганата до диоксида марганца. При определении концентрации раствора перманганата калия в качестве установочных веществ используются щавелевая кислота (H2C2O4*2H2O) и оксалат натрия (Na2C2O4). Чтобы гарантировать максимальную точность приготовления стандартного раствора перманганата калия необходимо в качестве установочного вещества использовать оксалат натрия, который не содержит кристаллизационной воды. Реакцию взаимодействия оксалата натрия или щавелевой кислоты с перманганатом калия необходимо проводить при нагревании чтобы повысить скорость реакции 1 капли раствора перманганата калия обесцвечивается медленно несмотря на нагревание так как на начальной стадии реакции в растворе катализатором реакции ой отсутствует ионы двухвалентного марганца, который является катализатором реакции. Какие процессы протекают в свежеприготовленном растворе калия перманганата? Титрантом метода, является водный раствор перманганата калия, чаще всего — с молярной концентрацией эквивалента 0,1 моль/л. B обычных условиях процесс протекает медленно, поэтому свежеприготовленный раствор перманганата калия можно использовать некоторое время в качестве титранта. Разложение перманганат-ионов ускоряется на свету, при нагревании, под действием кислот и оснований, в присутствии катионов марганца(II) Мп2+, диоксида марганца МпO2, который осаждается на стенках сосуда, образуя темный налет. В силу указанных обстоятельств стандартный раствор перманганата калия нельзя приготовить по точной навеске. Для получения титранта вначале готовят раствор перманганата калия с приблизительной концентрацией, например, разбавляя водой более концентрированный раствор. Поскольку дистиллированная вода всегда содержит следы различных веществ, при окислении которых перманганатом калия образуется диоксид марганца, то приготовленный первоначальный раствор перманганата калия следует либо прокипятить, охладить и профильтровать через стеклянный фильтр, либо выдержать длительное время (до нескольких недель) в темном месте и затем также профильтровать через стеклянный. 6. Почему растворы калия перманганата хранят в темных склянках? Рассеянный дневной свет не вызывает заметного разложения перманганата, но прямой солнечный свет очень быстро способствует разложению даже чистых растворов, поэтому их необходимо хранить в темных сосудах, избегая прямого солнечного света и попадания в них пыли. Какие вещества можно определять прямым перманганатометрическим титрованием? Перманганатометрия – один из наиболее часто применяемых методов окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора. Титрование перманганатом может осуществляться прямым, обратным и косвенным методами. Прямым методом титрования определяют многие восстановители, которые легко без потерь окисляются перманганатом. Сущность прямого титрования: перманганат калия является сильным окислителем (в кислой среде), поэтому он вступает в реакцию со многими восстановителями. Определение анализируемого восстановителя проводят титрованием аликвотной доли раствора титрантом (подкисленным раствором KMnO4). Расчет проводят по закону эквивалентов: n (1/5 KMnO4)= nэкв (анализируемого вещества) Преимущества и недостатки перманганатометрического метода. По сравнению с другими методами окисления—восстановления рассматриваемый метод отличается рядом преимуществ. 1. Исходные стандартные растворы перманганата окрашены в малиновокрасный цвет. Поэтому конечную точку титрования можно определять по покраснению титруемого раствора при титровании прямым методом или по исчезновению окраски при титровании обратным методом, не прибегая к использованию индикаторов. 2. Титрование перманганатом возможно осуществлять в кислой или щелочной средах. 3. Перманганат отличается высоким окислительно-восстановительным потенциалом. Поэтому многие вещества, которые невозможно оттитровать растворами более слабых окислителей, можно определять перманганатометрическим методом. 4. Перманганат является дешевым и легко доступным реагентом. 5. Перманганат также применяют для определения веществ, не обладающих окислительно-восстановительными свойствами. Такого рода определения основаны на осаждении определяемых ионов в виде малорастворимых соединений, получаемых при действии восстановителей (например, оксалатов), и последующем титровании перманганатом избытка восстановителя, или ионов осадителя, связанных в осадок. 8. От каких факторов зависит реальный окислительновосстановительный потенциал редокс-пары «перманганат-ион-ион марганца(II)»? Напишите уравнение Нернста для окислительно восстановительного потенциала данной редокс-пары. Редокс-потенциал зависит также от кислотности среды, комплексообразования или осаждения одного из компонентов редокс-пары в процессе редокс-перехода. Уравнение Нернста. Окислительно-восстановительные процессы, как и все динамические процессы, в той или иной мере обратимы. Направление реакций определяется соотношением электронодонорных свойств компонентов системы одной окислительно-восстановительной полуреакции и электроно-акцепторных свойств второй (при условии постоянства факторов, влияющих на смещение равновесных химических реакций). Перемещение электронов в ходе окислительно-восстановительных реакций приводит к возникновению потенциала. Таким образом, потенциал, измеряемый в вольтах, служит мерой окислительно-восстановительной способности соединения. Для количественной оценки редокс-свойств редокс-пар используют редокс - (окислительно-восстановительные) потенциалы. При вычислении окислительно-восстановительного потенциала используют уравнение Нернста: E (Ox/Red) = E 0 (Ox/Red) + где E(Ox/Red) - реальный или равновесный редокс-потенциал, В; E 0 (Ox/Red) - стандартный редокс-потенциал, равный равновесному при а(Ох) = а(Red) = 1 моль/дм 3 ; R - универсальная газовая постоянная (8,31 Дж/К·моль); Т - абсолютная температура, K; F - число Фарадея (96500 Кл/моль); z - число электронов, участвующих в редокс-переходе в ОХ+ze dRed; a(OX) и a(Red) - активности соответственно окисленной и восстановленной форм вещества, моль/дм 3 . При подстановке в уравнение Нернста значений R, F и T = 298 К, а также переходе к десятичному логарифму, получим E(Ox/Red) =E 0 (Ox/Red) + Редокс-потенциал зависит также от кислотности среды, комплексообразования или осаждения одного из компонентов редокс-пары в процессе редокс-перехода. Чем больше концентрация ионов водорода в растворе, тем больше окислительная способность окисленной формы вещества редокс-пары и тем больше E(Ox/Red). При выборе вещества титранта в редоксиметрии проводят качественную и количественную оценку возможности (направленности) и полноты прохождения ОВР между титрантом и определяемым веществом. Качественную оценку проводят путем сравнения табличных величин E 0 (Ox|Red) вещества титранта и определяемого вещества, приведенных в аналитических, химических и физико-химических справочниках. |
