Государственное профессиональное образовательное учреждение «Кемеровский областной колледж культуры и искусств»
|
Реферат
|
«Бензол и его гомологи»
|
|
Выполнила: Давыдова А. С.
Профессия: Библиотековедение
Группа: БД-11
Проверила: Чернова Татьяна Владимировна
Реферат принят с оценкой ______
роспись руководителя _______
|
|
Кемерово 2018
|
Оглавление
Ароматические углеводороды 1
Бензол 1
Номенклатура гомологов бензола 2
Названия радикалов 2
Химические свойства бензола 3
(гексахлоран) 4
Химические свойства гомологов бензола — алкилбензолов 4
Получение бензола и его гомологов 4
Список литературы 5
Ароматические углеводороды
Ароматические углеводороды/ Арены — соединения, молекулы которых содержат одно или несколько бензольных колец.
Бензольные кольца – циклические группы атомов углерода с особым характером связей.
О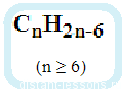 бщая формула ароматических углеводородов ряда бензола: бщая формула ароматических углеводородов ряда бензола:
Гомологический ряд : С6H6, C7Н8, C8H10 и т.д.
Критерии ароматичности:
Атомы углерода располагаются в одной плоскости.
Атомы углерода образуют циклическую систему.
Сопряжённая система связей содержит 4n+2π-электронов (n – целое число).
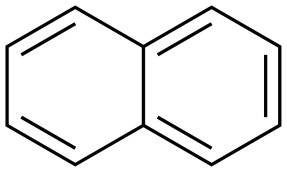
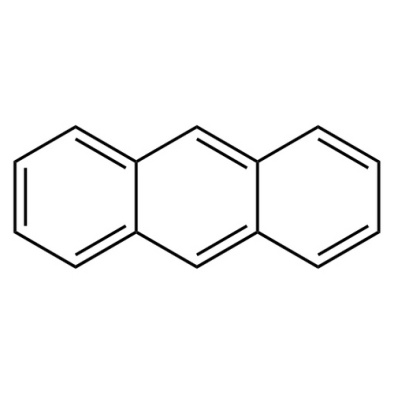
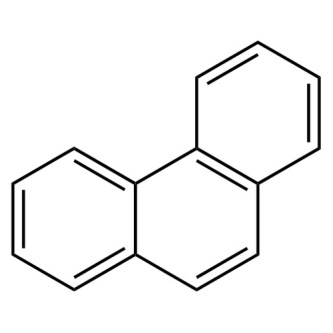
Конденсированные ароматические углеводороды – соединения, молекулы которых включают несколько бензольных колец, соединённых вдоль связи С–С. Простейшие соединения данного типа:
Нафталин
|
Антрацен
|
Фенантрен
|
|
|
|
Бензол
Бензол — 1) первый представитель класса аренов/ ароматических углеводородов; простейший ароматический углеводород.
Почему «ароматических»? Потому что большинство гомологов бензола, да и сам бензол, имеют сладковатый запах, при этом довольно ядовиты.
Обычно бензол рисуют вот таким «скворечником» или пишут общую формулу С6H6.
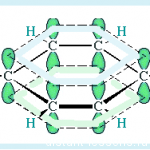
С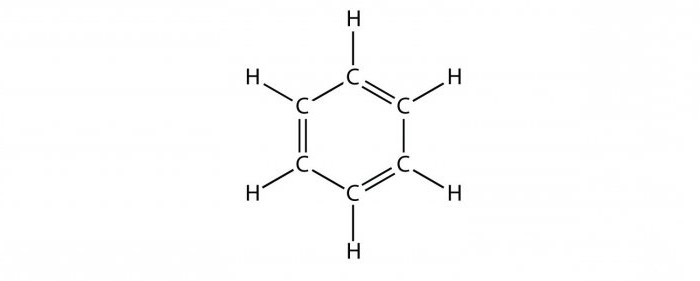 троение троение
Шесть атомов углерода, образующих правильный шестиуголник (σ-скелет), находятся в sp2-гибридном состоянии. Каждый атом углерода образует при σ-связи с двумя другими атомами углерода и
одним атомом водорода, лежащие в одной плоскости.
Валентные углы между тремя σ-связями равны 120°
(см. σ-скелет молекулы бензола)
Шесть p-электронов взаимодействуют между собой, образуя единое π-электронное облако, которое изображают кружочком внутри шестичленного цикла:
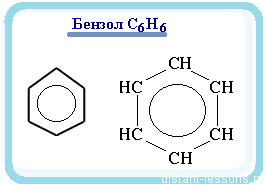
Почему рисуют кружок в шестиугольнике? Это обозначение того, что все связи в молекуле одинаковые.
Дело в том, что если рисовать бензол по валентностям углерода (у каждого атома должно быть 4 связи), то надо было бы нарисовать с двойными связями.
Но!Каждая связь — это не просто черточки на бумаге. Каждая связь имеет определенные физические характеристики. Например, длинна связи.
Двойная связь короче одинарной. При исследовании молекулы бензола оказалось, что:
все связи одинаковы, т.е. нет разделения на двойные и одинарные;
эти связи представляют собой промежуточный вариант между двойной и одинарной.
Поэтому рисуют кружок — обозначение одинаковых связей по всей молекуле. Этот кружок и называют «бензольным кольцом».
Если рассмотреть строение молекулы более детально, с точки зрения электронной плотности, то картина будет примерно следующая — образуется общее ∏-электронное облако и оно распространено (=делокализовано) по всей молекуле:
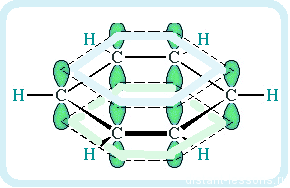
Слева показана плотность бензольного кольца

Справка
Делокализация – электронная плотность.
Физическое состояние
Бесцветная жидкость с характерным запахом
Температура плавления: tпл=5,5°С
Температура кипения: tкип=80,1°С
Давление: p = 0,88г/см3.
Не растворяется в воде, хорошо растворяется в органических растворителях.

σ-скелет молекулы бензола
Н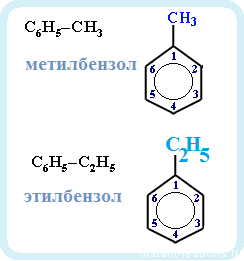 оменклатура гомологов бензола оменклатура гомологов бензола
Название углеводорода складывается из двух частей:
Количество и указание места прикрепления
Название радикала + «бензол»
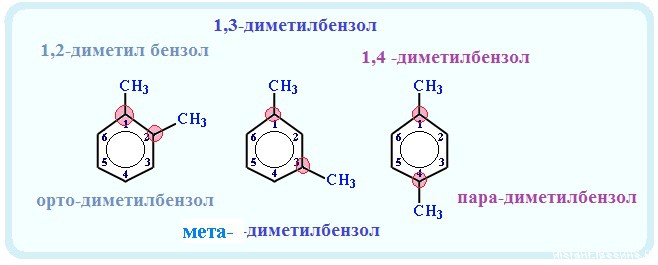
Если в молекуле арена есть несколько одинаковых радикала, то применяются приставки: орто-, мета— и пара-
орто- (о-) — два радикала находятся рядом — при соседних атомах углерода (1,2-ди «радикал» бензол);
мета- (м-) — два радикала находятся через один атом углерода (1,3 — ди «радикал» бензол)
пара- (п-) — два радикала находятся друг против друга — через 2 атома углерода (1,4- ди «радикал» бензол)
Все эти вещества изомерны друг другу. У бензола и его гомологов довольно много изомеров —это обусловлено как количеством атомов, так и геометрией молекулы.
Названия радикалов
С6H5 — фенил-
С6H5CH2- бензил-
Тривиальные названия:
толуол = метилбензол (С4Н5СН3);
ксилол = все диметилбензолы (C6H4(CH3)2);
кумол = изопропилбензол (C6H5 - CH(CH3)2)
В ЕГЭ это вопрос А13иА14 — Строение и свойства углеводородов.
В ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах.
Химические свойства бензола
В первом разделе о бензоле мы рассмотрели строение молекулы и определили, что бензольное кольцо — уникальная система. И у этой системы свои характеристики, отличающиеся от свойств других углеводородов.
Первая такая характеристика — прочность бензольного кольца. Прочность не просто геометрической фигуры шестиугольника, а именно системы связей и делокализованного электронного облака.
Что это означает? Это означает, что разрушить эту систему (раскрыть кольцо) возможно при специальных условиях — давление, температура, катализатор и т.д.
Для бензола и его гомологов характерны реакции замещения.
Остальные реакции идут с трудом.
Лучше, конечно, разделить химические свойства бензола и химические свойства алкилбензолов.
По сути, алкилбензолы — вещества с двумя функциональными группами — бензольным кольцом и насыщенным алкильным радикалом, для которого более характерны свойства алканов.
Химические свойства бензола
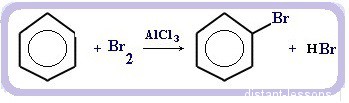
1. Реакции электрофильного замещения в бензольном кольце проходят в присутствии катализаторов: солей Al(3+) или Fe(3+):
Катализаторы – кислоты Льюиса
Например: взаимодействие с бромом — качественная реакция на бензол.
C6H6 + Br2 = C6 H5Br + HBr
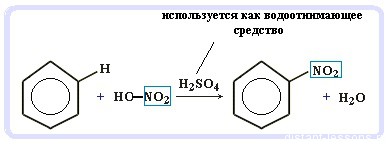
Нитрование бензола (обратите внимание, в органической химии неорганические кислоты реагируют немного по-другому — с отщеплением группы -OH)
Бензол реагирует с нитрирующей смесью
Нитрирующая смесь – смесь концентрированных азотной и серной кислот.
C6H6 + HO – NO2 → C6 H 5 NO 2 + H 2 O
Алкилирование — 1)получение гомологов бензола, алкилбензолов;
2) реакция Фриделя-Крафтса)
Реакция происходит с помощью алкилгалогенид и алкенов.
Катализаторы реакции — галогениды алюминия: AlCl3, AlBr3 и т.д.):
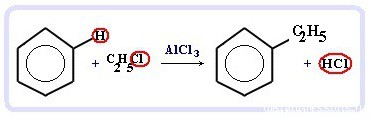
С6H6 + С2H5Cl → C6H5C2H5 + HCl
2. Реакции присоединения разрушают ароматическую систему и протекают в жёстких условиях.
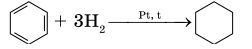
Циклогексан
Радикальное хлорирование на свету:

Гексахлорциклогексан
(гексахлоран)
Химические свойства гомологов бензола — алкилбензолов
Реакции замещения алкилбензолов:
Гомологи бензола более ракционноспособны — легче вступают в реакции
Эти реакции идут немного по-другому
Галогенирование алкилбензолов:
С6H5-CH3 + Br2 (на свету) = С6H5-CH2Br + HBr
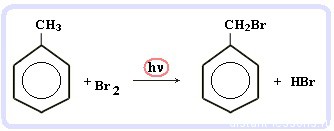
Т.е. бром идет в боковую цепь, а не в кольцо.
Чтобы бром пошел в кольцо, надо использовать катализатор — соли Al(3+)
Нитрование алкилбензолов:
С6H5-CH3 + 3HNO3 → C6H2CH3(NO2)3
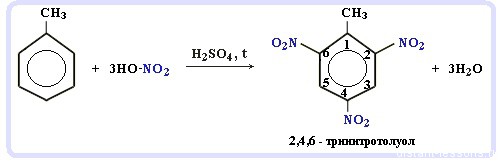
тринитротолуол, он же тротил
Окисление: реакция, характерная для алкилбензолов и не характерная для самого бензола
С6H5CH3 + [O] → C6H5COOH — бензойная кислота

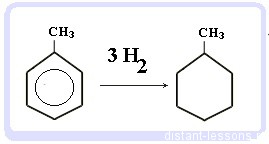
Гидрирование бензола и алкилбензолов:
Тут уже различий нет. При гидрировании всех аренов (температура, давление, катализатор — бензольное кольцо разорвать не так уж и просто) получаются циклоалканы, а точнее, циклогексан и циклогексан с радикалами:
С6H6 + 3 H2 → C6H12 циклогексан
С6H5CH3 + 3 H2 → C6H11-CH3 — метилциклогексан
Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды H2O:
CnH2n-6 + (3n-3)\2 O2 → nCO2 + (n-3)H2O
Получение бензола и его гомологов
Мы рассмотрим «классические» методы получения бензола — те, которые описаны в каждом учебнике по химии, и рассмотрим получение из разных классов органических соединений, т.к. цепочки реакций, которые предлагаются в ЕГЭ, подразумевают умение получать бензол «из всего».
«Классические» реакции получениябензола и его гомологов
Ароматизация нефти. Точнее, это реакция циклизации гексана. Называется метод «ароматизация нефти», т.к. из нее получают гексан:
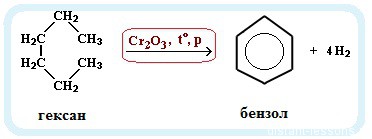
С6H14 → C6H6 + 4H2
Обратите внимание на условия реакции — давление, температуру и катализатор. Они означают, что при обычных условиях гексан не вступит в такую реакцию. Алканы вообще довольно нереакционноспособные вещества.
Дегидрирование циклогексана: этот метод хорошо тем, что можно получить не только бензол, но и его гомологи. Для этого надо взять циклогексан с нужным количеством атомов С в боковой цепи
С6H12 → C6H6 + 3H2
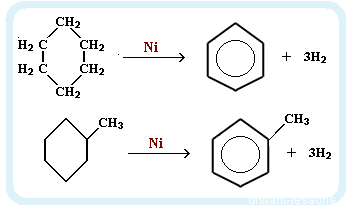
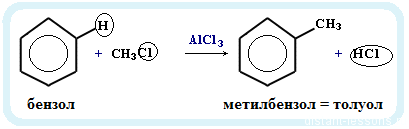
Получение гомологов бензола.Алкилирование бензола:
- Реакция проводится в присутствии катализатора — галогенидов алюминия, например, AlCl3:
C6H6 + CH3Cl → C6H5CH3 + HCl
И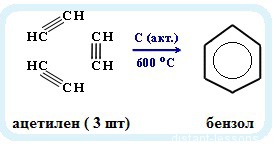 менная реакция — реакция Зелинского. Получение бензола из ацетилена: менная реакция — реакция Зелинского. Получение бензола из ацетилена:
3С2H2 → C6H6
Это основные, «классические» способы получения бензола и его гомологов, теперь рассмотрим варианты из заданий ЕГЭ
1. Получение бензола из неорганических веществ:
1вариант:
Исходное вещество — карбид кальция СaC2:
CaC2 + 2H2O → Ca(OH)2 + C2H2 — ацетилен
дальше — реакция Зелинского: 3С2H2 → C6H6
Это самый короткий путь получения.
2 вариант:
Исходное вещество — карбид алюминия Al4C3:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 — метан
2СH4 (1500 °C) → C2H2 + 3H2
дальше — реакция Зелинского
2. Получение бензола и его гомологов из других неорганических веществ:
1) получение бензола из алканов:
СH4 (1500 °C) → C2H2 (С, 600ºС) → С6H6
2) получение бензола и его гомологов из алкенов:
С2H4 → C2H2 →C6H6
Схема: алкен → дибромалкан → циклоалкан → гомолог бензола
CH2=CH-(CH2)4-CH3 + HBr → CH3-CH(Br)-(CH2)4-CH3
CH3-CH(Br)-(CH2)4-CH3 + Br2 → CH3-CH(Br)-(CH2)4-CH2Br
CH3-CH(Br)-(CH2)4-CH2Br + Zn → C6H13-СH3
C6H13-СH3 — метилциклогексан + ZnBr2
C6H13-СH3 → С6H5-CH3 + 4H2
Список литературы
http://www.graycell.ru/simplemask.php
http://kursak.net/interesnye-fakty-v-ximii-i-ne-tolko/
http://www.tk-topaz.ru/production/i/191
«Большой справочник школьника». 5 – 11 классы. – 5-е изд., стереотип. – М.: Дрофа, 2002. – Б79 1104 страниц. Редакторы разделов: Н. Е. Рудомазина, Т. Д. Дажина, Н. В. Павлова и другие.
«Химия. 10 класс. Базовый уровень»: Учебник для общеобразовательных учреждений. – 3-е изд. – М.: ООО «ТИД «Русское слово–РС», 2009. - 176 с. Авторы: Новошинский И. И., Новошинская Н.С.
«Химия. 10 класс»: Учеб. для общеобразоват. учреждений / Х46 О.С. Габриелян, Ф. Н. Маскаев, С. Ю. Пономарёв, В. И. Теренин; Под ред. В. И. Теренина. – 4-е изд., стереотип. – М.: Дрофа, 2003. – 304с.: ил.
|
 Скачать 345.86 Kb.
Скачать 345.86 Kb.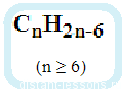 бщая формула ароматических углеводородов ряда бензола:
бщая формула ароматических углеводородов ряда бензола: троение
троение








 оменклатура гомологов бензола
оменклатура гомологов бензола












 менная реакция — реакция Зелинского. Получение бензола из ацетилена:
менная реакция — реакция Зелинского. Получение бензола из ацетилена: