Физические основы позитронно-эмиссионной томографии. Реферат (доклад) по дисциплине Позитронэмиссионная томография
 Скачать 116.5 Kb. Скачать 116.5 Kb.
|
|
Стерлитамакский филиал ФГБОУ ВО «Башкирский государственный университет» Естественнонаучный факультет Кафедра общей и теоретической физики «ЭТАПЫ ИССЛЕДОВАНИЯ ПЭТ И ОСНОВНЫЕ БЛОКИ СКАНЕРА» Реферат (доклад) по дисциплине «Позитрон-эмиссионная томография» Выполнил: студент группы ЕНФ-МФИЗ21 Гайнуллин И.Р Принял: Ягафарова З.А Стерлитамак – 2020 Содержание 1. Введение 2. Историческая справка 3. Этапы исследования и основные блоки сканера 4. Реконструкция изображений 5. Аппаратное обеспечение и контроль качества 6. Радионуклиды, используемые в ПЭТ 7. Достоинства и недостатки ПЭТ 8. ПЭТ/КТ сканеры 9. Области применения ПЭТ в медицине 10. Заключение 11. Список литературы 1. Введение В медицинской диагностике проходит много времени, прежде чем новая технология визуализации становится пригодной для клинической практики. Для правильной интерпретации изображения необходимо немало дополнительных исследований. На этом этапе сейчас находится позитронно-эмиссионная томография (ПЭТ). В клинической практике ПЭТ используется с начала 1990-ых и в отличие от классических методов (таких как компьютерная и магнитно-резонансная томография), позволяющих получать только изображения анатомических структур и изменений в них, ПЭТ позволяет проводить количественный анализ биохимических или физиологических функций. Эта информация часто позволяет выявить функциональные изменения, вызванные заболеванием, задолго до появления каких-либо морфологических изменений. В частности ПЭТ – единственный аппарат, позволяющий диагностировать опухоль на "нулевой" стадии. 2. Историческая справка Методика ПЭТ отображения является комбинацией двух изобретений, представленных к Нобелевской премии – радиоактивного индикатора и принципов томографии. В период с середины 40-х до начала 1950-х интерес к радиоактивным индикаторам был небольшим. Возможно, причиной стало открытие в 1940 Каменом и Рубеном Первый прототип ПЭТ сканера появился в 1952 году Массачусетском госпитале после 6 месяцев разработки конструкции. Он имел всего лишь два детектора на основе йодистого натрия расположенных друг напротив друга и позволял получать изображения, основанные как на обнаружении совпадения событий, так и на дисбалансе. Дисбаланс одноканальных детекторов использовался для создания изображения на основе регистрации любого дисбаланса между каналами детекторов. Разрешение было низким, но чувствительность устройства все же позволяла обнаружить опухоль и ее пространственное положение относительно срединной линии мозга. С середины 1950-ых до начала 1970-ых радионуклиды использовались мало. С начала 1970-ых испускающие позитрон радионуклиды стали популярны и интерес к ПЭТ исследованиям возрос. Были созданы сложные алгоритмы реконструкции и усовершенствованы датчики. В 1980х ПЭТ стал использоваться для динамических исследований метаболизма человека. На развитие технологии ПЭТ повлияли три фактора: 1) большинство метаболических процессов в теле происходят достаточно быстро, чтобы следить за ними с помощью короткоживущих радионуклидов; 2) несмотря на короткое время жизни изотопов, стала возможна быстрая радиоактивная маркировка сложных молекул; 3) проникающее излучение, возникающее при уничтожении позитронов, показало, что можно локализовать эти позитроны. Первые ПЭТ сканеры с множеством детекторов были созданы в начале1960-ых в нескольких исследовательских центрах и представляли собой системы с кольцом из 32 датчиков и разрешением более 2 см, позволяющие получать единичные срезы. Это позволило повысить чувствительность метода и получить двумерное изображение. В следующем поколении ПЭТ сканеров, появившемся в 1968 году был уменьшен размер датчика и добавлены дополнительные кольца, позволяющие одновременно получать несколько срезов с разрешением менее 1 см.Такие сканеры позволяли получать двумерные изображения срезов головного мозга; третья координата обнаруженных опухолей определялась по положению соответствующего среза. В 1970 году для обработки полученных данных было предложено использовать алгоритм обратного проецирования. В конце 1970-ых ПЭТ сканеры стали использоваться для проведения коммерческих исследований. Разрабатывались новые сканеры с большим числом датчиков для увеличения чувствительности и разрешения. После многих лет исследований, в Университете штата Пенсильвания было создано устройство, названное PENN-ПЭТ. Оно состояло из множества позитронных датчиков, расположенных вокруг отверстия для пациента в виде шестиугольника диаметром 50 см. PENN – ПЭТ давал высокую чувствительность и разрешение 5,5 мм и был менее сложен и дорог, чем системы с кольцом детекторов. Дальнейшее усовершенствование ПЭТ-сканеров состоит в повышении пространственного разрешения, чувствительности детекторов, увеличении числа одновременно получаемых срезов, коррекции аттенюации и разработке новых алгоритмов реконструкции изображений. Хотя в последние 20 лет ПЭТ использовалась преимущественно для научных исследований, ее роль как метода диагностики находится на стадии становления. В настоящее время основными областями клинического применения ПЭТ являются онкология, кардиология, неврология. 3. Этапы исследования и основные блоки сканера Любое ПЭТ исследование состоит из нескольких основных этапов: 1. производство радиоизотопа; 2. маркировка выбранного состава испускающим позитроны радионуклидом и подготовка состава в форме, пригодной для воздействия на людей; 3. транспортировка состава из лаборатории к месту проведения исследования; 4. воздействие радиоактивного индикатора и получение данных ПЭТ; 5. отображение распределения активности позитрона как функции времени, обработка данных; 6. интерпретация результата. Система производства радиоизотопов состоит из трех основных частей: - циклотрона (ускорителя частиц); - биологического синтезатора, присоединяющего радиоизотопы к биологическим молекулам; - компьютера, контролирующего процесс. До начала исследования в циклотроне производится радиоактивное вещество, входящее в естественный химический состав тела (атомы кислорода, углерода, азота) и распадающееся с испусканием позитронов.  Циклотрон (циклический ускоритель) состоит из двух полых полукруглых металлических электродов (дуантов), расположенных между полюсами электромагнита и разделенных узким зазором. Вблизи от центра дуантов располагается источник ионов (как правило электрическая дуга в газе), который служит генератором заряженных частиц. В момент работы, частицы импульсно генерируются источником ионов. Нить накала, расположенная в источнике ионов создает отрицательный заряд путем присоединения электронов к атому. 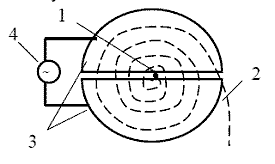 Схема движения частиц в циклотроне: 1 – источник тяжелых заряженных частиц (протонов, ионов); 2 – орбита ускоряемой частицы; 3 – ускоряющие электроды (дуанты); 4 – генератор ускоряющего поля Магнитное поле направлено перпендикулярно плоскости рисунка. При попадании отрицательных ионов в вакуумную камеру они приобретают энергию благодаря высокочастотному переменному электрическому полю, индуцированному на дуантах. Ионы подвергаются воздействию электрического поля и сильного магнитного поля, генерируемого электромагнитом. Когда отрицательные ионы долетают до края дуанта и влетают в зазор, РЧ-осциллятор меняет полярность на дуантах и ионы отталкиваются по мере входа в ранее положительно, а теперь отрицательно заряженный дуант. С каждым проходом зазора, энергия и радиус орбиты частиц возрастают и частицы двигаются по спирали. При достижении максимальных значений на последнем витке спирали включается отклоняющее электрическое поле, выводящее пучок наружу. Поток отрицательных ионов направляется к первой карусели, расположенной между ускорителями и камерой мишени. Карусели состоят из тонких угольных пластин, которые отделяют оба электрона от ионов Протонный пучок из циклотрона влетает в камеру мишени и путем ядерной реакции преобразует стабильный материал мишени (стабильный химический изотоп) в радиоактивный изотоп. Произведенные на циклотроне радиоизотопы переносятся в биосинтезатор, где они присоединяются к используемым в клинике химическим составам, за распределением которых в теле хотят проследить. Естественно встречающиеся в органических составах атомы заменяются маркированными (химически и биологически идентичными оригиналу). В ПЭТ маркируемы химические составы, ограничены воображением исследователей и временем полураспада. Чаще всего в роли маркируемого вещества выступает глюкоза. Вся работа системы производства радиоизотопов, включая циклотрон и биосинтезатор, управляется компьютером. Оператор выбирает из меню на консоли управления требуемый для производства изотоп, а остальные процессы проводятся автоматически. Для проведения исследования малое количество радиоактивного препарата (радионуклида) внутривенно вводят пациенту, радионуклид поступает в клетки и распределяется в них. Спустя некоторое время его концентрация в тканях измеряется сканером, достаточно чувствительным для обнаружения даже небольшого количества радиоактивного состава. При распаде радиоактивного вещества происходит выброс (эмиссия) положительных частиц (позитронов), стабилизирующая ядро за счет устранения положительного заряда путем превращения протона в нейтрон. Позитрон проходит короткое расстояние (зависящее от его энергии) перед столкновением с электроном окружающей среды (рис. 53). Происходит объединение позитрона с электроном среды (аннигиляция), частицы "уничтожают" друг друга, и их масса преобразуется в энергию, приводя к эмиссии двух противоположно направленных (180°±0,25°) гамма-лучей (фотонов высокой энергии) с энергией 511 кэВ каждый. 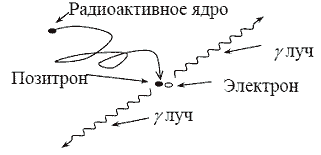 Эмиссия гамма лучей Данные фотоны, испущенные в результате аннигиляции, выходят за пределы тела и регистрируются внешними детекторами. Регистрируемые после аннигиляции гамма -лучи называются линией совпадения и используются для определения локализации и концентрации эмитента позитрона, которая зависит от биохимической и физиологической реакции органа. Когда гамма-лучи взаимодействуют с кристаллами сцинтиллятора, фотоны света преобразуются электронными устройствами томографа в электрические сигналы. Процессы конвертации и регистрация происходят практически мгновенно друг за другом, для того чтобы можно было сравнивать события сцинтилляции с противоположных детекторов (вдоль большого количества линий совпадений). 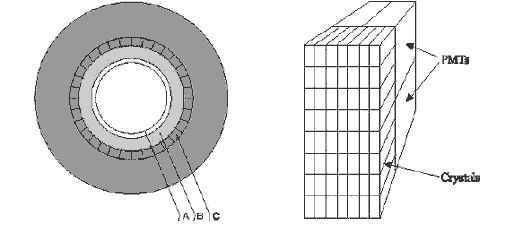 Гентри ПЭТ сканера: А - цилиндрический источник для коррекции аттенюации, В - септа, С - детекторные блоки Основным блоком ПЭТ сканера является гентри, внутри которого расположены детекторы Множество детекторов образует кольцо диаметром 80-100 см и шириной 10-20 см. Для снижения влияния внешнего излучения, наружная поверхность кольца детекторов имеет свинцовый экран. Большинство сканеров может работать как в посрезовом режиме, когда аксиальная коллимация создается тонкими вольфрамовыми кольцами называемыми септами, так и в трехмерном режиме, когда септа втягивается и совпадение регистрируется между всеми возможными парами детекторов.  Детекторы являются самими важным компонентами ПЭТ сканера. В ряде случаев они похожи на используемые в однофотонном отображении: большие кристаллы йодистого натрия соединенные с фотоумножителями. В коммерческих томографах детекторы конструктивно представляют собой прямоугольную группу кристаллов (блок), т.к. более плотное расположение детекторов позволяет снизить потери пространственного разрешения и регистрации фотонов. Использование множества регистрирующих кристаллов предотвращает оптическую дисперсию света между отдельными элементами блока. Сцинтилляционные детекторы (рис.), используемые в ПЭТ, состоят из сцинтиллятора, фотоэлектронного умножителя и электронной системы. Сцинтиллятором называют вещество, благодаря которому возникают флуоресцентные световые вспышки при испускании высокоэнергетического излучения (например, бета- или гамма-лучей). Быстрые заряженные частицы, двигаясь в веществе, теряют свою энергию при столкновении с атомами, причем энергия частиц расходуется на ионизацию и возбуждение атомов среды. Возбуждение атомов снимается в основном путем испускания квантов света характерной для данного вещества частоты. Обычно излучение, возникающее при этом, поглощается в той же среде. Только в люминесцирующих средах часть высвеченной энергии может выйти за пределы среды. 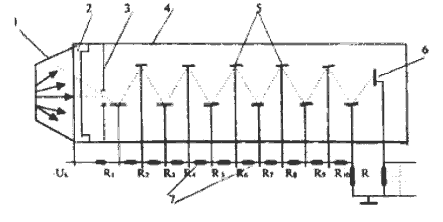 Схема сцинтилляционного детектора: 1 – сцинтиллятор; 2 – фотокатод; 3 – диафрагма; 4 – корпус фотоумножителя; 5 – диноды; 6 – анод; 7 – делитель напряжения Процесс люминесценции может осуществляться двумя путями. Если переходы из возбужденных энергетических состояний в основное разрешены, испускание света происходит в соответствии со средним временем жизни возбужденного состояния по обычным статистическим законам и называется флуоресценцией. Если переход из возбужденного состояния в основное запрещен, то возникает метастабильное состояние, среднее время жизни которого может быть значительно больше времени жизни обычного возбужденного состояния. В этом случае для испускания кванта света система должна перейти в более высокое энергетическое состояние, переход из которого в основное разрешен. Такой процесс называют фосфоресценцией. Основными характеристиками сцинтилляторов являются конверсионная эффективность, спектр излучения и время высвечивания. Конверсионная эффективность – это отношение энергии световой вспышки, к энергии, потерянной заряженной частицей в сцинтилляторе, зависящее от типа и качества сцинтиллятора. Количество света, испускаемое сцинтиллятором, характеризуется световым выходом – отношением энергии среднего числа фотонов люминесценции к энергии, потерянной ионизирую – щей частицей в сцинтилляторе. Т.к. световая вспышка сцинтиллятора регистрируется при помощи фотоэлектронного умножителя, область спектральной чувствительности которого лежит в диапазоне длин волн видимого света, то спектр частот, излучаемых сцинтиллятором, должен укладываться в чувствительной области ФЭУ. В большинстве случаев интенсивность вспышки I с течением времени t спадает по экспоненциальному закону: Величина τ – время, в течение которого интенсивность падает в е раз, характеризует длительность свечения и называется временем высвечивания сцинтиллятора. Основные свойства сцинтилляторов определяются механизмом возбуждения и высвечивания. С этой точки зрения удобно разделить все известные сцинтиллирующие вещества на три группы: кристаллофосфоры или неорганические кристаллы (например, ZnS, NaI), органические кристаллы (например, антрацен, стильбен), инертные газы. В медицине чаще всего используются сцинтилляторы в виде таллиевого кристалла, активированного йодидом натрия. В решетке такого кристалла при взаимодействии атомов и ионов происходит возмущение энергетических уровней внешних электронов, что приводит к образованию чередующихся разрешенных и запрещенных областей. В обычных условиях нижние энергетические зоны кристалла заняты полностью (валентная зона), а более высокие – целиком не заполнены и электроны в них могут свободно перемещаться (зона проводимости), не получая дополнительной энергии. Самая верхняя валентная зона отделена от наиболее низкой зоны проводимости интервалом в несколько эВ. При возбуждении электроны переходят из валентной зоны в зону проводимости, образуя в валентной зоне электронную вакансию – дырку. При обратном переходе электронов из зоны проводимости в валентную зону возникает излучение с характерным для данного кристалла спектром – собственное излучение. 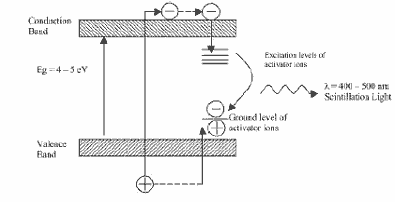 Схема энергетических зон в неорганическом кристалле При наличии в кристалле примесей, в запрещенной зоне могут возникать локальные энергетические уровни, лежащие вблизи валентной зоны. Если эти уровни не заняты, то на них могут попасть электроны, движущиеся в зоне проводимости. Если переход с этих уровней в валентную зону разрешен (люминесцентные центры), то возникает излучение, длина волны которого больше, чем в спектре поглощения. Таким образом, примеси сдвигают спектр излучения в сторону увеличения длин волн и к увеличению интенсивности свечения. Вместе с этим примеси создают дефекты в кристаллической решетке, и создают дополнительные метастабильные уровни, прямой переход с которых в валентную зону запрещен. Электроны с этих уровней могут перейти в зону проводимости при поглощении ими тепловой энергии колебаний решетки, а затем попасть в люминесцентные центры. Это приводит к замедленному испусканию фотонов (фосфоресценции). Фотоэлектронный умножитель (ФЭУ) – это фотоэлемент с многократным усилением, основанным на явлении вторичной эмиссии. ФЭУ состоит из фотокатода, фокусирующего устройства, нескольких эмиттеров (динодов) и анода. В фотоумножителях часто применяется сурьмяно-цезиевый фотокатод, активированный кислородом. Фотокатод нанесен в виде тонкого полупрозрачного слоя на внутреннюю сторону торцовой стенки стеклянного баллона ФЭУ, диаметром 15 мм. Эмиттеры и анод изготовлены из металла. Для увеличения коэффициента вторичной эмиссии σ (среднего числа вторичных электронов, выбиваемых одним первичным электроном) эмиттеры покрыты пленкой вещества с малой работой выхода электронов. В ФЭУ электроны ускоряются и фокусируются с помощью электростатического поля, определяемого конфигурацией электродов и распределением потенциалов в них. Для подачи напряжения на электроды используется делитель, состоящий из омических сопротивлений. К концам делителя приложено напряжение Uk (800-1500 В) от источника высокого напряжения. Световые кванты, падающие на фотокатод, вызывают фотоэффект. Возникшие при этом фотоэлектроны попадают в электрическое поле, ускоряются и фокусируются на первом эмиттере(диноде). При ударах электронов о первый эмиттер происходит вторичная эмиссия. Выбитые электроны ускоряются в следующем межэлектродном промежутке и, попадая на второй эмиттер, вызывают в свою очередь вторичную эмиссию со второго и т.д.Таким образом, число электронов от эмиттера к эмиттеру лавинообразно нарастает. Электроны с последнего эмиттера собираются на аноде фотоумножителя. Если σ-коэффициент вторичной эмиссии на каждом эмиттере, то коэффициент усиления умножителя где q<1 – множитель, учитывающий неполное собирание электронов с фотокатода на первый эмиттер; n- число эмиттеров. Величина коэффициента вторичной эмиссии σ прямопропорционально зависит от напряжения питания ФЭУ и в области больших ускоряющих напряжений имеет вид где U -ускоряющее напряжение, приложенное между соседними динодами и пропорциональное напряжению на делителе Uk,А и U0 –постоянные, определяемые свойствами материала поверхности эмиттера. Коэффициент усиления умножителя имеет вид: Поскольку коэффициент вторичной эмиссии не зависит от числа падающих электронов, то ФЭУ представляет собой линейный прибор, т.е. заряд, приносимый лавиной на анод, пропорционален числу первичных фотоэлектронов, собираемых с фотокатода, и, следовательно, пропорционален интенсивности световой вспышки, попавшей на катод. Если импульсы тока на выходе достаточно велики, линейность может нарушаться за счет искажения поля пространственным зарядом в области анода и последних эмиттеров, а также за счет изменения потенциалов последних эмиттеров и анода. Оба фактора вызывают дефокусировку и тем самым нарушают линейность, которую полностью устранить нельзя. Расширению области линейности в данном случае способствует только увеличение разности потенциалов между последними эмиттерами и особенно между анодом и предыдущим динодом. Если к ФЭУ предъявляется требование линейности в широком диапазоне интенсивности световых вспышек, то это накладывает ограничение на величину коэффициента усиления. Другой причиной ограничения коэффициента усиления может явиться резкое возрастание шумов ФЭУ. В сцинтилляционном детекторе свечение сцинтиллятора приводит к эмиссии с фотокатода сотен фотоэлектронов и полезные сигналы по величине в несколько раз превышают шумы. Чаще в сканерах используют германат висмута, который создает около 2500 фотонов света на 511 кэВ фотон и имеет время затухания 300 нс. Один блок содержит матрицу 7Ч8 кристаллов и четыре фотоумножителя. Каждый кристалл имеет сечение 3.3Ч6.25 мм и глубину 30 мм. Электронная система регистрирует импульсы электрического тока, в которые преобразуется световая вспышка. Сцинтилляционные детекторы позволяют регистрировать все виды радиоактивного излучения, причем в отличие от газоразрядных счетчиков эффективность регистрации высокоэнергетичных γ-квантов может быть в сцинтилляционных детекторах очень большой (50 или даже 100%). Высокая временная разрешающая способность позволяет использовать сцинтилляционные детекторы при высоких скоростях счета и проводить измерения коротких интервалов вплоть до десятых долей секунды. При выборе детекторов производители томографов учитывают такие их свойства как длина аттенюации, эффективность обнаружения, плотность, яркость, время восстановления, коэффициент преломления, цена. 4. Реконструкция изображений Реконструкция изображений производится путем обработки данных, полученных детекторами, расположенными в виде нескольких колец, что позволяет одновременно получать изображения до пятнадцати срезов. Получение изображения базируется на внешнем обнаружении совпадающих испускаемых лучей в течение 10 нс между двумя датчиками, расположенными на противоположных сторонах сканера. Каждый детектор может работать режиме регистрации совпадений со множеством расположенных напротив детекторов. Линия, соединяющая центры детекторов, проходит через объект и используется для реконструкции изображения. Таким образом, существует возможность определения совпадений на нескольких углах (расходящийся пучок). Если уничтожение происходит вне объема между этими двумя датчиками, то может быть обнаружен только один фотон, и этот случай отклоняется как не удовлетворяющий условию. Одновременное обнаружение фотона обеспечивает область представления с однородной чувствительностью. 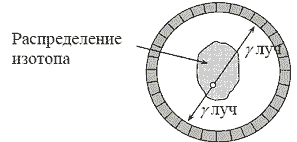 Совпадающие детекторы в ПЭТ камере Программное обеспечение томографа получает данные о событиях совпадения, зарегистрированных в угловых и линейных положениях, количественное суммирование которых дает двумерную картину распределения изотопа. Подобно КТ и МАРТ, отображение в ПЭТ косвенное и производится с помощью компьютерной реконструкции изображений Для реконструкции изображения необходимо получить распределение изотопа g(x1,x2) внутри отображаемого объекта. Если обозначить коэффициент аттенюации тела как f (x1, x2), то интенсивность излучения I, регистрируемая детекторами вдоль прямой линии L, определяется с помощью выражения где τ –отрезок вдоль L, L(x) – участок L между точкой (x1, x2) и детектором. Коэффициент аттенюации f (x1, x2) аналогичен коэффициенту поглощения, измеряемому в обычной компьютерной томографии. Поскольку в ПЭТ источник испускает две противоположно направленные частицы и излучение в обоих направлениях измеряется одновременно, выражение можно переписать как где L+, L− – отрезки линии L, разделенной на участки точкой х. Поскольку L+ + L− = L, то выражение приобретает вид Поскольку значения I и f (x1,x2) известны из измерений, основной математической задачей ПЭТ является определение функции g(x1, x2) по ее известным линейным интегралам. Эта математическая задача идентична задаче компьютерной томографии, рассмотренной выше. Отличительной особенностью ПЭТ изображений является их представление по цветной шкале. Цвет или степень яркости каждого пикселя пропорциональны концентрации изотопа в соответствующей точке объекта, что создает более наглядную картину. 5. Аппаратное обеспечение и контроль качества Использование ПЭТ в клинике накладывает требования на характеристики и производительность аппаратного и программного обеспечения цифровой обработки, отличающегося от систем, используемых в исследовательской деятельности. Разрешающая способность ПЭТ должна быть сбалансирована приемлемым уровнем шума изображений и высокой пропускной способностью системы. Для большинства ПЭТ систем приемлемым является внутреннее разрешение 6 мм по всем пространственным направлениям, позволяющее реконструировать изображения с разрешением в 8-10 мм. Такие системы имеют показатель расстояния дискретизации равный 3 мм по всем пространственным направлениям. Относительно однородное разрешение и дискретизация делает их пригодными к 3D визуализации. Пропускная способность – один из важных показателей системы. Часто требуется быстро подготовить томограф к следующему исследованию, получить, реконструировать и обработать данные, напечатать и заархивировать данные. Система должна позволять проводить исследования в нескольких режимах, включая статические, динамические, синхронизированные и прямолинейные исследования. Поле обзора ПЭТ сканеров должно позволять проводить как исследования отдельных органов, так и всего тела. Поле обзора таких систем равно 60см. Аксиальное поле обзора большинства современных томографов ограничивается приблизительно 10 см, что накладывает некоторые ограничения на исследования. Для используемых в клинике систем желательно расширить аксиальное поле обзора до 15 – 20 см, что позволит повысить эффективность исследований. Однако, из-за того, что детекторы вносят существенный вклад в стоимость томографа, возникает вопрос о предельной приемлемой стоимости ПЭТ сканера. Современные ПЭТ сканеры имеют до 16 плоскостей колец, что обеспечивает суммарно 31 поперечную плоскость. Разрешение составляет приблизительно 5 мм по всем направлениям. С дискретизацией 3 мм можно проводить исследования без изменений положений детекторов. Клинический ПЭТ сканер должен поддерживать широкий диапазон скоростей счета без существенных потерь в разрешающей способности и линейности. В большинстве исследований, вводимая активность не требует предельных скоростей счета. Но в кардиоисследованиях вводимая активность может требовать высоких скоростей счета, что приводит к существенным простоям аппаратуры. Большинство систем имеют встроенную систему коррекции простоя, обеспечивая линейную реакцию на вводимую активность. Однако, при таких высоких скоростях счета могут происходить потери в разрешении из-за наложения событий. Важным аспектом клинической ПЭТ является необходимость быстром и эффективном программном и аппаратном обеспечении, отвечающим за цифровую обработку. После завершения сбора информации, программное обеспечение должно позволять формировать предварительные изображения до ухода пациента. Конечные изображения при стандартных исследованиях должны быть готовы в течение одного часа после окончания исследования, что требует максимальной автоматизации процесса. Для обработки данных всех проведенных исследований необходима дополнительная мощность, реализуемая путем установки дополнительных рабочих станций и наличие единой сети для обмена информацией между станциями. 6. Радионуклиды, используемые в ПЭТ Радиоизотопы, используемые в ПЭТ и других подобных исследованиях, производятся с помощью ускорителя частиц, называемого циклотроном. Все используемые в ПЭТ испускающие позитроны радионуклиды имеют короткое время полураспада и высокую энергию излучения по сравнению с радиоизотопами, вообще используемыми в биомедицинских исследованиях. Основные радионуклиды, используемые в клинических исследованиях, это углерод 11C, азот 13N, кислород 15O и фтор 18F, поскольку эти химические элементы есть почти во всех соединениях в теле человека. Все они имеют короткий период полураспада, что позволяет вводить пациенту большие дозы препарата с низким лучевым воздействием и неоднократно проводить исследования. Радиоизотопы, используемые в ПЭТ
7. Достоинства и недостатки ПЭТ Системы ПЭТ универсальны, они используют все типы позитронных излучателей. Их отличает 100% достоверность диагностических результатов, которая достигается использованием поправок на нормализацию, мертвое время счетчика, затухание, рассеяние и распад, а также качественной и количественной обработкой информации. Они просты в использовании, имеют стандартные протоколы и автоматизированный контроль качества. ПЭТ сканеры позволяют параллельно собирать и обрабатывать данные, реконструировать изображения, анализировать результаты, что существенно повышает пропускную способность. Поскольку период полураспада радиоизотопов мал, лучевое облучение чрезвычайно мало и не затрагивает нормальные процессы тела. Это позволяет при необходимости проводить повторные исследования. Изображения, получаемые в ПЭТ, чаще всего представлены в соответствии с цветной шкалой, что делает результаты исследования более наглядными для диагностики. Например, здоровая ткань использует глюкозу для пополнения энергии и накапливает часть радиоактивной глюкозы. Злокачественная ткань потребляет больше глюкозы, чем здоровая и на ПЭТ изображении будет более яркой, чем нормальная ткань. Конструкция современных ПЭТ сканеров позволяет проводить исследования не только головного мозга, но и внутренних органов, что важно для раннего обнаружения злокачественных изменений. Одним из условий получения правильной картины распределения изотопа является отсутствие его перераспределения при проведении сканирования. В ряде случаев ПЭТ может дать ложные результаты, если химический баланс пациента нарушен. Например, у диабетиков причиной этого может послужить высокое содержание сахара или инсулина в крови. Возможности использования ПЭТ ограничиваются дороговизной томографов и необходимостью размещения их вблизи циклотрона. Создание новых радиофармпрепаратов, имеющих период полураспада несколько часов, позволяет частично решить ее. Кроме того, радиоизотоп рубидия-82 (период полураспада 76 с) можно получить не используя циклотрон. Этот изотоп создается с помощью разработанного в институте ядерных исследований им. Курчатова (Москва) генератора рубидия-82 и позволяет проводить исследования перфузии миокарда с высокой чувствительностью. Ценность ПЭТ растет при совместном проведении с другими исследованиями (КТ, МРТ). 8. ПЭТ/КТ сканеры Сравнительно недавно появились новые диагностические устройства ПЭТ/КТ сканеры. Они позволяют в одном исследовании получать функциональную (ПЭТ) и структурную (КТ) информацию, что достигается совмещением ПЭТ и КТ изображений. Кроме того, данные КТ могут использоваться для коррекции аттенюации ПЭТ изображений, что сокращает время исследования на 30%-40%. Эти преимущества делают ПЭТ/КТ более предпочтительным методом, чем обычное ПЭТ исследование. Недостатком метода является возникновение артефактов и количественных ошибок на ПЭТ-изображениях при коррекции аттенюации на основе данных КТ. Например, использование контрастирующих веществ и наличие металлических имплантов может привести к переоценки активности препарата в исследуемой области. Дыхание пациента приводит к несоответствию данных КТ и ПЭТ исследований (разные поля сбора данных) и артефактам. 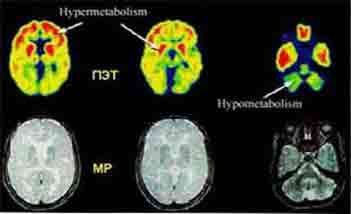 Конструктивно ПЭТ/КТ сканер представляет собой позитронно эмиссионный и компьютерный томографы, размещенные в одном гентри (обычно КТ блок расположен перед ПЭТ блоком). Современные ПЭТ/КТ сканеры имеют апертуру гентри 70 см и ширину 100 см. Оба сканера могут использоваться как вместе, так и независимо друг от друга. КТ сканер может быть многосрезовым с пошаговым или спиральным режимами сбора данных и различными скоростями вращения трубки; ПЭТ сканер может работать в двух или трехмерном режимах. Первым этапом сбора данных является получения базового изображения, служащего для задания границ области ПЭТ/КТ исследования. КТ изображения получают при напряжении 100-140 кВ и различных силах тока (в зависимости от цели исследования). Затем пациент автоматически перемещается в ПЭТ сканер и позиционируется в то же анатомическое положение. Сбор данных на этом этапе занимает 3-5 минут, затем ПЭТ изображения реконструируются с учетом коррекции на аттенюацию по КТ изображениям. Полученные КТ изображения имеют матрицу 512х512, а ПЭТ изображения матрицу 128х128. Одновременное получение функциональной и анатомической информации позволяет повысить качество исследования за счёт улучшения качества изображения и повышения точности определения пространственной локализации образований до 98%. 9. Области применения ПЭТ в медицине ПЭТ используется в различных областях медицины. Около 80% клинических ПЭТ исследований проводится в области онкологии, они позволяют дифференцировать злокачественные и доброкачественные образования, определять степень распространения опухолей чувствительностью, близкой к 100%. Исследования всего тела, занимающие 60-70 минут, позволяют определить метастазы любой локализации. ПЭТ не имеет альтернативы при ранней (через 1- 2 недели) оценке результатов химиотерапии. В кардиологии ПЭТ позволяет получать информацию о кровоснабжении миокарда, скорости метаболических процессов, оценить признаки болезни коронарной артерии, контролировать эффективность лечения. Для таких исследований используются ультракороткоживущие изотопы (13N, 18F, 11С). Данные ПЭТ важны при планировании аортокоронарного шунтирования. В неврологии ПЭТ используется для обнаружения неврологических болезней, включая эпилепсию, опухоли, дифференциации психических заболеваний. ПЭТ дает сведения о кровообращении мозга, скорости усваивания кислорода и глюкозы, отображает другие физиологические процессы. ПЭТ используется для измерения метаболизма глюкозы (единственного источника энергии клеток). Примерно через 40 минут после внутривенного введения радиоактивной глюкозы (чаще это изотоп 18ФДГ), радиоизотоп поступает в клетки и достигает равновесия. Затем его распределение измеряется в различных срезах. 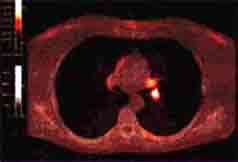 ПЭТ с 18F-ФДГ Подобные исследования проводятся при исследованиях болезней почек. Почки отличают высокий уровень метаболизма и поток крови, из-за чего регистрируемое изображение имеет высокое соотношение сигнал/шум. Также ПЭТ используется при изучение механизмов мозга, лежащих в основе человеческого создания: для исследования мозговой организации внимания, эмоций, мышления, творчества, общего интеллекта, способности ориентироваться, т.е. всех аспектов деятельности мозга, которые делают его настолько неповторимым и сложным объектом. Исследования проводятся путем измерения распределение потока крови в мозге. Предполагается, что увеличение потока крови связано с увеличенной функциональной деятельностью. Чтобы достигнуть активации радиоизотопа (15O) требуется примерно 3-5 минут, после чего можно измерить его распределение. Затем с помощью кодируемых цветом изображений можно видеть, где мозг активизирован во время некоторых действий. Например, когда человек говорит или читает, правое полушарие мозга "светится".В ряде научных центров с помощью ПЭТ проводят исследования лекарств, их распределение и действие на организм. 10. Заключение Таким образом, ПЭТ является высокоинформативным методом лучевой диагностики, позволяя за одно исследование оценить стадию заболевания, получив изображение первичной опухоли, региональных и отдаленных метастазов, в том числе ранее непредвиденных, что зачастую кардинально меняет тактику ведения пациента. В исследованиях головного мозга ПЭТ наиболее эффективен при неясно очерченных взаимоотношениях между анатомическими нарушениями и неврологическими симптомами, дополняя данные МРТ и КТ, а при обнаружении мозговой дисфункции в структурно неизмененных областях мозга обеспечивая объективные доказательства неврологического дефицита на диагностические и лечебные мероприятия. 11. Список литературы Марусина М.Я, Казначеева А.О. Современные виды томографии. Учебное пособие. Труфанов Г.Е. Лучевая диагностика: учебник Т.1. ГЭОТАР-Медиа, 2007 - 95 стр. ПЭТ в клинической практике / Рудас М.С. Насникова И.Ю. Матякин Г.Г. http://www.ims-mos.ru/pet/discovery/ |
