Реферат Основные биохимические константы Выполнил Хамитов А. М
 Скачать 214.5 Kb. Скачать 214.5 Kb.
|
|
Башкирский государственный университет Реферат Основные биохимические константы Выполнил : Хамитов А.М. Кровь – жидкая ткань организма, которая выполняет такие функции, как транспортная, дыхательная, защитная, терморегуляторная, коммуникативная, гуморальная. Общий объем крови у взрослого человека составляет 4 – 5,5 литров или 60 мл/кг, или 8% от массы тела. У новорожденных относительный объём крови выше, чем у взрослых. У новорожденных он равен 147 мл/кг, в возрасте 1 год - 110 мл/кг. Кровь состоит из форменных элементов и плазмы. Vформ/Vкрови= гематокрит. У взрослых он составляет около 45%, у новорожденных повышен до 60-67%, а к 1-у году снижается до 39%. Биохимия эритроцитов. Эритроциты состоят на 60-70% из воды, 30-40% приходится на сухой остаток, который представлен белками, азотсодержащими небелковыми веществами, углеводами, липидами, минеральными веществами. Химический состав эритроцитов. Основным белком эритроцитов является гемоглобин. На него приходится 90% всех белков эритроцитов. У взрослого содержание гемоглобина находится в интервале 120-140 г/л, новорожденного его уровень повышен до 190 г/л. Г 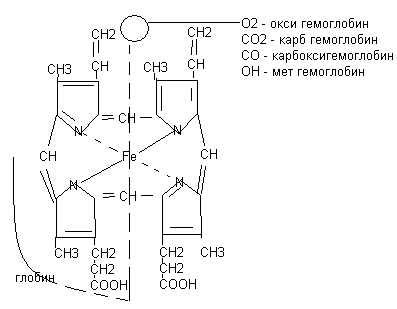 емоглобин по своей химической природе относится к гемопротеидам, состоит из простатической группы гема и белка глобина. Гем - тетрапирольное железосодержащее органическое вещество. Гем соединяется с гемоглобином гидрофобными связями и координационной связью с железом. Гемоглобин является олигомерным белком, включает в свой состав 4 гема и 4 полипептидные цепи. В зависимости от вида полипептидных цепей различают физиологические и аномальные формы гемоглобина: Физиологические формы гемоглобина
Аномальные формы гемоглобина появляются при гемоглобинозах, среди которых выделяют гемоглобинопатии и талассемии. При гемоглобинопатиях нарушается первичная структура α цепей или β цепей. Например, в HbS, выявляемый при серповидноклеточная анемия в 6 положении β цепи глютамат заменяется на валин, вследствие чего нарушается структура и функция гемоглобина, эритроциты приобретают серповидую форму. В HbC в 6 положении β цепей происходит замена глютамат на лизин. При талассемиях происходит замедление синтеза либо α цепей, либо β цепей гемоглобина, увеличивается доля минорного гемоглобина А2. Кроме гемоглобина в эритроцитах присутствуют другие белки, к которым относят:
Небелковые азотсодержащие вещества эритроцитов представлены АТФ, нуклеотидами, трипептидом глютатионом. К безазотистым органическим веществам эритроцитов относятся углеводы (глюкоза, продукты её обмена), все классы липидов Минеральные компоненты эритроцитов представлены К - 120-130 моль/л; Na - 30-35 ммоль/л; Fe – 19 мкмоль/л. Особенности метаболизма в эритроцитах Основным энергетическим процессом в эритроцитах является гликолиз. В эритроцитах активен пентозофосфатный путь, который обеспечивает эритроциты НАДФН2, необходимым для восстановления глютатиона и поддержания резистентности эритроцитов. Обмен гемопротеидов Помимо гемоглобина к гемопротеидам относятся миоглобин, цитохромы, ферменты каталаза, монооксигеназы. Синтез гемоглобина происходит в ретикулоцитах, эритробластах, в печени, костном мозге, селезенке, тимусе. Исходными веществами для синтеза гема являются активная форма янтарной кислоты (сукцинил КоА - из цикла Кребса) и аминокислота глицин. Промежуточные соединения процесса синтеза гема представлены аминолевулиновой кислотой (АЛК), порфобилиногеном, уропорфириногеном, копропорфириногеном, протопорфирином. При соединении 2 –х молекул АЛК образуется порфириновое кольцо порфобилиногена. Затем происходят изменения боковых радикалов до появления 4-х метильных, 2-х винильных и 2-х остатков пропионовой кислоты. Нарушения синтеза гема проявляются в виде порфирий. При порфириях либо искажается синтез гема, либо блокируется на каком - то этапе синтез гема. Выделяют печеночные и эритропоэтические порфирии. Например, при анемии Гюнтера блокируется синтез уропорфириногена, что сопровождается развитием анемии, фотодерматитов, выделением мочи оранжевого цвета (из-за большого количества порфиринов в ней), появлением коричневого оттенка эмали зубов. 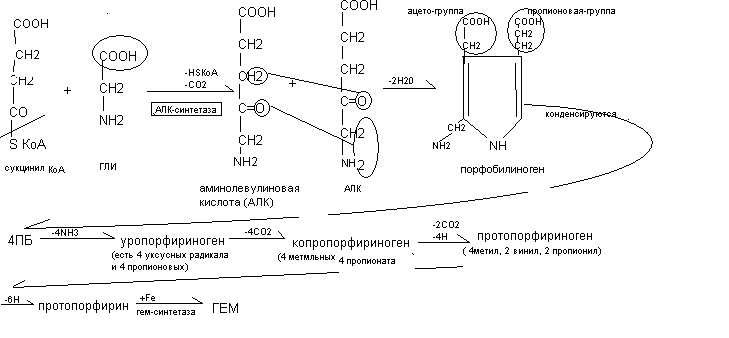 Распад гемоглобина осуществляется в процессе переваривания гемопротеидов в желудочно–кишечном тракте и в тканях при распаде эритроцитов. В желудке в процессе переваривания под действием пепсина отщепляется глобин, к гему присоединяется HCl с образованием солянокислого гематина коричневого цвета. Поэтому при желудочных кровотечениях содержимое желудка приобретает шоколадный оттенок. В кишечнике отщепляется соляная кислота, и постепенно формируются пигменты дегтярно-черного цвета. Поэтому при кишечных кровотечениях стул имеет чёрный цвет. Распад гемоглобина в тканях происходит при распаде эритроцитов (у взрослых через 120 дней, у детей около 80 дней) в лимфоидных клетках, костном мозге, селезенке, печени. Освободившийся гемоглобин при распаде эритроцитов соединяется с белком гаптоглобином и транспортируется в клетки РЭС (ретикуло-эндотелиальная - система), где происходит распад гемоглобина. 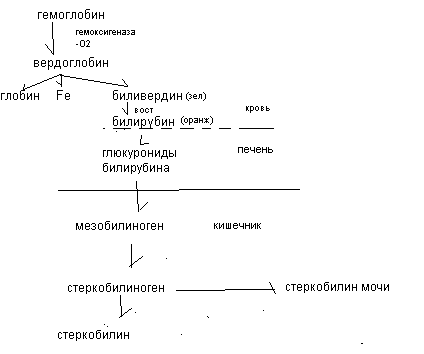 На первом этапе под действием гемоксигеназы происходит разрыв одного метинового мостика. Тетрапиррольная структура гемоглобина разворачивается и образуется вердоглобин. Вердоглобин расщепляется на глобин, железо и биливердин (пигмент зелёного цвета). Затем биливердин восстанавливается в билирубин (оранжево-желтый пигмент). Билирубин плохо растворим в воде и очень токсичен. Для транспорта гидрофобного билирубина в печень происходит его адсорбция на белках плазмы крови, вследствие чего повышается гидрофильность билирубина. Эта форма билирубина называется свободный билирубин (неконъюгированный), так как химически он с белками не связан или непрямой билирубин, так как он даёт цветную реакцию не сразу, а после осаждения белков. Непрямой билирубин поступает в печень, захватывается гепатоцитами и обезвреживается путём присоединения к нему глюкуроновой кислоты с образованием сначала моноглюкуронида, а затем диглюкуронида билирубина. Эта форма билирубина также имеет 2 названия: связанный билирубин, так как он химически связан с глюкуроновой кислотой или прямой билирубин, так как сразу даёт качественную цветную реакцию. Далее прямой билирубин с затратой энергии АТФ экскретируется в жёлчь, и в составе жёлчи поступает в тонкий кишечник. В кишечнике под действием микрофлоры отщепляется глюкуроновая кислота и образуется новый пигмент мезобилиноген (уробилиноген). Часть его по vena porta поступает в печень, где разрушается до дипирролов и трипирролов и выводится жёлчью. Другая часть в кишечнике переходит в стеркобилиноген. Основная часть стеркобилиногена (около 300 мг) выводится через кишечник в виде стеркобилиногена (коричневый пигмент). Другая часть его по системе геморроидальных вен попадает в кровь и выводится через почки в составе мочи (около 4 мг). Нарушения распада гема. Концентрация билирубина в крови не высока, составляет 2(8)-20 мкмоль/л Повышение уровня билирубина в крови - гипербилирубинемия клинически проявляется в виде желтухи. Непрямой билирубин нейротоксичен. Прямой билирубин водорастворим и может выводиться с мочой. По месту нарушения пигментного обмена различают гемолитические желтухи (надпечёночные), паренхиматозные (печёночные), механические (подпечёночные). По характеру повышения фракций билирубина выделяют конъюгированные, неконъюгированные и смешанные желтухи. Неконъюгированные (гемолитические) желтухи развиваются при усиленном гемолизе эритроцитов. В крови отмечается повышенное содержание непрямого билирубина. Содержимое кишечника пигментировано, поскольку в печени повышено образование стеркобилиногена. В моче также повышено содержание стертобилина и уробилина, она имеет тёмный цвет. Разновидностью неконьюгированных желтух является болезнь Жильберта, при которой снижено поступление и захват билирубина гепатоцитами. Смешанные (паренхиматозные) желтухи развиваются при поражении печени. При данном виде желтухи в крови повышен и непрямой билирубин, так как печень не может его обезвредить, и прямой билирубин, так как затруднено его выведение в жёлчь. Моча пигментирована, в ней присутствуют билирубин и уробилин. Содержимое кишечника более светлое, так как снижено образование и выведение стеркобилина. Разновидностью смешанной желтухи является желтуха Криглера-Найяра, при которой в печени снижена активность фермента глюкурнилтрансферазы. Механические (конъюгированные) желтухи развиваются при нарушениях оттока жёлчи (опухоль, камень). В крови повышено содержание прямого билирубина. Моча пигментирована за счёт присутствия билирубина, а содержимое кишечника светлое (ахоличное). Разновидностью коньюгированной желтухи является желтуха Дубина – Джонсона, при которой затруднено выведение прямого билирубина в жёлчь. При желтухе новорожденных концентрация билирубина может повышаться до 40 мкмоль/литр и выше. Причинами неонатальной желтухи являются усиленный гемолиз эритроцитов, сниженный захват билирубина гепатоцитами, снижение активности глюкуранилтрансферазы, снижение экскреции прямого билирубина в жёлчь, стерильность кишечника. Химический состав плазмы крови 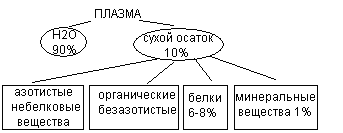 Белки плазмы крови Белки являются основными компонентами плазмы крови. Общее содержание белков плазмы крови у взрослых составляет 60-80 г/л. Концентрация белков в плазме крови у новорожденных равняется 56 г/л, повышаясь у годовалых детей до 65 г/л. Белки плазмы крови выполняют ряд важных функций:
Методом высаливания белки плазмы крови делятся на 3 фракции: альбумины - 30-50 г/л, глобулины- 20-30 г/л, фибриноген - 2-4 г/л Методом электрофореза на бумаге все белки плазмы крови делятся на 5 фракций: альбумины и α1, α2, β, γ - глобулины На альбумины приходится 60% всех белков плазмы крови. Альбумины имеют молекулярную массу меньше 100 тысяч д, богаты полярными гидрофильными аминокислотами, электрофоретически подвижны. Альбумины растворяются в дистиллированной воде, высаливаются 100% раствором (NH4)2SO4. Альбумины, синтезируются в печени, выполняют транспортную функцию, определяют физико-химические свойства крови. Глобулины составляют 40% всех белков плазмы крови. Глобулины – гетерогенная фракция белков. Содержание α1-глобулинов равняется 4%, α2 - глобулинов - 8%, β- глобулинов -12%, γ- глобулинов - 16%. Молекулярная масса глобулинов около 200 тысяч д. Они менее гидрофильны, растворяются в 10% растворах солей, осаждаются 50% (NH4)2SO4. Глобулины синтезируется в печени, лимфоцитах, макрофагах. К основным функциям глобулинов относятся транспортная, защитная функции. В составе глобулиновой фракции выделяют отдельные белки. Белки α1 - глобулиновой фракции Протромбин - белок свёртывающей системы крови α1- гликопротеид – переносит некоторые стероидные гормоны α1 – антитрипсин – ингибитор трипсина Орозомукоид – гликопротеид, ингибитор протеаз, обладает иммуномодуляторным действием Белки α2-фракции глобулинов Гаптоглобин – переносит гемоглобин α2- макроглобулин – обладает антипротеазной активностью, является ингибитором свёртывающей и фибринолитической системы крови, ингибитор синтеза кининов С-реактивный белок даёт реакцию преципитации с пневмококком, обладает антипротеазной активностью. Церулоплазмин – медьпереносящий белок, обладает ферментативной оксидазной активностью. Белки β - фракции глобулинов С реактивный белок – белок, участвующий в воспалительной реакции Трансферрин – переносит железо, входит в антиоксидантную систему крови. Гемопексин – переносит гемм, порфирины, гемоглобин Фибриноген – фактор свёртываемости крови. Белки γ- фракции глобулинов представлены антителами или иммуноглобулинами (Ig) 3-х основных видов: G, А, М и минорными: Д, Е. У новорожденных представлены все виды иммуноглобулинов, но содержание их ниже, чем у взрослых людей. В этот период основным является IgG, который проходит плацентарный барьер и попадает в плод из организма матери. К возрасту 1 год содержание IgG становится равным его содержанию у взрослых, к 2 годам концентрация IgА достигает уровня взрослых. Все иммуноглобулины построены по одному принципу. В их составе представлены две тяжелых Н цепи (500-60 аминокислот) и две легких L цепи (до 200 аминокислот), цепи соединяются дисульфидными связями. Вторичная структура Н и L цепей имеет β - складчатую укладку, цепи параллельны, в их составе выделяют доменные участки. В составе цепей есть постоянные участки и вариабельные участки, за счёт которых и происходит взаимодействие Ig с большим количеством антигенов. В IgА содержатся 3 «вилки», в IgМ – 5 «вилок». В плазме крови в небольшой концентрации присутствуют белки интерфероны (ИФ) различных видов: α – (ИФА) синтезируются в лимфоцитах и макрофагах β – (ИФБ) синтезируются в фибробластах γ – (ИФГ) синтезируются в различных тканях и в Т-лимфоцитах Интерфероны обладают антипролиферативным действием, стимулируют дифференцировку клеток, оказывают противоопухолевый эффект, активируют иммунные процессы. Концентрация интерферонов возрастает при вирусных заболеваниях. Интерфероны обладают антивирусной активностью, которая связана с активацией иммунитета, угнетением РНК - полимеразы, активацией РНК - азы. Ферменты плазмы крови делятся на 3 группы. Секреторные ферменты синтезируются в печени и секретируются в кровь. Их примерами являются холинэстераза, факторы свёртывания крови. В норме активность ферментов данной группы выше, чем при заболеваниях. Экскреторные ферменты синтезируются в печени, экскретируются в жёлчь (щелочная фосфатаза). При заболеваниях активность экскреторных ферментов увеличивается. Индикаторные ферменты в норме практически отсутствует в плазме крови, при заболеваниях их активность растёт. Изменение белкового состава крови при заболеваниях Гипопротеинемия - снижение общего содержания белков в плазме крови. Она может встречаться при белковом голодании, заболеваниях желудочно–кишечного тракта, печени, почек. Диспротеинемия - изменение соотношения отдельных фракций белков (в норме альбумин-глобулиновый коэффициент равен 1,5:1,9). В острой стадии воспалительных заболеваний в плазме увеличивается содержание глобулинов α и β фракций. К белкам острой стадии воспаления относятся, в частности, гаптоглобин, орозомукоид, с– реактивный белок. Считается, что белки острой фазы воспаления оказывают защитное действие на ткани, угнетают агрессивные протеолитические ферменты тканей. При хронических заболеваниях в плазме увеличивается содержание иммуноглобулинов. Парапротеинемия - появление в плазме патологических белков, таких как криоглобулины (осаждаются при температуре ниже 37 о), пироглобулинов (осаждается при 60-80о С), фетопротеин ( эмбриональный белок). Небелковые азотсодержащие вещества. Сумма низкомолекулярных азотистых веществ, остающихся в крови после осаждения белков, называется остаточным азотом (RN). В норме он составляет 15-25 ммоль/л. 50% остаточного азота составляет мочевина, концентрация которой равняется 3,3-8 ммоль/л, 25% остаточного азота приходится на аминокислоты. В состав остаточного азота крови входят также пептиды, мочевая кислота (0,2-0,4 ммоль/л), аммиак (20-80 мкмоль/л), билирубин (2-8,20 мкмоль/л), креатинин (60-130 мкмоль/л). Большинство из компонентов остаточного азота являются конечными продуктами азотистого обмена, которые выводятся через почки. В связи с этим при патологии почек содержание RN резко увеличивается, развивается симптом ретенционной азотемии. Продукционная азотемия встречается при увеличенном распаде белков, онкологических заболеваниях. Одной из фракций остаточного азота являются кинины. Кининовая система крови. Кинины представлены пептидом брадикинином (9 аминокислотных остатков), каллидином (10 остатков аминокислот) и лизил-метионил-брадикинином (содержит 11 аминокислот). Биологическое действие кининов моногообразно. Они регулируют гемодинамику, увеличивают работу сердца, расширяют сосуды, вызывают спазм гладкой мускулатуры бронхов, матки, являются медиаторами воспаления, участвуют в регуляции свёртывающей и антисвёртывающей системы крови, обладают иммуномодуляторным действием. 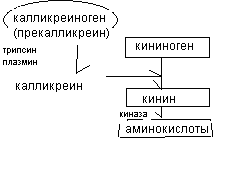 Кинины синтезируются из неактивных кининогенов - белков предшественников. В синтезе кининов участвуют протеолитические ферменты каликренины. Калликренины, в свою очередь, образуются из неактивных каликрииногенов (прекалликреиногенов), при участии трипсина, плазмина крови. Распад кининов до аминокислот осуществляется ферментами кининаазами. Безазотистые органические вещества крови К безазотистым органическим веществам крови относятся углеводы и липиды. Глюкоза содержится в крови в концентрации 3,3-5,5 ммоль/л. В крови присутствуют различные метаболиты углеводного обмена (пируват, лактат, и другие). Содержание сиаловых кислот составляет 2,2-2,6 ммоль/л. Общее содержание липидов у взрослых людей находится в интервале 4-8 г/л. Концентрация триацилглицеринов составляет 1,5-2,5 ммоль/л, фосфолипидов - 2,5-3,5 ммоль/л, холестерина - 3,5-5,2 ммоль/л, свободных жирных кислот - 0,4-0,8 ммоль/л. У детей содержание всех видов жиров, кроме свободных жирных кислот, ниже, чем у взрослых. Минеральные вещества крови Основным минеральными компонентами плазмы крови являются натрий, концентрация которого составляет(130 ммоль/л) и хлориды (98-107 ммоль/л). Значительно ниже уровень калия (4-5 ммоль/л) и железа (19 мколь/л). Физико-химические свойства крови. Плотность крови равняется 1,050-1,060 г/см3, зависит от суммы растворённых в крови веществ. Плотность крови определяется прибором ареометром. Вязкость крови равна 5-6 единиц относительно вязкости дистиллированной воды, определяется вискозиметрическим методом (оценивается вязкость по скорости перемещения жидкости) Осмотическое давление крови составляет 7,8-8,1 атмосферы. Для определения осмотического давления используют криоскопический метод, основанный на сравнении температуры замерзания плазмы крови и воды. Осмотическое давление учитывается при внутривенном введении жидкости. Жидкости с осмотичеким давлением, равным осмотическому давлению крови, называются изотоничными (0,9% NaCl, 5% глюкоза). Их можно вводить в кровь в достаточно большом объёме. Жидкости с более высоким осмотическим давлением – гипертонические растворы (40% глюкоза). Введение этих жидкостей допустимо в небольших объёмах, т.к. они вызывают обратимое сморщивание эритроцитов. Растворы с более низким давлением – гипотонические (дистиллированная вода). Введение гипотонических растворов недопустимо, поскольку они вызывают набухание и разрыв эритроцитов. рН крови находится в интервале 7,36-7,44. Отклонение рН от физиологических значений инактивирует ферменты, поэтому величина рН поддерживается на постоянном уровне физиологическими регуляторами рН (лёгкие, почки, желудочно–кишечный тракт, потовые железы) и физико-химическими регуляторами (буферные системы крови). Буферные системы включают акцептор протонов (чаще соль) и донор протонов (чаще кислота). Величина рН, которую создает буферная система, рассчитывается по формуле: рН= рК + lg ([акц]/[дон]). В крови человека присутствует четыре буферные системы:
Буферная емкость крови достаточно высока. Для сдвига рН на 0,1 единицы необходимо добавить 4,5 мл 0,1n NаНСО3 Бикарбонатная буферная система представлена Н2СО3, и NаНСО3.. Так как угольная кислота слабая, то оценивается концентрация СО2 . Угольная кислота является донором протонов: Н2СО3→Н+ + НСО3- - противодействует защелачиванию. Акцептором протонов является соль: НСО3-- + Н+→ Н2СО3. рН=рК + lg ([НСО3-]/[0,03 Н2СО3]). В физиологических условиях поддерживается соотношение НСО-3/ Н2СО3= 20/1 Гемоглобин - оксигемоглобиновая буферная система включает ННв и ННвО2. Донором протонов является ННвО2 . В лёгких происходит уменьшение концентрации угольной кислоты, что могло бы сопровождаться защелачиванием. Но ННвО2 диссоциирует на протон Н+ и анион НвО2- и препятствует сдвигу рН. Акцептром протонов является ННв. В тканях увеличивается содержание углекислоты, что могло бы вести к закислению, но происходит связывание протонов по реакции: Н+ + НвО2-→ ННвО2→ ННв + О2 , что противодействует закислению. В сумме на бикарбонатную и гемоглобин – оксигемоглобиновую системы приходится до 80% буферной ёмкости крови. Обе они функционируют вместе с лёгкими. Белковая буферная система обусловлена амфотерными свойствами белков. Акцептором протонов являются аминогруппы белков: белок-NН2 + Н+ → белок NН3 + (противодействие закислению). Донором протонов служат карбоксильные группы белков: белок - СООН → СОО - + Н+ (противодействие защелачиванию). На долю белкового буфера приходится до 18% всей буферной емкости крови. Фосфатная буферная система представлена фосфатами НРО42- / Н2РО4-. Однозамещённый фосфат является акцептором протонов: НРО42— + Н+→ Н2РО4-(противодействие закислению). Донором протонов служит двузамещённый фосфат: Н2РО4-→ НРО42- + Н+ (противодействие защелачиванию). рН= рК + lg ([НРО42-]/[ Н2РО4-]). Физиологические значение рН система поддерживает при соотношении Nа2НРО4 / NаНРО4 = 4:1. На долю фосфатной буферной системы приходится около 4-5% буферной ёмкости крови. Она функционирует в основном с почками. Нарушение кислотно-основного баланса. Изменения кислотно–основного баланса могут быть двух видов: ацидозы – закисление среды и алкалозы – защелачивание среды. По степени выраженности ацидозы и алкалозы делят на 3 группы:
По механизму развития выделяют следующие виды ацидозов и алкалозов:
Для диагностики различных видов ацидозов и алкалозов применяют аппаратные методы измерения величины рН при разной концентрации СО2 в крови. По специальным графикам-номограммам определяют несколько показателей кислотно-основного состояния.
а) АВ - истинные (актуальные) бикарбонаты, содержащиеся в данных условиях б) SB - стандартные бикарбонаты), содержащиеся в стандартных условиях: рСО2 = 40 мм рт. ст., ННвО2 = 100%, t = 380. Содержание SB равно 29-28 ммоль/л
а) ВВ - реальные буферные основания, содержащиеся в физиологических условиях б) NВВ - нормализованные буферные основания, содержащиеся в стандартных условиях. Их концентрация равна 32-65 ммоль/л
Дыхательные ацидозы возникают при задержке СО2 при заболеваниях лёгких (пневмония, пневмосклероз). Развивается сдвиг рН крови в кислую сторону в силу накопления угольной кислоты. Повышение парциального давления СО2 сопровождается увеличением концентрации бикарбонатов и увеличением АВ. Это, в свою очередь, приводит к незначительному возрастанию ВЕ. Метаболические ацидозы возникают при накоплении в тканях кислых компонентов (молочная кислота, кетоновые тела), при задержке протонов в организме при заболеваниях почек. рН крови смещается в кислую сторону. Использование бикарбонатов для нейтрализации кислот ведёт к уменьшению АВ и, соответственно, к снижению парциального давления рСО2. Уменьшение содержания бикарбонатов сопровождается значительным снижением величины ВЕ. Респираторные алкалозы наблюдаются при учащении дыхания и уменьшении содержания углекислоты. Реакция крови смещается в щелочную сторону. Дефицит углекислоты (↓рСО2) сопровождается снижением уровня АВ и, как следствие, уменьшением ВЕ. Метаболические алкалозы возникают при потере кислот из организма. Например, при потере НСl при рвоте, избыточном выведении протонов через почки (при гиперальдерстеронизме) или при введении в организм щелочных компонентов. Реакция крови смещается в щелочную сторону. Накопление бикарбонатов крови сопровождается повышением концентрации СО2 и значительным избытком ВЕ. Особенности кислотно-основного состояния у детей. У новорожденных выявляется более кислая реакция крови (рН может снижаться до 7,2), что связанно с высокой концентрацией лактата в крови. У новорожденных снижено р СО2, т.к. выше частота дыхания. У детей имеют место дефицит ВЕ (отрицательные значения ВЕ), т.к. повышено образование лактата и снижена способность почек к выведению протонов. У детей первых лет жизни выражена склонность к ацидозу. Дыхательная функция крови Транспорт кислорода Перенос кислорода от лёгких к тканям кровью осуществляется в 2 формах: в растворённом состоянии и в виде оксигемоглобина. Растворенный в плазме кислород составляет около 1,5% от всего переносимого кровью кислорода или 0,03 мл/100 мл крови. Невысокое содержание данной формы кислорода связано с его ограниченной растворимостью в воде. Величина растворённого в крови кислорода может быть увеличена при гипербарической оксигенации В виде оксигемоглобина переносится основная часть кислорода крови. Связывание кислорода с гемоглобином зависит от целого ряда факторов и, прежде всего, от парциального давления кислорода. В артериальной крови оно равно 80 мм рт. ст., в венозной -30-40 мм рт. ст. Соответственно насыщение гемоглобина кислородом в артериальной крови составляет 100%, в венозной крови около 70%. К 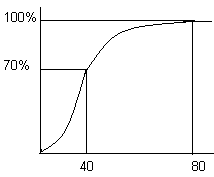 ривая насыщения гемоглобина кислородом носит S-образный характер. Это обусловлено кооперативными изменениями конформации протомеров в олигомерном гемоглобине. Соединение кислорода с одним протомером резко повышает чувствительность к кислороду других протомеров. Такой характер кривой обеспечивает способность гемоглобина связывать и отдавать кислород в широком диапазоне его парциального давления. Отдача и поглощение кислорода составляют 30% или 5-6 мл/100 мл крови. На характер кривой насыщения гемоглобина кислородом влияют:
Особенности транспорта кислорода у детей связаны с высоким содержанием фетального гемоглобина (НвF), который более прочно удерживает кислород, что отражает особенности внутриутробного дыхания. Фетальный гемоглобин имеет более короткий срок жизни, он легче окисляется. Нарушения транспорта кислорода Нарушения транспорта кислорода сопровождаются развитием гипоксии (дефицит кислорода в тканях). Различают высотную, альвеолярную (заболевания легких), циркуляторную (нарушение кровообращения), тканевую (нарушение тканевого дыхания), гемическую гипоксии. Гемическая гипоксия может носить характер гемолитической (гемолиз эритроцитов), железодефицитной, может также вызываться появлением форм гемоглобина, не способного переносить кислород. К данным формам относится карбоксигемоглобин и метгемоглобин. Карбоксигемоглобин образуется при соединении гемоглобина с угарным газом (СО) в концентрации более 0,1%. Не участвует в транспорте кислорода метгемоглобин-ОН, образующийся при действии сильных окислителей, в частности, нитратов. Транспорт СО2. Перенос углекислого газа от тканей к лёгким осуществляется кровью в 3-х формах:
Основной транспортной формой углекислого газа являются бикарбонаты. В тканях в процессах тканевого дыхания накапливается угольная кислота: СО2+Н2О→Н2СО3.. Затем она связывается с калиевой солью гемоглобина с образованием в эритроцитах бикарбоната калия: Н2СО3+КНв→КНСО3+Нв. Образовавшийся КНСО3 транспортируется в лёгкие В лёгких происходит образование оксигемоглобина: ННв+О2→ННвО2... Затем происходит взаимодействие оксигемоглобина с бикарбонатами с образованием угольной кислоты: ННвО2 +КНСО3 →Н2СО3. Образовавшаяся угольная кислота распадается с выделением углекислого газа, удаляемого при дыхании: Н2СО3→Н2О+СО2 Регуляция агрегатного состояния крови (РАСК) Свёртывающая система крови. Свёртывающая система крови - это биологическая система, поддерживающая жидкое состояние крови и препятствующая кровопотере путём образования кровяного сгустка или тромба. В свёртывании крови выделяют 2 стадии:
Плазменные факторы свёртывающей системы крови Плазменнные факторы гемокоагуляции классифицированы в 1954 Колером (ХIII факторов). Плазменные факторы чаще всего обозначают римскими цифрами. Общая характеристика плазменных факторов свёртывающей системы крови.
а) путём их частичного протеолиза б) путём их взаимодействия с кофакторами в) путём их взаимодействия с фосфолипидами мембран клеток и ионами кальция, что сопровождается конформационными перестройками.
Все плазменные факторы свёртывающей системы крови помимо римской цифры имеет тривиальное название чаще всего по фамилиям больных, у которых был обнаружен дефицит этих факторов.
Схема свёртывания крови. Выделяют три главных стадии гемокоагуляции:
Различают 2 механизма гемокоагуляции: внутренний механизм свертывания (в нём участвуют факторы, находящиеся внутри сосудистого русла) и внешний механизм свертывания крови (в нем помимо внутрисосудистых факторов участвуют ещё и внешние факторы). Внутренний механизм ввертывания крови (контактный) Внутренний механизм гемокоагуляции запускается при повреждении эндотелия сосудов (например, при атеросклерозе, при действии высоких доз катехоламинов). В этом случае в участке повреждения обнажается субэндотелиальный слой, в котором присутствует коллаген, фосфолипиды. К этому участку присоединяется ХII фактор (пусковой фактор). Взаимодействуя с измененным эндотелием, он претерпевает конформационные структурные изменения и становится очень мощным активным протеолитическим ферментом. ХIIа фактор одновременно участвует в свёртывающей системе, антисвёртывающей системе кининовой системе:
1 стадия внутреннего механизма свёртывания крови – образование полного тромбопластина крови ХII фактор, контактируя с поврежденным эндотелием, переходит в ХII активный. ХIIа активирует прекалликреин (ХIY), который активирует кининоген (ХY). Кинины, в свою очередь, повышают активность ХII фактора. ХII фактор активирует фактор ХI, который затем активирует IХ фактор (ф. Кристмаса). Фактор IХа взаимодействует с фактором YIII и ионами кальция. В результате образуется комплекс, включающий фермент, кофермент, ионы кальция (ф.IХа, ф.YIII, Са2+). Данный комплекс активирует Х фактор при участии тромбоцитарного фактора Р3. В результате образуется активный тромбопластин крови, включающий ф.Ха, ф.Y, Са2+ и Р3 Р3- представляет собой фрагмент мембран тромбоцитов, содержит липопротеиды, богат фосфолипидами 2 стадия – образование тромбина Активный тромбопластин крови запускает 2 стадию свёртывания крови, активируя переход протромбина в тромбин (ф.II →ф.II а). Тромбин активирует внешний и внутренний механизмы гемокоагуляции, а также антисвёртывающую систему, агрегацию тромбоцитов и высвобождение тромбоцитарных факторов. Активный тромбин запускает 3 стадию свёртывания крови. 3 стадия заключается в образовании нерастворимого фибрина (I фактор). Под воздействием тромбина растворимый фибриноген последовательно переходит в фибрин- мономер, а затем в нерастворимый фибрин-полимер. Фибриноген – водорастворимый белок, состоит из 6 полипептидных цепей, включающих 3 домена. Под действием тромбина от фибриногена отщепляются пептиды А и В, и в нём формируются участки агрегации. Фибриновые нити соединяются вначале в линейные цепи, а затем формируются ковалентные межцепочечные сшивки. В их образовании участвует ХIIIа фактор (фибринстабилизирующий), который активируется тромбином. Под действием фактора ХIIIа, являющегося ферментом трансамидиназой, в фибрине в процессе его полимеризации возникают связи между глютаминовой кислотой и лизином. Фибриновый сгусток подвергается сжатию (ретракции) за счёт энергии АТФ и фактора Р8 (ретрактоэнзим). Механизм свертывания носит каскадный характер, т.е. усиливается от предшествующего этапа к последующему благодаря наличию обратных связей. Так, фактор IIа активирует ХIII фактор, Y фактор, Р3 и YIII фактор. 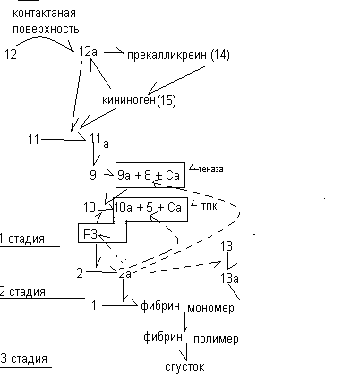 Внешний механизм свертывания крови (прокоагулянтный) 1 стадия – образование активного тромбопластина тканей включается при травме, разрыве сосуда и контакте плазмы крови с тканями. Тканевой тромбопластин (фактор III) в плазме крови активирует YII фактор. В результате образуется активный тромбопластин тканей, состоящий из фермента, кофермента и ионов кальция (ф.III ,ф.YII а, Са2+). 2 стадия – образование тромбина происходит в следующей последовательности: тромбопластин тканей активирует Х фактор с образованием комплекса, включающего ф. Ха, ф.Y, Са2+, который активирует тромбин (ф. II→ф.IIа). 3 стадия – образование фибрина осуществляется при воздействии тромбина на фибриноген. Витамин К, нафтохинон, антигеморрагический витамин В  ажную роль в свёртывании крови играет витамин К. Суточная потребность в нём составляет 10-20 мкг. Витамин К необходим для синтеза факторов II ,YII, IХ и Х, в которых образуется γ - карбоксиглютаминовая кислота с добавочной карбоксильной группой. В результате данной реакции повышается кальций связывающаяя способность указанных факторов свёртывания крови. Противосвёртывающая система крови. Противосвёртывающая система уравновешивает активность свёртывающей системы. Она включает компоненты, противодействующие факторам свёртывания крови на каждой стадии гемокоагуляции.
Факторы противосвёртывающей системы называются антикоагулянтами. Антитромбопластины – антикоагулянты, препятствующие образованию тромбопластина. К ним относятся белки, фосфолипиды:
Тромбиновый компонент антисвёртывающей системы – активный тромбин запускает противосвёртывающий каскадный механизм. Тромбин взаимодействует с особым белком эндотелия сосудов тромбомодулином с образованием комплекса: тромбомодулин, Са2+ , IIа. Этот комплекс активирует протеазу, обозначаемую как протеин «С». Протеин «С» взаимодействует с кофактором - протеином «S» и ионами кальция. Комплекс, включающий протеин «С», протеин «S», Са2+ разрушает Y и YIII факторы свёртывания крови. 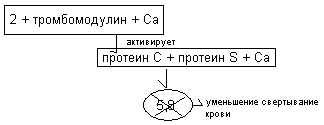 Антитромбины инактивируют тромбин. Наиболее активным является антитромбин 3 – гликопротеид, синтезирующийся в печени, эндотелии. Антитромбин 3 активируется гепарином, разрушает тромбин, уменьшая активность свёртывающей системы. Фибринолитическая система подвергает расщеплению (фибринолизу) образовавшийся кровяной сгусток. Основным компонентом фибринолитической системы является фермент плазмин (фибринолизин). Он представляет собой очень активный протеолитический фермент, способный растворять фибриновый сгусток. Плазмин синтезируется из неактивного предшественника плазминогена.В переходе плазминогена в плазмин участвуют активаторы двух видов:
стрептокиназы и лизокиназ 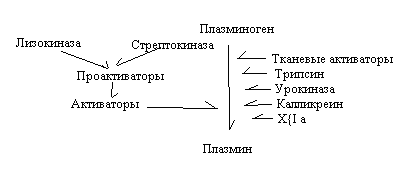 Для фибринолитической системы существует антифибринолитическая система. Детские особенности системы гемостаза К моменту рождения ребёнка в крови имеются все факторы свертывающей и антисвёртывающей систем. Концентрация некоторых из них (I, Y, YIII , ХIII) равна концентрации взрослых. Некоторые факторы (II, YII, IХ, Х) содержатся в меньшей концентрации. Концентрация плазмина составляет 1/3 от уровня взрослых. Нарушения гемостаза. Нарушения свёртывания крови наблюдается при тромбоцитопениях, тромфоцитофилиях, тромбоцитопениях. Могут развиваться тромботические состояния, при которых преобладает активность свёртывающей системы. При геморрагических состояниях преобладает активность противосвёртывающей системы крови. Возможны наследственные гемофилии: гемофилия А (дефект YIII фактора), гемофилия В (дефект IХ фактора), гемофилия С (дефект ХI фактора). Литература Тюкавкина Н.А.: Биоорганическая химия. - М.: Дрофа, 2007 : Растительные флаволигнаны. - М.: [Б.И.], 2006 БелГУ, Медицинский фак. ; авт.-сост. Е.А. Шенцева ; рец.: М.И. Чурносов, В.Г. Сухотерин : Подготовка к экзамену по биологической химии. - Белгород: БелГУ, 2006 Казанский гос. ун-т; Гл. ред. М.Х. Салахов: Ученые записки Казанского государственного университета. - Казань: КГУ, 2006 Казанский гос. ун-т; Гл. ред. М.Х. Салахов: Ученые записки Казанского государственного университета. - Казань: КГУ, 2006 Казанский гос. ун-т; Гл. ред. М.Х. Салахов: Ученые записки Казанского государственного университета. - Казань: КГУ, 2006 Под ред.: Ю.И. Афанасьева, С.Л. Кузнецова, Н.А. Юриной ; Рец.: Д.И. Медведев, Т.К. Дубовая: Гистология, цитология и эмбриология. - М.: Медицина, 2006 Ред.: Д.Д. Бронзино: Tissue Engineering and Artificial Organs. - Boca Raton ; London ; New York: Taylor & Francis, 2006 Т.Л. Алейникова и др.; Под ред. Е.С. Северина, Рец.: Д.М. Никулина, З.И. Микашенович, Л.М. Пустовалова: Биохимия. - М.: ГЭОТАР-МЕД, 2006 Тюкавкина Н.А.: Биоорганическая химия. - М.: Дрофа, 2006 Федеральное агенство по образованию РФ; Биолого-химический фак. БелГУ, Белгородское отделение Русского ботанического общества, Академия нетрадиционных и редких растений; Рец.: В.П. Нецветаев, А.Е. Соловьева, А.А. Шапошников; Отв. за вып.: О.Е. Лебеде: Материалы Международной молодежной научно-практической конференции (14 апреля 2006 г.). - Белгород: ПОЛИТЕРРА, 2006 Федеральное агенство по образованию, БелГУ, Всероссийский научно-исследовательский ин-т семеноводства и селекции овощных культур РАСХН: Нетрадиционные и редкие растения, природные соединения и перспективы их использования . - Белгород: Политерра, 2006 Федеральное агенство по образованию, БелГУ, Всероссийский научно-исследовательский ин-т семеноводства и селекции овощных культур РАСХН: Нетрадиционные и редкие растения, природные соединения и перспективы их использования . - Белгород: Политерра, 2006 федеральное агентство по образованию , медицинский фак. БелГУ ; сост.: Е.А. Шенцева, Л.Р. Закирова ; рец.: Л.Г. Прокопенко, М.И. Чурносов : Лабораторный практикум по биологической химии. - Белгород: БелГУ, 2006 |
