Реферат по курсу Химическая технология
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
| |||||||||||||||||||||||||||||||||||||||||||
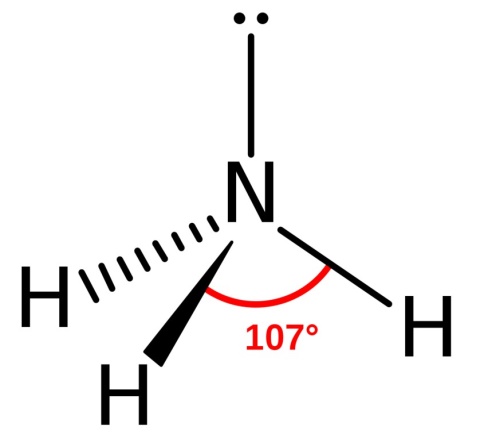 |
| Рис. 1. Молекула аммиака |
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн тонн.
В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717).
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5—1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипячёной воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения.
В ходе работы рассмотрим историю происхождения, химические свойства и различные промышленные методы синтеза.
История
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkalineair). Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака. С того времени в мире начались исследования по получению аммиака из азота и водорода. Аммиак был очень нужен для синтеза соединений азота, поскольку получение их из чилийской селитры ограничивалось постепенным истощением запасов последней. Проблема уменьшения запасов селитры обострилась к концу XIX века. Только в начале XX века удалось изобрести процесс синтеза аммиака, пригодный для промышленности. Это осуществил Ф. Габер, начавший трудиться над этой задачей в 1904 году и к 1909 году создавший небольшой контактный аппарат, в котором использовал повышенное давление (в соответствии с принципом Ле-Шателье) и катализатор из осмия. 2 июля 1909 года Габер устроил испытания аппарата в присутствии К. Боша и А. Митташа, оба — от Баденского анилинового и содового завода (BASF), и получил аммиак. К. Бош к 1911 году создал крупномасштабную версию аппарата для BASF, а затем был построен и 9 сентября 1913 года вступил в строй первый в мире завод по синтезу аммиака, который был расположен в Оппау (ныне район в черте города Людвигсхафен-на-Рейне) и принадлежал BASF. В 1918 году Ф. Габер стал лауреатом Нобелевской премии по химии «за синтез аммиака из составляющих его элементов». В России и СССР первая партия синтетического аммиака была получена в 1928 году на Чернореченском химическом комбинате.
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрёстке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали минерал нашатырь (NH4Cl), который при нагревании испаряет аммиак.
Химические свойства
Благодаря наличию неподелённой электронной пары во многих реакциях аммиак выступает как основание Бренстеда или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
  |
Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
 |
Взаимодействуя с кислотами, даёт соответствующие соли аммония:
 |
Физические свойства
Горючий бесцветный газ. Молекулярная масса 17,03; температура кипения — 33,4 °С; плотность по воздуху 0,597; коэффициент диффузии газа в воздухе 0,198 см2/с; теплота сгорания —316,5 кДж/моль; растворимость в воде 34,2% (масс). Температура самовоспламенения 650 °С.
Синтез аммиака
Обзор промышленных методов производства
Цианамидный метод. Первым промышленным процессом, который использовался для получения аммиака, был цианамидный процесс. При нагревании извести СаО и углерода получали карбид кальция СаС2. Затем карбид нагревали в атмосфере азота и получали цианамид кальция СаСN2; далее аммиак получали гидролизом цианамида:
| СаСN2(тв) + 3Н2О = 2NН3↑ + СаСО3(тв) |
Этот процесс требовал больших затрат энергии и экономически был невыгоден.
Современный процесс получения аммиака основан на способности тонкоизмельченного карбида кальция при температуре около 1000 °С взаимодействовать с азотом по уравнению
| СаС2 + N2 = CaCN2 + С + 302 кДж |
Доля производства связанного азота цианамидным методой весьма незначительна.
Дуговой метод. Дуговой метод состоит в том, что через пламя электрической дуги продувается воздух. При температуре около 3000 °С протекает обратимая реакция
| N2 + О2 =2NО – Q. |
Образующийся оксид азота (II) может быть окислен до оксида азота (IV) и переработан в азотную кислоту и другие соединения. Для получения 1 т связанного азота этим способом расходуется 60 000…70 000 кВт-ч электроэнергии.
Аммиачный метод. На данный момент в промышленности используют лишь один метод получение аммиака – это получение из азото-водородной смеси. Конечно, в зависимости от конкретного производства может изменяться получение основного сырья (водорода), использоваться различие показатели температур и давлений, различные катализаторы, а также разные по размерам и формам колоны для получения аммиака. Далее в работе будут рассмотрены основные химико-технологические особенности.
Описание сырья
Азото-водородная смесь (АВС) - сырье в производстве аммиака стехиометрического состава N2 : H2 = 1 : 3. Так как ресурсы атмосферного азота практически неисчерпаемы, сырьевая база аммиачного производства определяется вторым компонентом смеси – водородом, который может быть получен разделением обратного коксового газа, газификацией твердого топлива, конверсией природного газа.
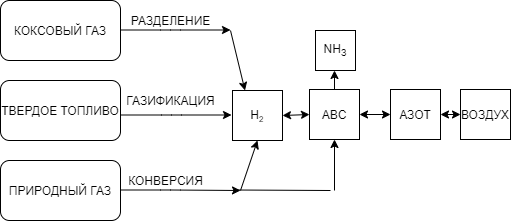 |
| Рис. 2. Сырьевые ресурсы производства аммиака |
Азот получают ректификацией (перегонкой) сжиженного атмосферного воздуха. Водород для синтеза аммиака может быть получен:
разделением обратного коксового газа,
газификацией твердого топлива,
конверсией природного газа (метана или его газообразных гомологов),
конверсией оксида углерода с водяным паром,
крекингом метана,
электролизом либо термическим разложением воды.
Для перспективных планов широкого применения водорода в промышленных и энергетических целях планируется его крупномасштабное производство из воды – самого дешевого сырья, запасы которого неограниченны. Существующие и разрабатываемые методы производства водорода из воды делятся на три группы:
электролиз воды
термохимические методы
комбинированные термо- и электрохимические методы.
Электролиз – наиболее освоенный метод производства водорода из воды, в настоящее время он используется в небольших масштабах при наличии дешевой электроэнергии. Электрохимические процессы основаны на взаимных превращениях электрической энергии в химическую и наоборот. Достоинства электрохимических процессов – их простота в аппаратурном оформлении, малостадийность технологического процесса, высокая чистота получаемых продуктов, надостижимая для химических способов и др. Основной недостаток электролиза – высокий расход электроэнергии, стоимость которой составляет основную долю в себестоимости продуктов – более 90 %. Более того, при промышленном электролизе водных растворов коэффициент использования энергии – не более 50 – 60%, что еще более повышает стоимость продуктов электролиза. При получении водорода электролизом воды применяют в качестве электролита водные растворы кислот, щелочей или солей, так как электропроводность чистой воды ничтожно мала – при 18 °С удельная электропроводность воды составляет (2-6)×10-10 См×м-1. Чаще всего применяют щелочные электролиты, наименее агрессивные для конструкционных материалов электролизеров. Выделение водорода происходит на катоде по реакции:
 |
Суммарный КПД производства водорода электролизом воды с использованием электроэнергии, вырабатываемой атомной станцией, составляет не более 20 – 30 %, и это отрицательно сказывается на себестоимости водорода. Снижение себестоимости электролитического водорода может быть достигнуто совершенствованием конструкции электролизеров, их удешевлением, и, что самое главное, применением дешевой электроэнергии. Как основная перспектива, рассматривается возможность питания водородных электролизеров «провальной» энергией атомных станций, т.е. использованием электроэнергии в те периоды, когда станции недогружены, например, в ночные часы.
Термохимический метод получения водорода основан на разложении воды с помощью тепловой энергии, которую предполагается получать от атомных реакторов с гелиевым охлаждением, используя теплоту газового теплоносителя на выходе из реактора. Непосредственное разложение воды по реакции:
 |
неосуществимо, так как при необходимой для этого высокой температуре (около 1000 °С) константа равновесия реакции ничтожно мала (10-6). Реализация процесса возможна заменой реакции прямого разложения воды термохимическим циклом, состоящим из нескольких стадий, для каждого из которых значения константы равновесия были бы приемлемы для практики. Разработано и предложено множество термохимических циклов для разложения воды при температурах, доступных с точки зрения использования теплоты охлаждающих газов ядерных реакторов. В большинстве из предложенных циклов промежуточные вещества имеют высокое сродство к водороду, либо к кислороду – это галогены, элементы IV группы (сера), металлы II группы (Mg, Ca. Ba) и переходные элементы с переменной степенью окисления (V, Fe). Ниже приведен один из примеров термохимического цикла реакций, ведущих к разложению воды на H2 и O2:
 |
 |
 |
 |
Весь термохимический цикл разложения воды представляет собой замкнутый цикл, так как все исходные реагенты отделяются от продуктов реакции и возвращаются в цикл, за исключением воды, расходуемой на образование водорода и кислорода. Максимальная температура реакций не превышает 700 °С и может быть обеспечена теплоносителем на выходе их атомного реактора на уровне 800 - 900 °С.
В настоящее время ни один из предложенных термохимических циклов еще не реализован в промышленности и значение КПД циклов, а так же расчеты затрат на получение водорода этим методом пока не определены.
Комбинированный метод производства водорода заключается в комбинировании термо- и электрохимических стадий процесса. Ожидаемые преимущества комбинированного метода состоят в том, что могут быть использованы достоинства каждого из рассмотренных способов: электрохимический хорошо освоен, имеет простое аппаратурное оформление, а термохимический более экономичен, но мало освоен и включает стадии, трудные для промышленного осуществления.
Примером может служить сернокислотный комбинированный цикл получения водорода и кислорода из воды. Это двухступенчатый процесс, включающий 2 стадии:
термохимическая – эндотермическая реакция, осуществляемая при 900°С
 |
низкотемпературный электрохимический процесс:
 |
 |
Последняя реакция может быть реализована только путем электролиза, так как ее константа равновесия и теоретическим выход водорода чрезвычайно малы. Источником энергии для комбинированной установки может служить атомный газовый реактор, снабжающий отбросной теплотой термохимическую стадию и электроэнергией электрохимическую стадию. Расчетные затраты для комбинированной установки меньше, чем для прямого электролиза воды. Суммарный КПД процесса должен составить 35 – 37 %. По мнению специалистов комбинирование термохимических и электрохимических стадий – наиболее перспективное направление крупномасштабного производства водорода из воды.
Основным методом получения водорода для синтеза аммиака является каталитическая конверсия метана. Сырьём для этого метода служит природный и попутный газ, содержащий до 90-98% метана.
Термодинамика и кинетика процесса синтеза аммиака
Реакция синтеза аммиака представляет собой обратимую, экзотермическую реакцию, протекающую с уменьшением объёма.
 |
Равновесие этой реакции в соответствии с принципом Ле-Шателье-Брауна может быть смещено вправо:
при снижении температуры;
при повышении давления.
Для получения примерно 97 % превращения азота и водорода в аммиак при 400°С необходимо применять давление выше 350 МПа.
Зависимость равновесного выхода аммиака от температуры и давления приведена на рисунке 3:
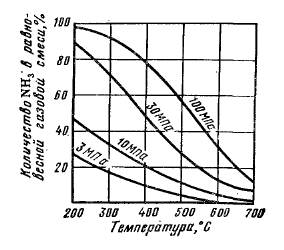 |
| Рис.3. Зависимость равновесного выхода аммиака от температуры для различных давлений. |
При 450°С и 10 МПа в равновесной газовой смеси содержит всего 16 % NH3, а при давлении 30 МПа равновесный выход уже составляет 36 %. Но влияние давления на фактический выход аммиака характеризуется затухающей кривой, поэтому применять очень высокие давления экономически невыгодно.
Выход аммиака повышается с понижением температуры. Однако при этом падает скорость процесса катализа, а следовательно, и общая производительность цеха. Даже при сравнительно высоких температурах активационный энергетический барьер молекул азота слишком велик, и образование аммиака протекает крайне медленно. Для снижения энергии активации процесс синтеза ведут на твердых катализаторах при 400– 500°С.
Реакция протекает с большой скоростью лишь в присутствии катализатора, значительная активность которого проявляется только при температуре не ниже 450-500ºС.
Однако получить значительный выход аммиака можно только при применении высоких давлений.
На основании этого промышленный синтез аммиака осуществляется при температуре 450-500ºС, с использованием катализаторов и высоких давлений.
Остановимся на каждом из этих параметров более подробно:
Температура.
Мы уже с вами говорили о том, что для процесса синтеза аммиака существенное значение имеет оптимальный температурный режим.
Синтез аммиака является экзотермической реакцией. Здесь, как и в случае окисления оксидасеры в присутствии катализатора, имеет место противоречие, возникающее при проведении обратимых экзотермических реакций.
Противоречие состоит в том, что:
повышение температуры при экзотермической реакции приводит к уменьшению выхода продукта;
в то время как снижение температуры влечёт за собой уменьшение скорости реакции.
Решение проблемы заключается в том, что для обеспечения максимальной скорости синтеза процесс следует начинать при максимальной температуре и по мере увеличения степени превращения снижать её в соответствии с режимом оптимальных температур.
Каталитической активностью
По отношению к реакции синтеза аммиака обладают металлы, имеющие незавершённый второй снаружи d- или f- электронный уровень: железо, уран, платина и молибден. Наиболее высокую активность проявляют железо, осьмий, рений и уран. Однако рений, осмий и уран дороги и опасны в работе.
В промышленности в качестве катализатора синтеза аммиака используется железо, содержащее активаторы (промоторы), введённые в катализатор в процессе его изготовления.
В качестве промоторов используют оксиды щелочных и щелочноземельных металлов: Al2O3, K2O, CaO,SiO2. Такой катализатор достаточно активен и стоек к местным перегревам.
Соединения серы отравляют катализатор необратимо, кислород и CO – необратимо, но очень быстро и даже в ничтожно малых концентрациях.
Контактную массу готовят сплавлением смеси оксидов железа(Fe3O4), алюминия, калия, кальция и кремния с последующим измельчением массы до размера зёрен катализатора (5 мм).
Оксид железа восстанавливается до свободного железа водородом в колонне синтеза аммиака.
Гетерогенный каталитический процесс синтеза аммиака на железном катализаторе проходит в три стадии.
Диффузия азота и водорода из газового объема к поверхности зерна катализатора и в его порах;
Активированная адсорбция азота и водорода поверхностью катализатора;
Химическое взаимодействие азота и водорода через промежуточные соединения их с катализатором.
В соответствии с представлениями электронной теории катализа водород передает свои электроны катализатору, а азот воспринимает их от катализатора, восстанавливая электронное равновесие. Перегруппировка поверхностных соединений N×Кат и H×Кат проходит последовательно через низшие соединения азота с водородом: имид NH, амид NH2, и, наконец, аммиак NH3.
4. Десорбция аммиака и диффузия его в газовый объем.
Установлено, что лимитирующей стадией собственно катализа является активированная адсорбция азота.
На первой стадии происходит активированная адсорбция атомами железа молекул водорода (диссоциирующих на атомы) и азота(у молекул азота разрывается одна из связей) на поверхности катализатора.
На второй стадии идёт последовательное гидрирование молекулы азота по схеме:
 |
Давление.
Определяющим параметром в производстве аммиак является давление синтеза.
В зависимости от применяемого давления все системы производства аммиака делятся на:
системы низкого давления (10 – 15 МПа);
системы среднего давления (25 –60 МПа) – наиболее часто применяется;
системы высокого давления (60–100 МПа).
Однако даже при использовании систем высокого давления не удаётся добиться полного превращения АВС в аммиак.
В связи с этим при производстве аммиака из АВС применяют принцип циркуляции.
Принцип циркуляции заключается в следующем:
Аммиак, образовавшийся после прохождения АВС через контактные массы, конденсируется при охлаждении газовой смеси и отделяется от неё.
Непрореагировавшая АВС с остатком аммиака (циркуляционный газ) смешивается со свежей порцией АВС и снова подаётся на катализатор и т. д.
Циркуляция продолжается до полного превращения исходных веществ.
Таким образом, скорость реакции и, следовательно, производительность цеха синтеза аммиака в сильной степени зависит от объемной скорости, температуры процесса и давления в системе.
Схемы производства аммиака
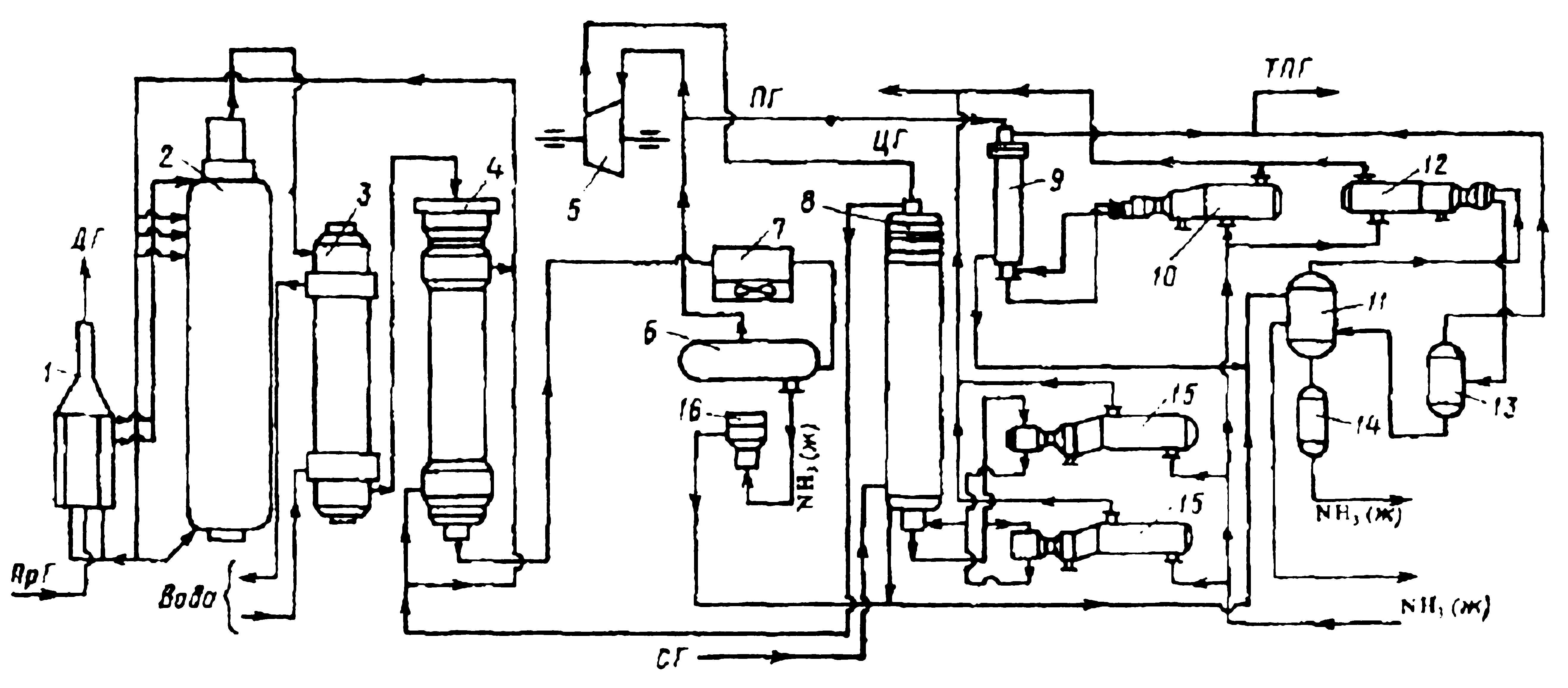 |
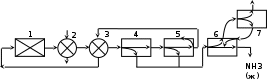
| Рис 4. Технологическая схема процесса |
| 1 - Подогреватель газа. 2 - Колонна синтеза аммиака. 3 - Подогреватель воды. 4 - Выносной теплообменник. 5 – Циркуляционное колесо компрессора. 6 – Сепаратор жидкого аммиака. 7 – Блок аппарата воздушного охлаждения. 8 – Конденсационная колонна. 9 - Конденсационная колонна продувочных газов. 10 – испаритель жидкого аммиака на линии продувочных газов. 11 – Сборник жидкого аммиака. 12 – Испаритель жидкого аммиака на линии танковых газов. 13 – Сепаратор. 14 – Промежуточная дренажая ёмкость. 15 – Испарители житкого аммиака.16 – Магнитный фильтр. |
 |
| Рис. 5. Операторная схема |
| Колонна синтеза Теплообменник Теплообменник Сепаратор Конденсационная колонна Сборник жидкого NH3 Сепаратор |
Колонна синтеза аммиака под средним давлением выглядит следующим образом и имеет следующие характеристики. Это стальной цилиндр с толщиной стенки 0,2 м, внутреннем диаметром – 1-2 м, высотой – 12-20 м.
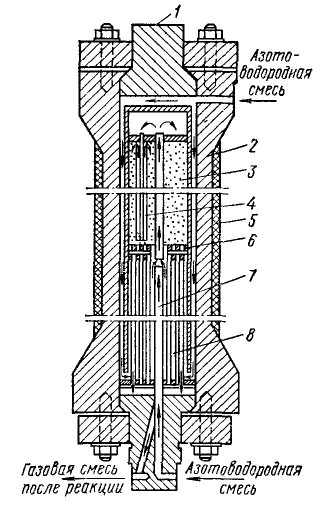 |
| Рис. 6. Колонна синтеза аммиака под средним давлением |
| 1- крышки; 2 - корпус колонны; 3 - катализаторная коробка; 4 - теплообменные трубы; 5 - тепловая изоляция; 6 - колосниковая решетка; 7 - центральная труба; 8 - теплообменник |
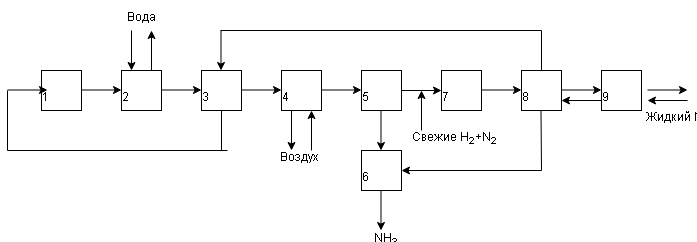 |
| Рис. 7. Функциональная схема синтеза аммиака |
| 1 – колонна (реактор) синтеза NH3; 2 – водяной холодильник; 3 теплообменник; 4 – воздушный холодильник; 5 – сепаратор; 6 – сборник аммиака, 7 – циркуляционный компрессор; 8 – конденсационная колонна; 9- испаритель |
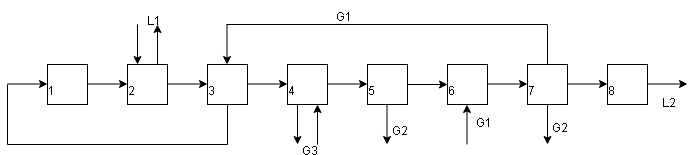 | |
| Рис. 8. Структурная схема синтеза аммиака | |
| 1 – колонна (реактор) синтеза NH3; 2 – водяной холодильник; 3 теплообменник; 4 – воздушный холодильник; 5 – сепаратор; 6 – циркуляционный компрессор; 7 – конденсационная колонна; 8- испаритель. | |
| L1-вода L2-жидкий аммиак | G1-смесь ABC G2-аммиак G3-воздух |
Заключение
Современное производство синтетического аммиака состоит из ряда последовательных технологических стадий сосредоточенных в отдельных блоках сероочистки природного газа конверсии метана конверсии СО, очистки синтез-газа от СО2, метанирования компрессии синтеза аммиака объединенных по технологическому принципу и, кроме того, по энергетическому – единой системой парового цикла.
Характерной особенностью блока отделения синтеза аммиака является то, что здесь образуется и выделяется жидкий аммиак – товарный продукт. От остальных стадий производства синтез аммиака отличается применением высокого давления наличием циркуляционного газового контура использованием холода. На этой стадии выделяется и утилизируется наибольшее количество реакционного тепла.
Блок синтеза характеризуется применением сложной и разнообразной реакционной и теплообменной аппаратуры, для изготовления которой используются высококачественные стали. По капитальным затратам он один из самых весомых в аммиачном производстве.
Выбор технологических схем аппаратурного оформления и экономические показатели производства аммиака во многом определяются свойствами катализаторов синтеза его активностью стабильностью механической прочностью в связи, с чем к качеству катализатора предъявляют самые высокие требования.
Современное производство аммиака основано на ресурсо- и энергосберегающих технологиях и реализовано в многотоннажных безотходных предприятиях. Проблема российских производств заключается в том, что значительная часть действующих мощностей технически устарела и в условиях быстрого роста цен на сырье и энергоносители выпускаемый на них аммиак может иметь значительно большую себестоимость, чем производимый на современном оборудовании.
Список литературы
Атрощенко В. И., Каргин С. И. Технология азотной кислоты М. — Л. 1970. -494 с.
Ганз С.Н.. Теоретические основы и технология синтеза аммиака / Под общ. ред. проф. А.М.Николаева – К. Вища школа 1969. – 260 с.
Общая химическая технология. / Под редакцией проф. Амелина А. Г. – М. Химия 1977. – 400 с.
Семенов В.П. Производство аммиака / Под ред. В. П. Семенова. – М. Химия 1985. – 368 с.
Справочник азотчика. Физико-химические свойства газов и жидкостей. Производство технологических газов. Очистка технологических газов. Синтез аммиака. – 2-е изд. перераб. М. Химия 1986. – 512 с.
Технология аммиака. Учебное пособие / Янковский Н. А., Демиденко И.М., Мельников Б.И., Лобойко А.Я., Корона Г.М. – Днепропетровск УГХТУ 2004. – 300 с.
Технология связанного азота. Синтетический аммиак. / Бласяк Е., Лайдлер К., Павликовский С. –М. Госхимиздат 1961. – 623 c.
Янковский Н. А. и др.. Аммиак. Вопросы технологии / Под общ. ред. Н.А. Янковского – Донецк ГИК “Новая печать” ООО “Лебедь”. 2001. — 497 c.
Тарчигина Н.Ф. Технология связанного азота.
Ахметова Т.Г. Химическая технология неорганических веществ.
Беренгартен М.Г. Общая химическая технология
