Решение. Cl
 Скачать 38.05 Kb. Скачать 38.05 Kb.
|
|
2. Строение атома Задание I. Составить электронные формулы элементов, графические схемы заполнения электронами валентных орбиталей в спокойном и возбужденном состояниях, указать, к какому типу эти элементы относятся. 11. Cl, Cu, Bi. Решение. Cl 1. Порядковый номер хлора – 17, следовательно атом хлора имеет 17 электронов. Хлор находится в 3 периоде периодической системы, следовательно, АО с n, равным 1; 2 заполнены полностью. Хлор относится к p-элементам, следовательно, заполнен 3s-подуровень. В ряду 3p-элементов хлор – пятый элемент, следовательно, на 3p-подуровне – пять электронов. Таким образом, электронная формула хлора имеет вид 1s 22s 22p 63s 23p5. 2. Валентными орбиталями в этом атоме являются орбитали внешнего (третего) электронного слоя, т.е. 3s-, 3p- и незаполненные 3d-орбитали. Графически схема заполнения электронами этих орбиталей имеет вид 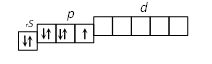  в таком состоянии хлор имеет валентность 1, которой соответствуют степени окисления 1 и +1. 3. При затрате некоторой энергии спаренный p-электрон перейдет на свободную d-орбиталь. В этом первом возбужденном состоянии 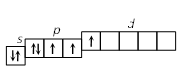  хлор имеет валентность 3, которой соответствует степень окисления +3. 4. При передаче атому хлора еще некоторого количества энергии следующий p-электрон также перейдет на свободную d-орбиталь. Во втором возбужденном состоянии 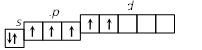  хлор имеет валентность 5, которой соответствует степень окисления +5. 5. При передаче атому хлора еще некоторого количества энергии s-электрон также перейдет на свободную d-орбиталь. В третьем возбужденном состоянии 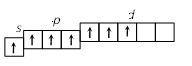 хлор имеет валентность 7, которой соответствует степень окисления +7. Cu. 1. Порядковый номер меди – 29, следовательно атом меди имеет 29 электронов. Медь находится в 4 периоде периодической системы, следовательно, АО с n, равным 1; 2 3 заполнены полностью. Медь относится к d-элементам. В ряду 3d-элементов медь – девятый элемент, следовательно, на 3d-подуровне – девять электронов. Таким образом, электронная формула меди имеет вид 1s 22s 22p 63s 23p64s 13d10. 2. Валентными орбиталями в этом атоме являются орбитали внешнего (третего) электронного слоя, т.е. 3s-, 3p- и незаполненные 3d-орбитали. Графически схема заполнения электронами этих орбиталей имеет вид. у меди происходит переход одного электрона с s-оболочки на d-оболочку, причина которого -более выгодная по энергии полностью заполненная d-оболочка. 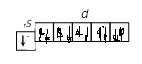 Cu + 1s 22s 22p 63s 23p64s 03d10 (уходит электрон, сначала внешний 4s1 ) Cu 2+ 1s 22s 22p 63s 23p64s 03d9 Bi 1. Порядковый номер висмута – 83, следовательно атом висмута имеет 83 электронов. Висмут находится в 6 периоде периодической системы, следовательно, АО с n, равным 1- 5 заполнены полностью. Висмут относится к p-элементам, следовательно, заполнен 6s-подуровень. В ряду 6p-элементов висмут – третий элемент, следовательно, на 6p-подуровне – три электрона. Таким образом, электронная формула висмута имеет вид 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3. 2. Валентными орбиталями в этом атоме являются орбитали внешнего (шестого) электронного слоя, т.е. 6s-, 6p Графически схема заполнения электронами этих орбиталей имеет вид 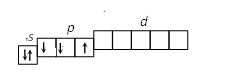 в таком состоянии висмут имеет валентность 3, которой соответствуют степени окисления +3. При передаче атому висмута некоторого количества энергии s-электрон перейдет на свободную d-орбиталь. В возбужденном состоянии 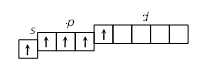 висмут имеет валентность 5, которой соответствует степень окисления +5. |
