Химия. Дз по химии. Решение Медное изделие покрыто серебром. Е 0 (Сu 2 Cu) 0,34 b е 0 (Ag Ag) 0,799 B
 Скачать 36.9 Kb. Скачать 36.9 Kb.
|
|
Работа № 6 1. Какие процессы протекают при электрохимической коррозии посеребренного медного изделия работающего в сильно разбавленном растворе кислоты (рН7) при нарушении покрытия? Написать электродные процессы и возможные вторичные реакции. Решение: Медное изделие покрыто серебром. Е0 (Сu2+/Cu) =+0,34 B Е0 (Ag+/Ag) =+0,799 B Е0 (Ag+/Ag)> Е0 (Сu2+/Cu), поэтому в случае нарушения покрытия коррозии будет подвергаться медь. В образующейся гальванической паре Ag0-Cu0 анодом будет Cu, а Ag – катодом. В кислой среде коррозия протекает с водородной деполяризацией. Процессы, протекающие на электродах: А: Cu0 – 2 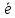 →Cu2+ 1 процесс окисления →Cu2+ 1 процесс окисленияK: 2H+ + 2 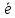 → H2 1 процесс восстановления → H2 1 процесс восстановленияТокообразующая реакция: Cu + 2H+ →Cu2+ + H2↑ Продукты коррозии будут зависеть от состава анионов, имеющихся в растворе. Образуются соли меди, которые гидролизуются по катиону с образованием Cu(OH)2. При действии сильных окислителей, имеющихся в коррозионной среде (например, О2, H2SO4), в качестве побочных продуктов коррозии могут образовываться оксиды меди CuO и Сu2O. Покрытие из серебра является катодным покрытием. 2. Какие возможны коррозионные процессы изделия из титана при наличии на нем тонкой пленки воды и неравномерной аэрации? Написать электродные процессы и возможные вторичные реакции. Решение: Коррозия при неравномерной аэрации наблюдается в тех случаях, когда конструкция из металла находится в растворе, но доступ растворенного кислорода к различным ее участкам неодинаков. При этом те части металла, доступ кислорода к которым минимален, корродируют значительно сильнее тех частей, доступ кислорода к которым больше. Это объясняется тем, что участки, к которым открыт доступ кислорода, будут являться катодом, и на них будет восстанавливаться кислород. Другие же участки будут являться анодом, и на них будет происходить разрушение металла. А: Тi –2 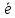 →Ti2+ 2 процесс окисления →Ti2+ 2 процесс окисленияК: 2H2O + O2 + 4e →4OH- 1 процесс восстановления Суммарное уравнение процесса коррозии: 2Ti + 2H2O + O2 →2Тi(OH)2 Таким образом, при неравномерной аэрации локализация процесса окисления приводит к местной коррозии – интенсивному разрушению металла на отдельных участках. Побочные продукты, образующиеся при коррозии титана, – TiO и TiO2– покрывают поверхность металла защитной пленкой, препятствующей дальнейшей коррозии. 3. Предложить схему концентрационного гальванического элемента, состоящего из хромовых электродов, опущенных в растворы сульфата хрома [Cr2(SO4)3]. Вычислить ЭДС, если концентрации ионов хрома равны 1,0 и 0.001 моль/л. Написать электродные процессы. Решение: Гальванический элемент, в котором два одинаковых металлических электрода погружены в растворы соли данного металла с разной концентрацией, называется концентрационным гальваническим элементом. Значение стандартного электродного потенциала ионов хрома: Е0 (Cr3+/Cr) =–0,744 B Равновесный электродный потенциал электрода с концентрацией ионов 1,0 моль/л равен стандартному электродному потенциалу. Е (Cr3+/Cr, 1 моль/л) = Е0 (Cr3+/Cr) =–0,744 B Равновесный электродный потенциал второго электрода рассчитаем по уравнению Нернста: Е (Сr3+/Cr,0,001моль/л) = Е0 +  lg 0,001 = –0,744+ 0,0107 lg 0,001=–0,803(В) lg 0,001 = –0,744+ 0,0107 lg 0,001=–0,803(В)Е (Cr3+/Cr,1моль/л) > Е (Cr3+/Cr,0,001моль/л), следовательно, электрод в первом растворе будет катодом, а во втором– анодом. Составим схему гальванического элемента: Cr│Cr3+ (0,001 моль/л) ║ Cr3+ (1моль/л)│Cr При работе данного гальванического элемента протекают процессы: (–)А: Cr0 – 3 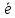 → Cr3+ процесс окисления → Cr3+ процесс окисления(+)K: Cr3 + +3 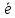 → Cr0 процесс восстановления → Cr0 процесс восстановленияРассчитаем ЭДС гальванического элемента: ЭДС = Е (Сr3+/Cr, 1моль/л)– Е (Cr3+/Cr, 0,001 моль/л)= – 0,744 –(– 0,803) =0,059 (В) Ответ: ЭДС = 0,059 В 4. Составить химический гальванический элемент, в котором никель является катодом. Вычислить ЭДС в стандартных условиях и при уменьшении концентрации ионов Ni+2 у катода до 0,01 моль/л. Написать электродные процессы. Решение: Для того, чтобы в гальваническом элементе никель являлся катодом, нужно в качестве второго электрода взять металл с более низким значением стандартного электродного потенциала, допустим, кадмий. Е0 (Cd2+/Cd) = –0,40B E0 (Ni2+/Ni) = –0,25 B Схема гальванического элемента: A(–) Сd│ Cd2+ ║ Ni2+│Ni (+)K При работе данного гальванического элемента протекают процессы: (–)А: Cd0 – 2 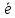 →Cd2+ 1 процесс окисления →Cd2+ 1 процесс окисления(+)K: Ni 2+ +2 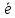 →Ni0 1 процесс восстановления →Ni0 1 процесс восстановленияРассчитаем ЭДС гальванического элемента при стандартных условиях: ЭДС = Е0 катода – Е0 анода = –0,25 – (-0,40) =0,15 (В) Рассчитаем равновесный электродный потенциал никеля при концентрации Ni2+ = 0,01 моль/л по уравнению Нернста. E (Ni2+/Ni) = E0 +  lg C(Ni2+) = –0,25+ 0,0295 lg0,01 =–0,309(В) lg C(Ni2+) = –0,25+ 0,0295 lg0,01 =–0,309(В)ЭДС = Е катода – Е0 анода = –0,309 – (-0,40) =0,091 (В) При уменьшении концентрации ионов Ni2+ ЭДС гальванического элемента уменьшается. 5. При электролизе водного раствора хлорида кальция [CaCl2] на неактивном аноде выделилось 0.224л газа. Какое это вещество? Какой продукт, и в каком количестве (в мл) выделился на катоде? Написать электродные процессы. Какое количество электричества (в числах Фарадея) было пропущено через электролизер? Решение: Электролиз раствора СaCl2 СaCl2→ Ca2+ + 2Cl- При электролизе растворов солей, содержащих ионы металла, расположеннoго в ряду напряжений левее Аl, на катоде восстанавливается вода и выделяется водород. На аноде будут окисляться хлорид-ионы.  A: 2Cl- –2 A: 2Cl- –2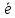 →Cl2 1 процесс окисления →Cl2 1 процесс окисленияK: 2Н2О + 2 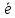 → Н2 +2ОН- 1 процесс восстановления → Н2 +2ОН- 1 процесс восстановленияСуммарное уравнение электролиза: СаCl2 + 2Н2О→Са(ОН)2 + Cl2↑ +Н2↑ На аноде выделяется Cl2. На катоде выделяется Н2 в эквивалентном количестве. VЭ(Cl2) = VЭ(Н2) = 11,2 л/моль, следовательно, V(Н2) = V(Cl2) = 0,224 л = 224 мл. Количество электричества, пропущенного через электролизер, рассчитаем по закону Фарадея. q = V ∙ F / VЭ , или в числах Фарадея : q = V / VЭ =0,224/11,2 = 0,02 F Ответ: V(Н2) =224 мл; q =0,02 F 6. Предложить электрохимический процесс получения металлического натрия из NaОН. Сколько времени потребуется пропускать постоянный электрический ток силой 10 А для получения 23 г металла? Написать электродные процессы. Решение: Металлический натрий можно получить электролизом расплава NaOH. NaOH →Na+ + OH- К: Na+ + 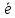 → Na 4 процесс восстановления → Na 4 процесс восстановленияА: 4OH- – 4 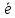 → O2 + 2H2O 1 процесс окисления → O2 + 2H2O 1 процесс окисленияСуммарное уравнение электролиза: 4NaOH → 4Na + O2↑ + 2H2O По закону Фарадея вычислим время, необходимое для электролиза. t =  m = 23 г n = 1 F = 96500 Кл/моль М(Na) = 23 г/моль I = 10 A t =  = 9650 c =2 час 41 мин. = 9650 c =2 час 41 мин.Ответ: t =2 час. 41 мин. |
