В РЕКОМЕНДАЦИИ МИНЗДРАВА ПО COVID. Решение на временное обращение партии препарата. До тех пор, пока molnupiravir не зарегистрирован, он может быть назначен по решению врачебной комиссии
 Скачать 56.89 Kb. Скачать 56.89 Kb.
|
|
В РЕКОМЕНДАЦИИ МИНЗДРАВА ПО COVID-19 ДОБАВЛЕНЫ МИР-19 И НОВЫЕ ПЕРОРАЛЬНЫЕ ПРЕПАРАТЫ 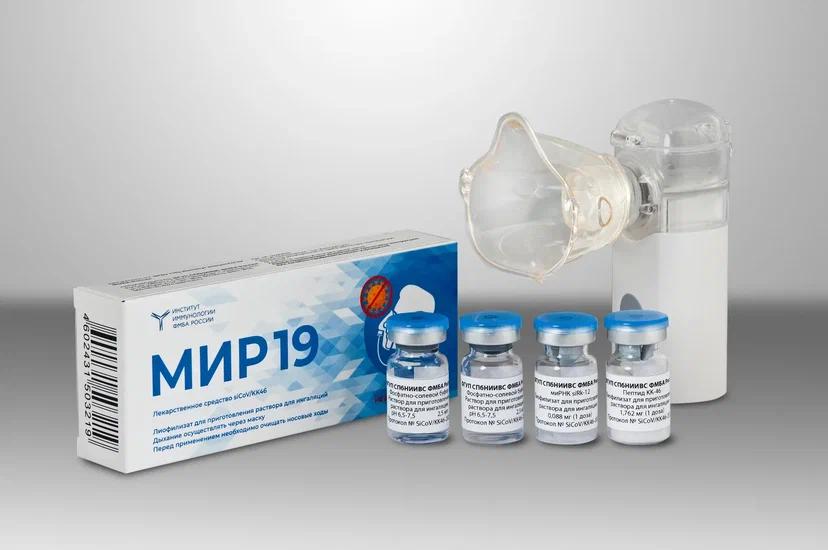 Фото: fmba.gov.ru Фото: fmba.gov.ruМинздрав обновил временные рекомендации по профилактике, диагностике и лечению новой коронавирусной инфекции. В 14-ю версию добавлены препарат МИР-19 от ФМБА России и вакцина для подростков Спутник М. Также в рекомендациях появилась информация о пока не зарегистрированных в России molnupiravir от MSD и Ridgeback Biotherapeutics и nirmatrelvir c ритонавиром (Paxlovid) от Pfizer. МИР-19 (синтетическая малая интерферирующая рибонуклеиновая кислота (миРНК) [двуцепочечная]) добавлен в стационарные схемы лечения COVID-19 у пациентов от 18 до 65 лет с легким и среднетяжелым течением заболевания. Препарат предлагается как альтернатива фавипиравиру, ремдесивиру или иммуноглобулину человека против COVID-19. Его применяют ингаляционно в течение 14 дней. МИР-19 зарегистрирован в России 22 декабря 2021 года. Препарат разработан Институтом иммунологии ФМБА и производится на другом предприятии агентства – Санкт-Петербургском НИИ вакцин и сывороток. В рекомендации добавлена информация о зарегистрированной в ноябре вакцине Гам-Ковид-Вак М (Спутник М), предназначенной для профилактики заболевания у подростков 12–17 лет. В 14-й версии документа впервые появилась информация об испытываемых в России пероральных противовирусных препаратах против COVID-19 – molnupiravir от MSD и Ridgeback Biotherapeutics (Lagevrio в Европе) и nirmatrelvir c ритонавиром (Paxlovid) от Pfizer. Molnupiravir перечислен среди средств этиотропного лечения COVID-19 наряду с фавипиравиром, ремдесивиром и МИР-19. Исследование препарата на 1 433 пациентах выявило снижение риска госпитализации или смерти по сравнению с группой плацебо, говорится в рекомендациях. По данным MSD, этот риск снизился на 30%. С октября 2020 года molnupiravir испытывается в России. MSD обсуждает локализацию его производства в стране с группой «Р-Фарм» Алексея Репика. «Р-Фарм» получил в декабре разрешение на временное обращение партии препарата. До тех пор, пока molnupiravir не зарегистрирован, он может быть назначен по решению врачебной комиссии. Paxlovid может применяться у пациентов от 12 лет с массой тела не менее 40 кг. В ходе испытаний на 1 219 пациентах препарат снизил риск госпитализации и смерти в группе принимающих Paxlovid на 89% в течение первых трех дней после появления симптомов по сравнению с плацебо. Molnupiravir и nirmatrelvir+ритонавир одобрены FDA. Molnupiravir одобрен в Европе и Великобритании. Paxlovid условно одобрен в Европе: Европейское медицинское агентство рекомендовало в особых ситуациях применять препарат взрослым пациентам с высоким риском развития тяжелого заболевания. В обновленную версию документа добавлена также возможность применения фавипиравира в форме лиофилизата или концентрата, а не только в таблетках. Пока препарат для парентерального применения выпускает только «Промомед». В новых формах фавипиравир рекомендовано использовать в стационарных условиях у пациентов с легким и среднетяжелым течением COVID-19. Источник:Минздрав России Подробнее: https://vademec.ru/news/2021/12/28/v-rekomendatsii-minzdrava-po-covid-19-dobavleny-mir-19-i-novye-peroralnye-preparaty-/ |
