Химия ПР1 КУПЛЕН. Решение Реакция разложения оксида ртути (II) описывается уравнением
 Скачать 368.96 Kb. Скачать 368.96 Kb.
|
|
М  ИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИфедеральное государственное бюджетное образовательное учреждение высшего образования «Тольяттинский государственный университет» (наименование института полностью) Кафедра (наименование кафедры полностью) (код и наименование направления подготовки, специальности) (направленность (профиль) / специализация) Практическое задание по учебному курсу «Химия» (наименование учебного курса) Вариант 9
Тольятти 2022 Задача 1 Рассчитать массу оксида ртути (II), если при разложении этого вещества выделилось 1,8 л кислорода при температуре 350º С и давлении 745 мм рт. ст. Решение: Реакция разложения оксида ртути (II) описывается уравнением: 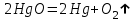 Из уравнения Менделеева-Клапейрона:  Где Р – давление в кПа, V – объем в л, n –количество вещества в моль, R- универсальная газовая постоянная, Дж/Моль·К, Т – температура в К Находим количество вещества кислорода: 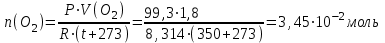 При разложении 2 моль оксида ртути (II) образуется 1 моль кислорода, т.е. n(HgO) = 2n(O2) = 2·3,45·10-2 = 6,9·10-2 моль Находим массу оксида ртути (II): 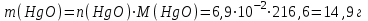  Задача 2 Сколько металла, молярная масса эквивалента которого 12,16 г/моль, прореагирует с 370 мл кислорода (Р = 700 мм рт. ст., t = 100º С)? Решение: Уравнение Менделеева-Клапейрона:  Где Р – давление в кПа, V – объем в л, n –количество вещества в моль, R- универсальная газовая постоянная, Дж/Моль·К, Т – температура в К Находим количество вещества кислорода: 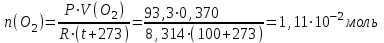 Находим массу кислорода: 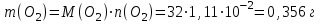 Из закона эквивалентов:  выражаем массу металла: 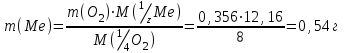  Задача 3 По порядковому номеру элемента составить электронную формулу его атома. Определить природу элемента и валентные электроны. Указать квантовые числа для трех последних электронов. Охарактеризовать местоположение в периодической таблице Д. И. Менделеева. Сравнить электроотрицательности, атомные радиусы и энергии ионизации между элементом и соседними элементами в группе и периоде. Определить состав атома (количество электронов, протонов и нейтронов). Элементы №№ 85, 41 Решение: № 85 – астат At. Он расположен в 6 периоде, в VII группе, главной подгруппе периодической таблицы Д. И. Менделеева. Электронная формула атома астата:  Астат относится к типичным неметаллам. Валентные электроны  . .Квантовые числа для трех последних электронов атома астата
Электроотрицательность астата больше электроотрицательности полония. Астат имеет минимальную электроотрицательность в своей подгруппе. Астат имеет максимальный атомный радиус в своей подгруппе. Астат имеет минимальную энергию ионизации в своей подгруппе. В атоме астата 85 протонов, 85 электронов и 125 нейтронов (для наиболее стабильного изотопа 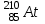 ). ).Элемент с порядковым номером 41 – ниобий Nb. Ниобий расположен в 5 периоде, в V группе, побочной подгруппе периодической таблицы Д. И. Менделеева. Электронная формула атома ниобия: 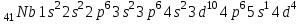 Ниобий относится к амфотерным элементам. Квантовые числа для трех последних электронов атома ниобия
Электроотрицательность ниобия больше электроотрицательности циркония и тантала, но меньше электроотрицательности молибдена и ванадия. Атомный радиус ниобия меньше атомного радиуса циркония и тантала, но больше атомного радиуса молибдена и ванадия. Атомный радиус ниобия меньше атомного радиуса полония, но больше атомного радиуса радона. Энергия ионизации ниобия больше энергии ионизации циркония тантала, но меньше энергии ионизации молибдена и ванадия. Энергия ионизации ниобия больше энергии ионизации полония. В атоме ниобия 41 протон, 41 электрон и 51 нейтрон (для изотопа 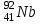 ). ).Задача 4 При окислении 10 г алюминия выделится 309,6 кДж теплоты. Вычислить энтальпию образования оксида алюминия. Решение: 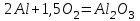 1 моль оксида алюминия образуется при окислении 2 моль алюминия. Молярная масса алюминия равна 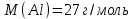 Находим тепловой эффект реакции 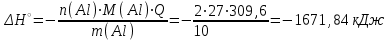 Согласно следствию из закона Гесса тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ, с учетом коэффициентов перед формулами веществ уравнении реакции. Находим энтальпию образования оксида алюминия:  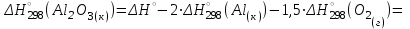 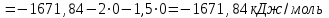 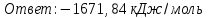 Задача 5 Рассчитать изменение стандартной свободной энергии Гиббса и сделать вывод о направлении процесса при указанной температуре. Рассчитать температуру равной вероятности прямого и обратного процессов. Сделать вывод о направлении процесса выше и ниже этой температуры. СН4(г) + Н2О(г) ↔ СО(г) + Н2(г); 850º С Решение: 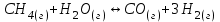 Изменение энтальпии реакции:   Изменение энтропии реакции:   Связь между абсолютной температурой и температурой по шкале Цельсия   Находим изменение энергии Гиббса при 25 ºС: 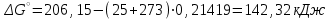 Находим изменение энергии Гиббса при 850 ºС 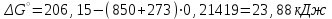 Делаем вывод, что при и 25 ºС и при 850 ºС реакция протекает в обратном направлении (влево). Энтальпийный фактор не благоприятствует протеканию реакции в прямом направлении, энтропийный – благоприятствует протеканию реакции в прямом направлении. Находим температуру начала реакции 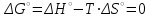 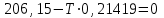 Отсюда,  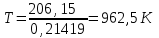 Ниже данной температуры процесс идет в обратную сторону (влево), при данной температуре (и выше) процесс идет вправо.  Задача 6 В газофазной реакции N2 + Н2 ↔ NН3 начальные концентрации азота и водорода составляли 6 и 11,2 моль/л, соответственно. Рассчитать константу равновесия реакции, если к моменту равновесия прореагировало 40 % исходного количества азота. Решение: 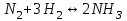 Согласно уравнению реакции при вступлении в реакцию 1 моль азота и 3 моль водорода образуется 2 моль аммиака. Находим равновесные концентрации веществ в смеси:  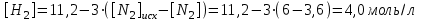 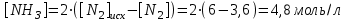 Находим константу равновесия:  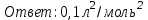 Задача 7 Для нейтрализации некоторого количества НСl оказалось достаточным прибавить 25 мл 4,5%-го раствора NаОН (плотность 1,05 г/мл). Определить, сколько граммов АgСl получится из такого же количества кислоты при добавлении АgNО3. Решение:   Согласно уравнениям реакций 1 моль хлороводородной кислоты реагирует с 1 моль гидроксида натрия. В то же время при реакции 1 моль хлороводородной кислоты с нитратом серебра образуется 1 моль хлорида серебра. То есть  Массовая доля растворенного вещества равна отношению массы растворенного вещества к массе раствора.  Масса раствора равна произведению объема раствора на плотность раствора  Находим массу гидроксида натрия 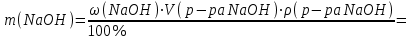  Количество вещества равно отношению массы вещества к молярной массе вещества. 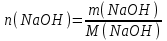 Находим массу хлорида серебра 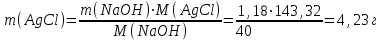  Задача 8 Рассчитать температуру кристаллизации 0,018 н. раствора карбоната натрия, приняв плотность раствора равной единице и кажущаяся степень диссоциации соли 80 %. Решение: Записываем уравнение диссоциации карбоната натрия   По II закону Рауля с учетом коэффициента Вант-Гоффа понижение температуры кристаллизации водного раствора электролита по сравнению с температурой кристаллизации чистого растворителя выражается уравнением 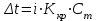 где:  коэффициент Вант-Гоффа (изотонический коэффициент); коэффициент Вант-Гоффа (изотонический коэффициент); криоскопическая константа растворителя, для воды криоскопическая константа растворителя, для воды 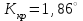 ; ; моляльная концентрация растворенного электролита, моль/кг. моляльная концентрация растворенного электролита, моль/кг.Изотонический коэффициент связан со степенью диссоциации электролита в растворе  где:  степень диссоциации электролита; степень диссоциации электролита; число ионов, на которые диссоциирует 1 молекула (формульная единица) электролита. число ионов, на которые диссоциирует 1 молекула (формульная единица) электролита.Находим изотонический коэффициент  Переводим молярную концентрацию эквивалентов карбоната натрия в моляльную концентрацию.   Находим понижение температуры кристаллизации данного раствора 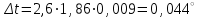 Чистая вода кристаллизуется при 0 ºС. Находим температуру кристаллизации данного раствора   Задача 9 Составить уравнение окислительно-восстановительной реакции с использованием метода электронного баланса; рассчитать массу восстановителя, необходимую для взаимодействия с окислителем, объемом V и концентрацией С.
Решение:  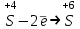 3 окисление 3 окисление  восстановитель восстановитель 1 окисление 1 окисление  окислитель окислитель Молярная концентрация равна:  Отсюда, количество вещества дихромата калия равно:  Согласно уравнению реакции 3 моль восстановителя (сульфита натрия) взаимодействуют с 1 моль окислителя (дихромата калия). Количество вещества равно отношению массы вещества к молярной массе вещества 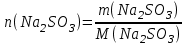 Находим необходимую массу сульфита натрия. 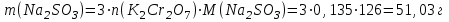  Задача 10 Рассчитать потенциал водородного электрода, погруженного в 0,002 М раствор уксусной кислоты. Решение: Потенциал водородного электрода равен: 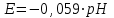 Находим рН данного раствора уксусной кислоты:  Находим потенциал водородного электрода   Задача 11 Рассчитать силу тока при электролизе раствора хлорида цинка, если за 7 часов получено 30 г цинка. Выход по току составляет 82 %. Написать уравнения электродных процессов. Решение: На аноде окисляется простой анион, на катоде восстанавливаются ионы цинка и вода (т.к. цинк в ряду напряжений стоит после алюминия и до водорода). На электродах:  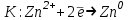 H2O + 2e- = H2 + 2OH- Согласно закону Фарадея масса цинка равна:  где:  молярная масса эквивалентов цинка, г/моль; молярная масса эквивалентов цинка, г/моль; сила тока, А; сила тока, А; время, с; время, с; выход по току, %; выход по току, %;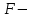 постоянная Фарадея, постоянная Фарадея, 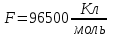 . .Молярная масса эквивалентов цинка равна 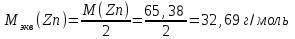 Выражаем время в с 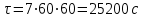 Находим силу тока   Задача 12 Объяснить, как протекает коррозия стальных трубопроводов при использовании цинковых протекторов во влажном грунте? Написать уравнения электродных реакций и суммарное уравнение коррозионного процесса. Решение: Стандартные электродные потенциалы железа и цинка имеют следующие значения   Поскольку 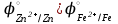 , образуется гальваническая пара, в которой цинк (более активный металл) является анодом, стальной трубопровод – катодом. , образуется гальваническая пара, в которой цинк (более активный металл) является анодом, стальной трубопровод – катодом.Цинк окисляется, по внешнему проводнику электроны поступают на катодную часть, где на катоде (железо) восстанавливаются молекулы воды. Записываем уравнения электродных реакций   Суммарное уравнение коррозионного процесса  |
