химия. Решение. Согласно положению в Периодической системе атом самария имеет следующую электронную формулу
 Скачать 7.89 Mb. Скачать 7.89 Mb.
|
|
20. Составьте электронные формулы атома А и электронно-графические схемы атома Б (в возбужденном состоянии) и иона В (табл. 2). Укажите их ковалентность. Определите набор квантовых чисел последнего электрона элемента А.  Решение. Согласно положению в Периодической системе атом самария имеет следующую электронную формулу: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f6. Электронно-графическая схема наружного (внешнего) уровня имеет вид: 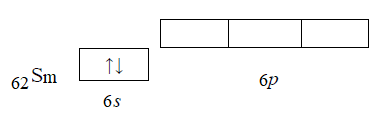 Ковалентность (число неспаренных электронов) равна 0. Набор квантовых чисел для последнего электрона 6s2:
Согласно положению в Периодической системе атом серы имеет следующую электронную формулу: 1s2 2s2 2p6 3s2 3p4.  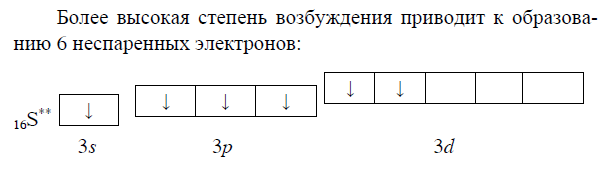 Ковалентность в этом случае будет 6. Согласно положению в Периодической системе атом натрия имеет следующую электронную формулу: 1s2 2s2 2p6 3s1 Образование иона: Na - 1e– → Na+, приводит к изменению электронно-графической схемы: 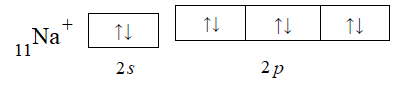 Ковалентность становится равной 0. 21. Исходя из положения указанных элементов (азота и фосфора) в Периодической системе, охарактеризуйте свойства высших оксидов и соответствующих гидроксидов (кислот или оснований). Какие основания или кислоты из данных пар являются более сильными? Ответ обоснуйте. Решение. Структура электронной оболочки атома азота N 1s22s22p3. Такое строение характерно для типичного неметалла, т.е. атом азота способен принимать электроны (быть окислителем), чтобы иметь завершенный электронный слой. Формула высшего оксида азота N2O5, а соответствующего гидроксида HNO3. Оксид проявляет кислотные свойства, гидроксид – одна из самых сильных кислот. Атом фосфора является электронным аналогом азота, имеет электронную структуру 1s22s22p63s23p3, способен принимать электроны, т.е. проявляет также свойства неметалла, однако менее выраженные (так как увеличивается число электронных слоев). Оксид фосфора P2O5 – кислотный оксид, гидроксид фосфора – кислота средней силы H3PO4. Имеет менее выраженные кислотные свойства по сравнению с азотной кислотой, так как неметаллические свойства азота выражены сильнее. А чем ярче выражены неметаллические свойства элемента, тем сильнее кислотные свойства соответствующего гидроксида. 60. Определите тип химической связи для веществ CH4, H2, Ni, NaCl. Сравните их по термической устойчивости, растворимости в воде и способности к диссоциации. Решение. Молекулу метана CH4 образуют два неметалла с небольшой разностью электроотрицательностей, поэтому связь между атомами ковалентная полярная. Разностью электроотрицательностей ΔЭО в молекуле водорода H2 ноль, следовательно, тип химической связи – ковалентная неполярная. Для никеля характерная металлическая связь – связь между катионами металла, закрепленными в узлах металлической кристаллической решетки, и свободными электронами. В молекуле хлорида натрия NaCl возникает ионная связь в результате электростатического взаимодействия противоположно заряженных ионов натрия и хлора (связь образуется между элементами с большим различием значений электроотрицательности). Термически устойчивыми будут вещества с ионной и металлической связями – никель и хлорид натрия, в воде растворяться и диссоциировать будет только соль, растворимость газов (метана и водорода) в воде очень низкая, никель в воде растворяться не будет. 78. Для реакции, соответствующей Вашему номеру задания, рассчитайте:   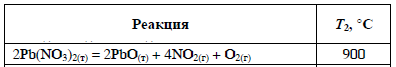 Решение. Выпишем из приложения необходимые для расчетов данные:  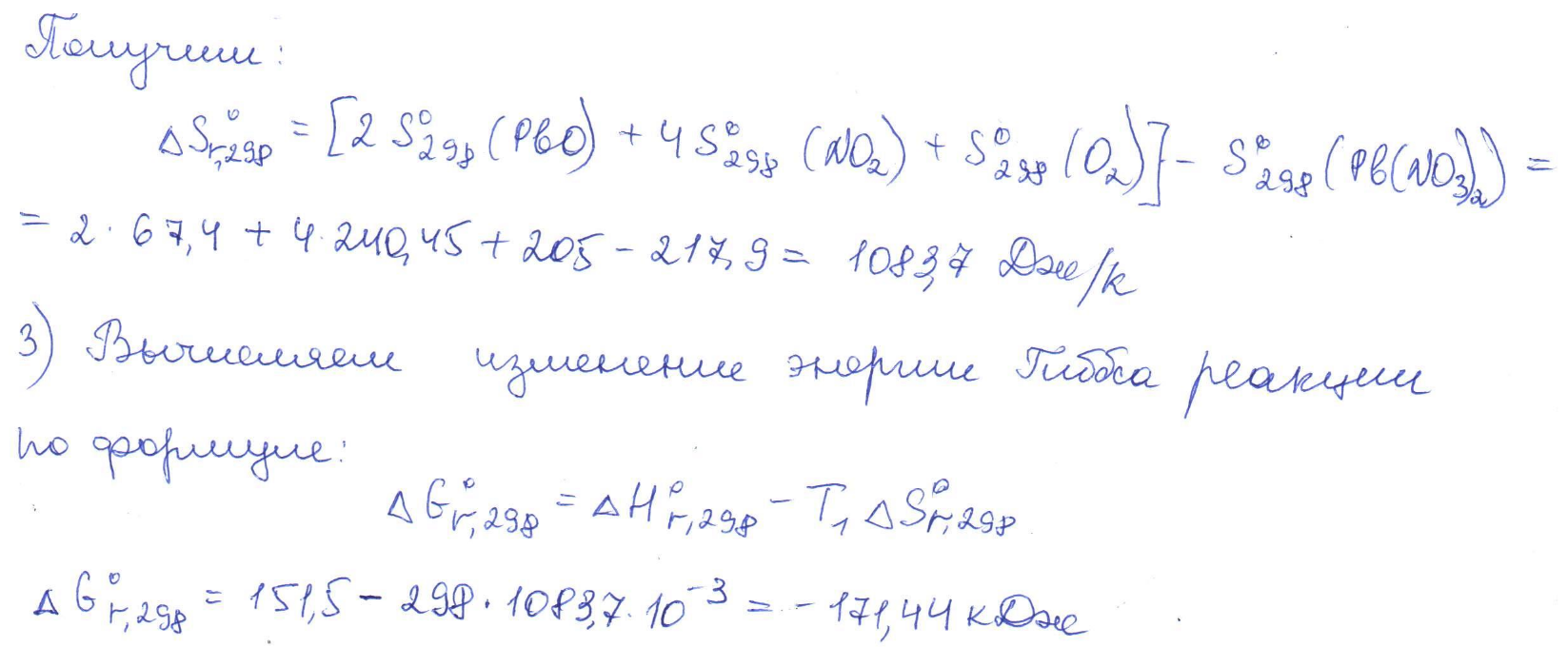 Поскольку ΔG0r,298 < 0, то рассматриваемая реакция при температуре 298 К самопроизвольно протекает в прямом направлении. Знак ΔG определяет энтропийный фактор.  Получилось, что энергия Гиббса химической реакции меньше нуля, следовательно, самопроизвольное протекание реакции в прямом направлении при Т2 = 1173 К также термодинамически возможно. Знак ΔG определяет энтропийный фактор. При увеличении температуры величина энергии Гиббса уменьшается, а вероятность протекания прямой реакции увеличивается. 99. Для реакции, соответствующей Вашему номеру задания, выполните следующее: 1. Напишите уравнение для скорости прямой реакции согласно закону действующих масс. 2. Определите, как изменится скорость прямой реакции в следующих условиях: а) если концентрацию каждого из исходных веществ увеличить в а раз; б) если объем исходных веществ увеличить в b раз. 3. Определите, как изменится скорость этой реакции при повышении температуры от Т1 до Т2 с заданным значением γ.  Решение. 1) Зависимость скорости реакции от концентрации реагирующих веществ выражает закон действующих масс (ЗДМ): при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам реакции. Уравнение для скорости прямой реакции согласно закону действующих масс: v1 = k ·[N2O]·[NO2]. 2) а) После увеличения концентраций N2O и NO2 в 3 раза: v2 = k ·3[N2O]·3[NO2] = 9 k ·[N2O]·[NO2] Скорость прямой реакции увеличится в 9 раз. б) После увеличения объема газовой смеси в три раза концентрации веществ соответственно уменьшатся в три раза: v3 = k ·[N2O]/3·[NO2]/3 = 1/9k ·[N2O]·[NO2] Скорость прямой реакции уменьшится в 9 раз. По правилу Вант-Гоффа: 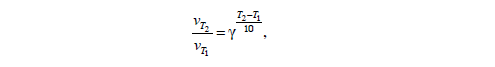 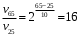 Следовательно, скорость реакции, протекающей при температуре 65 °С, увеличилась по сравнению со скоростью реакции, протекающей при температуре 25°С, в 16 раз. 120. Для реакции, соответствующей Вашему номеру задания, выполните следующее: 1. Рассчитайте константу равновесия KCи первоначальные концентрации исходных веществ, учитывая заданные значения равновесных концентраций (все вещества – газообразные). 2. На основании принципа смещения равновесия Ле Шателье определите, как влияют на смещение равновесия в реакции давление, температура и концентрации веществ, участвующих в реакции. Определите условия наиболее полного протекания реакции в прямом направлении.  Решение.  Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, подействовать извне, то равновесие смещается в том направлении, которое ослабляет это воздействие. При увеличении давления равновесие смещается в сторону уменьшения количества вещества газа, т.е. в сторону понижения давления; при уменьшении давления равновесие смещается в сторону возрастания количества вещества газов, т.е. в сторону увеличения давления. Протекание данной реакции в прямом направлении сопровождается увеличением давления (из 2 молекул газов образуется 3), поэтому для смещения равновесия вправо следует уменьшать давление. При изменении температуры изменяются скорости как прямой, так и обратной реакции, но в разной степени. Для выяснения влияния температуры на химическое равновесие необходимо знать знак теплового эффекта реакции. При повышении температуры равновесие смещается в сторону эндотермической реакции (ΔН > 0), при понижении температуры – в сторону экзотермической (ΔН < 0). Для данной реакции ΔH > 0, т.е. прямая реакция идет с поглощением тепла. Поэтому для смещения равновесия в сторону прямой реакции необходимо повысить температуру. При увеличении концентрации какого-либо исходного реагента равновесие реакции смещается в сторону расходования его, т.е. вправо (с образованием продуктов реакции). Равновесие можно сместить вправо, если уменьшать концентрацию продукта. Увеличение концентраций исходного вещества NOCl и уменьшение концентраций NO и Cl2 способствует протеканию прямой реакции. 138. Определите молярную концентрацию раствора, если массовая доля карбоната натрия в этом растворе составляет 12 %. Решение. Молярная концентрация (молярность) СМ выражается числом молей растворенного вещества, содержащегося в 1 дм3 раствора. Молярная концентрация измеряется в моль/дм3. Согласно справочнику плотность 12%-ного раствора карбоната натрия 1,1243 г/см3. Молярную концентрацию раствора находим по формуле: 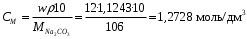 где w – массовая доля растворенного вещества, - плотность, М – молярная масса. 159. Определите общую жесткость воды, карбонатную и некарбонатную, а также рассчитайте солесодержание природной воды. Охарактеризуйте основные методы устранения жесткости воды. Составьте уравнения соответствующих реакций. 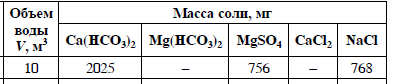 Решение.  Основные методы устранения жесткости воды Термический метод устранение жесткости воды используется только для устранения карбонатной (временной) жесткости. Метод основан на реакции разложения гидрокарбонатов при нагревании с образованием осадков карбонатов кальция и магния. Са(НСО3)2 = СаСО3↓ + СО2↑ + Н2О Mg (НСО3)2 = MgСО3↓ + СО2↑ + Н2О Химический или реагентный метод. В этом случае к воде известной жесткости добавляют рассчитанное количество реагента, переводящего ионы Са2+, Mg2+ в связанное состояние. Большое распространение получил известково-содовый метод. Воду обрабатывают растворами гашеной извести Са(ОН)2 и кальцинированной соды Na2CО3. При этом временная жесткость воды устраняется гашеной известью: Са (НСО3)2 + Са (ОН)2 = 2СаСО3↓ + 2Н2О Mg (HCO3)2 + 2Ca (OH)2 = Mg(OH)2↓ + 2CaCO3↓ + 2H2O а постоянная – содой: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4 Среди других реагентов отметим ортофосфат натрия Na3PO4, также часто используемый для умягчения воды: 3Са(НСО3)2 + 2Na3PO4 = Са3(РО4)2↓ + 6NaHCO3 3MgСl2 + 2Na3PO4 = Mg3(РО4)2↓ + 6NaCl Метод ионного обмена. Широкое применение в практике умягчения или полного обессоливания воды получили иониты. Это природные или синтетические вещества, способные к обмену катионов (катиониты) или анионов (аниониты). Например, катионит, содержащий катион водорода Н+, способный замещаться на катионы кальция Са2+ и Mg2+ по схеме: RH2 + Са2+ → RCa + 2Н+ RH2 + Mg2+ → RMg + 2H+ Аниониты имеют основный характер. Гидроксид-ион ОН-, входящий в их состав, способен обмениваться на анионы солей, содержащихся в воде, например: 2ROH + SO42- → R2SO4 + 2OH- Полного обессоливания воды можно добиться, пропуская воду последовательно через катионит, а затем через анионит. 161. Определите степень диссоциации α, константу диссоциации Kд, концентрацию ионов водорода [Н+], гидроксид-ионов [ОН–] и рН по заданным условиям (величины, которые нужно определить, обозначены через х). Для многоосновных слабых электролитов в расчетах учитывайте первую ступень диссоциации. Как изменится рН раствора, если разбавить раствор в 2 раза?  Решение. Гидроксид натрия NaOH является сильным электролитом, который диссоциирует практически полностью: NaOH = Na+ + OH- Следовательно, [OH-] = CM(NaOH) = C / M = 0,04 г/дм3 / 40 г/моль = 0,001 моль/дм3 Из соотношения рН + рОН = 14 находим: рН = 14 – рОН = 14 + lg[OH-] = 14 + lg0,001 = 11 240. В уравнениях окислительно-восстановительных реакций, соответствующих Вашему номеру задания, расставьте коэффициенты. Для реакции а используйте метод электронного баланса, а для реакции б – ионно-электронный метод. В каждой реакции определите окислитель и восстановитель. Вычислите ЭДС и константу равновесия реакции б. Определите направление и полноту протекания реакции в стандартных условиях. Значения стандартных электродных окислительно-восстановительных потенциалов приведены в приложении. 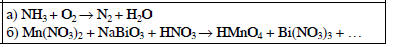 Решение. а) Азот в аммиаке имеет низшую степень окисления -3 и проявляет только восстановительные свойства. Кислород в этом случает будет окислителем. Азот окисляется от степени окисления -3 до 0 в простом веществе, а кислород восстанавливается от степени окисления 0 до -2 в воде. Сначала записываем уравнение реакции: Затем составляем электронные уравнения процессов окисления и восстановления, определяем окислитель и восстановитель: 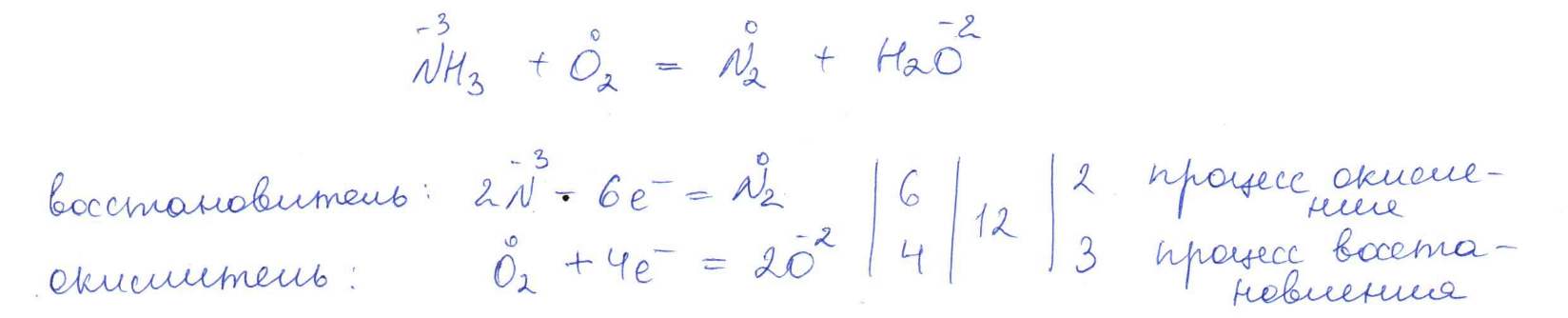 При определении коэффициентов перед окислителем и восстановителем руководствуются правилом: общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Наименьшее общее кратное для отданных и принятых электронов равно 12. Разделив это число на 4, получаем коэффициент 3 для окислителя, а при делении 12 на 6 получаем коэффициент 2 продукта окисления восстановителя. Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции с коэффициентами будет иметь вид: 4NH3 + 3O2 = 2N2 + 6H2O. 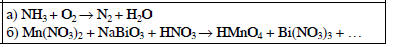 б) При составлении уравнения окислительно-восстановительной реакции ионно-электронным методом рекомендуется придерживаться следующего порядка: 1) Написать ионное уравнение реакции: Mn2+ + 2NO3- + NaBiO3 + H+ + NO3- = H+ + MnO4- + Bi3+ + 3NO3- + … 2) Составить ионно-электронные уравнения процессов восстановления и окисления с учетом среды, в которой протекает реакция; определить коэффициенты для окислителя и восстановителя. Данная реакция протекает в кислой среде, поэтому избыток атомов кислорода связывается ионами Н+ с образованием молекул воды, а недостаток кислорода восполняется за счет молекул воды с образованием ионов Н+:  3) Суммировать ионно-электронные уравнения, умножив каждое из них на найденные коэффициенты, при необходимости провести сокращение: 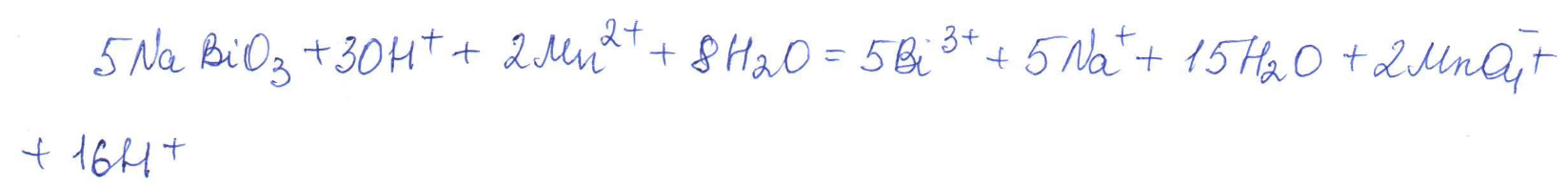 После сокращения: 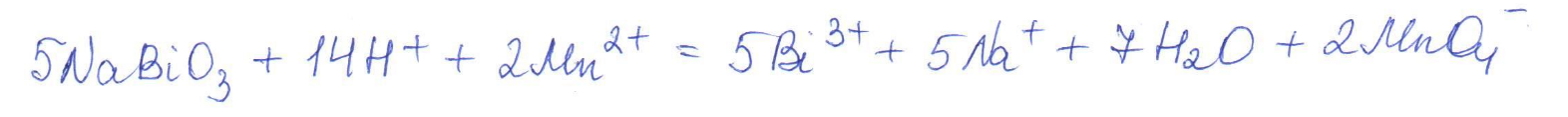 4) Написать уравнения в молекулярной форме и подобрать коэффициенты перед формулами остальных веществ, завершая при этом правую часть уравнения: 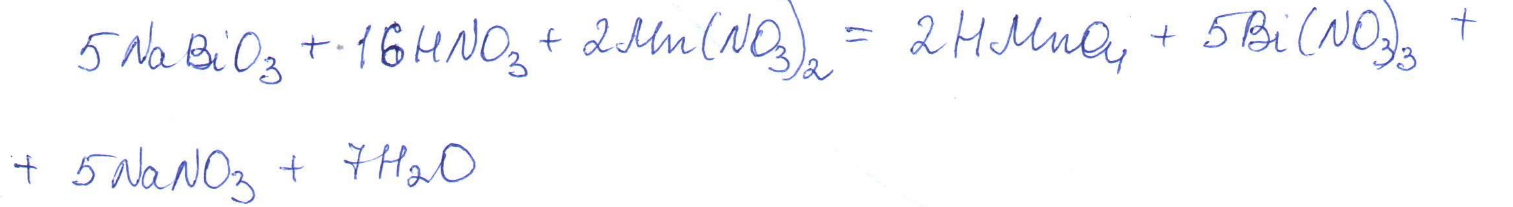 Направление протекания реакции определяем по величине стандартной энергии Гиббса ΔG0, которая связана с ЭДС окислительно-восстановительной реакции соотношением: ΔG0 = –nFE0, где n – число электронов, принимающих участие в реакции (наименьшее общее кратное числа электронов, участвующих в полуреакциях окисления и восстановления); F – постоянная Фарадея, F ≈ 96 500 Кл/моль; E0 – стандартная ЭДС окислительно-восстановительной реакции, В. Величину E0 рассчитывают как разность стандартных электродных окислительно-восстановительных потенциалов окислителя 0окисл и восстановителя 0восст: Для рассматриваемой реакции: При вычислении величины ΔG0 учитываем, что в полуреакциях окисления и восстановления участвует 10 электронов: Поскольку ΔG0 < 0, реакция идет в прямом направлении. Полноту протекания реакции определим по величине константы равновесия, ее рассчитываем по формуле 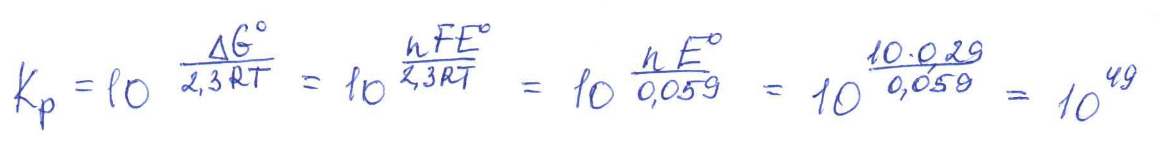 Большая величина константы равновесия свидетельствует о том, что равновесие реакции сдвинуто в сторону продуктов. 259. Составьте схему гальванического элемента, состоящего из пластин кадмия и железа, погруженных в растворы сульфата кадмия и сульфата железа (II) соответственно. Напишите электронные уравнения процессов, протекающих на аноде и катоде. Рассчитайте, при какой концентрации (моль/дм3) ионов Fe2+ ЭДС этого элемента будет равна нулю, если [Cd2+] = 0,001моль/дм3. Решение. Схема гальванического элемента: (−) FeFe2+Cd2+Cd (+). Железный электрод имеет меньший потенциал (0Fe2+/Fe = −0,440 В) и является анодом. Железо окисляется и в форме ионов переходит в раствор: Fe − 2е– = Fe2+. Кадмиевый электрод имеет больший потенциал (0Cd2+/Cd= −0,403 В) и является катодом. На катоде восстанавливается кадмий: Cd2+ + 2е– = Cd. Складывая уравнения анодного и катодного процессов, получаем суммарное уравнение реакции: Fe + Cd2+ = Fe2+ + Cd Fe + CdSO4 = FeSO4 + Cd ЭДС вычисляют по формуле: Зависимость электродного потенциала металла от концентрации ионов металла в растворе при стандартной температуре выражается уравнением Нернста: 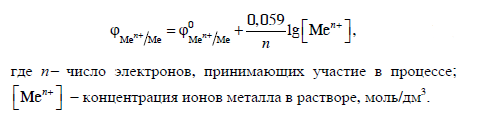  261. Составьте схему электролиза раствора. Напишите уравнения процессов, протекающих на электродах. Катодный процесс подтвердите расчетом. Рассчитайте массы веществ, выделившихся на электродах, при пропускании через раствор тока силой 1 А в течение 1 ч. Парциальное давление водорода в воздухе равно 5·10–7 атм. Значения стандартных электродных потенциалов металлов приведены в приложении. 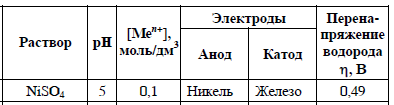 Решение.     Массу никеля, которая выделится на катоде, находим по закону Фарадея:  ЭNi = 29,35 г/моль 1 ч = 3600 сек mNi = 29,35·1·3600 / 96500 = 1,095 г 284. Для НАТРИЯ выполните следующее: 1. Напишите электронную формулу. Укажите возможные степени окисления элемента. Определите ковалентность. Приведите примеры типичных соединений в данных степенях окисления (оксиды, гидроксиды, соли). 2. Напишите уравнения реакций, характеризующих взаимодействие металла: а) с простыми веществами (кислородом, серой, галогенами); б) с растворами солей, оснований; в) с разбавленной азотной кислотой; г) с разбавленной соляной кислотой. Возможность реакции в, протекающей в стандартных условиях, и реакции г, протекающей при парциальном давлении водорода PH2 = 5·10–7 атм и концентрации HCl 0,01 моль/дм3, подтвердите расчетом. 3. Составьте уравнения реакций получения заданного металла в чистом виде из природного соединения или руды, используя один из промышленных методов (гидрометаллургический, металлотермический, пирометаллургический электрометаллургический, электрогидрометаллургический). Решение. 1) Согласно положению в Периодической системе атом натрия имеет следующую электронную формулу: 1s2 2s2 2p6 3s1 Электронно-графическую структуру атома натрия можно представить следующей схемой: 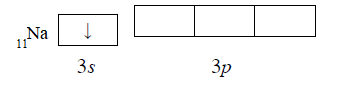 Атом натрия может отдавать электрон, поэтому для него возможная только степень окисления +1. Ковалентность равна 1. Оксид натрия Na2O проявляет основные свойства, гидроксид – NaOH – щелочь. Натрий образует множество солей: NaCl, NaBr, Na2S, Na2SO4, NaNO3 и др. 2) а) 4Na + O2 = 2Na2O; 2Na + S = Na2S; 2Na + Cl2 = 2NaCl. б) Натрий не замещает металлы в растворах их солей, так как реагирует с водой: 2Na + 2H2O = 2NaOH + H2 C основаниями реакция натрия не идет. в) с разбавленной азотной кислотой  г) с разбавленной соляной кислотой.   3) В настоящее время электролиз – основной способ получения натрия. В качестве исходных веществ используют хлорид натрия и щелочь: 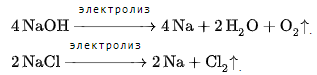 340. Два металла находятся в контакте друг с другом. Какой металл из заданной пары будет подвергаться коррозии? Определите термодинамическую возможность коррозии этого металла с указанной деполяризацией при заданном значении рН (Т = 298 К). Концентрация ионов металла в водном растворе 0,001 моль/дм3. Парциальные давления водорода и кислорода имеют следующие значения: PH2 = 5 · 10–7 атм, PО2 = 0,21 атм. Напишите электронные уравнения процессов, протекающих на анодном и катодном участках. Для защиты данного металла от коррозии подберите анодное и катодное покрытия и составьте уравнения процессов, происходящих при нарушении данного покрытия в растворе соляной кислоты. 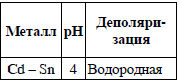 Решение. Кадмий – более активный металл, чем олово, поэтому он является анодом, а олово – катодом: Коррозии будет подвергаться кадмий. Коррозия, как самопроизвольный процесс, протекает, если энергия Гиббса реакции имеет отрицательное значение (ΔG < 0). Для расчета энергии Гиббса ΔG необходимо вычислить электродвижущую силу Е0, а также потенциалы окислителей и восстановителя.  Для защиты от коррозии в качестве анодного покрытия нужно выбрать более активный металл, чем кадмий, например, цинк. При нарушении данного покрытия, находящегося в растворе соляной кислоты, происходят процессы: – анодный: Zn – 2е– = Zn2+, окисление; – катодный: 2H+ + 2е– = H2, восстановление. Для защиты от коррозии в качестве катодного покрытия нужно выбрать менее активный металл, чем кадмий, например, свинец. При нарушении данного покрытия, находящегося в растворе соляной кислоты, происходят процессы: – анодный: Cd – 2е– = Cd2+, окисление; – катодный: 2H+ + 2е– = H2, восстановление. |
