Реферат ПКС. Российский Университет Дружбы Народов Медицинский факультет Кафедра травматологии и ортопедии
 Скачать 0.56 Mb. Скачать 0.56 Mb.
|
|
Российский Университет Дружбы Народов Медицинский факультет Кафедра травматологии и ортопедии Повреждение передней крестообразной связки коленного сустава и методики ее оперативного восстановления. Выполнила Клинический ординатор 2-го года Котова М.Н. Москва, 2010г. Повреждения связочных структур составляют 69-76% случаев от всех травм коленного сустава (КС). Данное утверждение в особенности справедливо для людей, занимающихся спортом с повышенным риском (футбол, баскетбол, волейбол, лыжный спорт), что связано с прыжками и скручивающими движениями. Из всех повреждений коленного сустава 32% приходятся на разрывы передней крестообразной связки (ПКС), приводящих к развитию нестабильности. Посттравматическая нестабильность коленного сустава рассматривается как состояние, при котором нарушается соответствие функциональных опорных площадей бедра и голени в результате повреждения связочных структур коленного сустава. Повреждение передней крестообразной связки приводит к прогрессирующей хронической нестабильности коленного сустава, преждевременным дегенеративным изменениям. В мировой литературе существует много разногласий по установлению показаний к оперативному лечению при повреждениях передней крестообразной связки коленного сустава и по выбору хирургической тактики. Расходятся мнения хирургов по использованию тех или иных трансплантатов для реконструкции передней крестообразной связки, по способу фиксации этих трансплантатов и выбору адекватных имплантатов для ее осуществления. Анатомия и строение передней крестообразной связки коленного сустава ПКС – это соединительнотканный тяж (в среднем 32 мм длиной, 9 мм шириной), который направляется от задней внутренней поверхности наружного мыщелка бедренной кости к заднему отделу межмыщелковой ямки на большеберцовой кости (Рис. 1). Нормальная ПКС имеет угол наклона 27º при 90º сгибания, ротационная составляющая волокон в местах прикрепления на большеберцовой и бедренной костях - 110º, угол внутрипучкового скручивания коллагеновых волокон колеблется в пределах 23-25º. При полном разгибании волокна ПКС идут примерно параллельно сагиттальной плоскости. Существует небольшая ротация связки по отношению к продольной оси, форма тибиального отхождения овальная, длиннее в переднезаднем направлении, чем в медиально-латеральном. В ПКС выделяют узкий, антеромедиальный пучок, который натягивается при сгибании и широкий постеролатеральный пучок, имеющий напряжение волокон при разгибании. Передняя крестообразная связка является первичным ограничителем переднего смещения голени при всех углах сгибания в коленном суставе, принимая на себя около 80-85% противодействия этому движению. Максимальное значение данного ограничения отмечается при 30º сгибания в суставе. Изолированное секционирование ПКС ведет к большей трансляции при 30º, чем при 90º. ПКС также обеспечивает первичное ограничение медиального смещения большеберцовой кости при полном разгибании и 30º сгибания в суставе. Вторичная роль ПКС как стабилизатора состоит в ограничении ротации голени, особенно при полном разгибании, причем являясь большим сдерживателем внутренней ротации, чем наружной. Однако отдельные авторы указывают на то, что при изолированном повреждении ПКС возникает незначительная ротационная нестабильность. 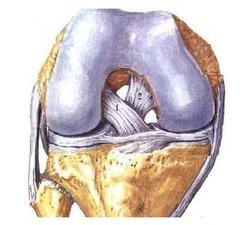 Рисунок 1. 1. – передняя крестообразная связка 2. – задняя крестообразная связка Механизм повреждения передней крестообразной связки коленного сустава Повреждение ПКС может произойти как в результате прямого, так и непрямого механизма травмы, при внутренней или наружно ротации (Рис. 2). Пациенты обычно испытывают неприятные ощущения в коленном суставе и падают на землю. Часто они описывают ощущения в суставе при помощи двух ”кулаков”(Рис.3), характеризуя неустойчивость в суставе. В 80% острой травмы ПКС слышен треск или щелчок. В течение 3 часов после травмы развивается гемартроз коленного сустава, но у некоторых пациентов он может развиться в течение 24 часов после травмы. В большинстве случаев совместно с ПКС повреждается и мениск. Мениск или культя ущемившийся связки могут приводить к блокаде коленного сустава. 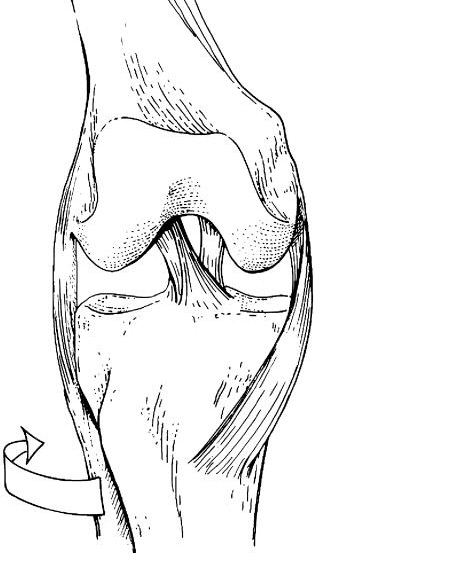 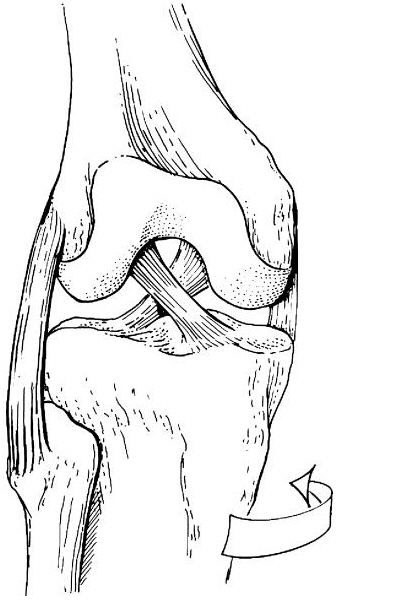 Рисунок 2. Повреждение ПКС при наружной или внутренней ротации 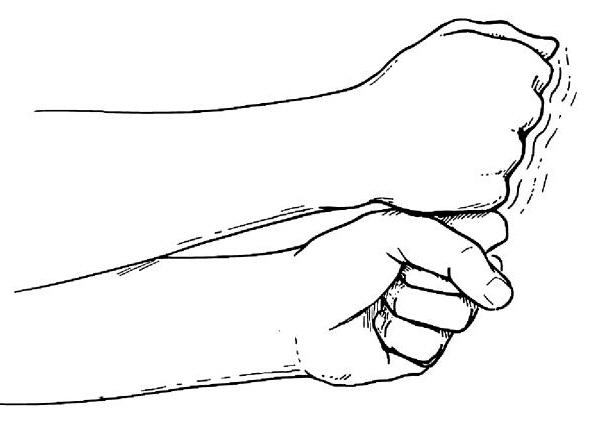 Рисунок 3. Демонстрация пациентом нестабильности коленного сустава Диагностика повреждений передней крестообразной связки Полный разрыв связочных структур крайне редко происходит без сопутствующего повреждения других элементов коленного сустава. Подчас сложно выявить ведущее повреждение, так как тесная функциональная взаимосвязь всех структурных элементов определяет наличие сочетанной патологии практически во всех случаях. Для выявлений повреждений или неполноценности ПКС используется симптом “переднего выдвижного ящика” (ПВЯ) – пассивное смещение голени (передняя трансляция) – также при различной сгибательной установке голени. Градации этого симптома: I степень (+) – 6-10 мм, II степень (++) – 11-15 мм, III степень (+++) – более 15 мм. Кроме того, симптом GDZ следует оценивать при различной ротационной установке голени - 30º наружной и внутренней ротации. Симптом Lachman признан наиболее патогномичным тестом для выявления повреждений передней крестообразной связки. Считается, что он дает наибольшую информацию о состоянии ПКС при острой травме коленного сустава, так как при его выполнении почти полностью отсутствует мышечное и капсулярное противодействие переднезадней трансляции (смещению) голени, а также при хронической нестабильности коленного сустава. Lachman-тест выполняют в положении лежа на спине. Пациента просят расслабить мышцы обеих ног. Одной рукой захватывают дистальный отдел бедра, а другой – проксимальный голени. Коленный сустав сгибают до 15-20º и затем пассивно смещают голень в переднезаднем направлении. Оценка теста Lachman производится по величине переднего смещения большеберцовой кости относительно бедра. Некоторые авторы используют следующие градации: I степень (+) – 5 мм, II степень (++) – 8 мм, III степень (+++) – 13 мм, IV степень (++++) – 18 мм. Симптом переднего динамического подвывиха голени (pivot shift test) тоже относится к симптомам, патогномоничным неполноценности ПКС. Тестирование проводят в положении лежа на спине, мышцы ног должны быть расслаблены. Одна рука захватывает стопу и поворачивает голень внутрь, другая располагается в области латерального мыщелка бедра. При медленном сгибании коленного сустава до 30-40º она ощущает возникновение переднего подвывиха большеберцовой кости, который устраняется при дальнейшем сгибании. Pivot shift test по McIntosh выполняется в аналогичном положении пациента. Одной рукой производят внутреннюю ротацию голени, а другой вальгусную девиацию. При положительном тесте латеральная часть суставной поверхности большеберцовой кости (наружное плато) смещается кпереди и при медленном сгибании коленного сустава до 30-40º происходит ее обратное смещение. Хотя и считается, что pivot shift test патогномоничен неполноценности ПКС, но он может быть отрицательным при повреждении илиотибиального тракта, полном продольном разрыве медиального или латерального мениска с дислокацией его тела (разрыв по типу “ручки лейки”), выраженном дегеративном процессе в латеральном отделе сустава, гипертрофии бугорков межмыщелкового возвышения большеберцовой кости и др. Активный Lachman-тест может использоваться как при клиническом осмотре, так и при рентгенологическом обследовании. При повреждении ПКС переднее смещение большеберцовой кости достигает 3-6 мм. Тестирование проводится в положении лежа на спине, при полностью выпрямленных ногах. Одну руку подкладывают под бедро исследуемой конечности, согнув ее в коленном суставе под углом 20º, и кистью захватываю коленный сустав другой ноги так, чтобы бедро исследуемой конечности лежало на предплечье исследователя. Другую кисть помещают на переднюю поверхность голеностопного сустава пациента и его пятку прижимают к столу. Затем просят пациента напрячь четырехглавую мышцу бедра, и внимательно следят за перемещением бугристости большеберцовой кости кпереди. При ее смещении более чем на 3 мм симптом считается положительным, что указывает на повреждение ПКС. Для определения состояния медиальных и латеральных стабилизаторов сустава аналогичный тест можно выполнять при внутренней и наружной ротации голени. Для повреждения ПКС характерен jerk-тест. В коленном суставе задается сгибание 50º при внутренней ротации голени. Приложение вальгусной силы на проксимальный отдел большеберцовой кости и постепенное разгибание голени приводит к ее подвывиху при 30º сгибания, который устраняется при полном разгибании. Тест флекия-ротация – “передний выдвижной ящик”. Данный симптом является комбинацией jerk-теста и Lachman-теста. Пациент лежит на спине, коленный сустав полностью разогнут. Конечность приподнимают, что ведет к смещению бедра кзади и кнаружи, голень переходит в положение передненаружного подвывиха. Магнитно-резонансная томография ПКС в норме при МРТ представляет собой темную полоску сигнала низкой интенсивности. От бедренной инсерции в постмедиальной части наружного мыщелка бедренной кости ПКС идет кпереди вниз и медиально. Тибиальное прикрепление находится антеролатерально на бугорках межмыщелкового возвышения. ПКС хорошо визуализируется на сагиттальных срезах при экстензии с наружной ротацией голени 15-20º. Наружная ротация уменьшает артефакты и рапрямляет ПКС в сагиттальной плоскости. ПКС ярче, чем PRC? Что важно, так как это может привести к неправильному диагнозу разрыва GRC/ Макроскопическая анатомия крестообразных связок также различна: если PRC представлена параллельными волокнами, то ПКС – скрученными. Данные, говорящие о разрыве ПКС следующие: отсутствие визуализации GRC? Отсутствие непрерывности волокон связки или аномальная ориентация оставшихся волокон. Полный разрыв ПКС диагностируется больше по косвенным данным: передняя трансляция голени, чрезмерный задний наклон ПКС. Волнистый контур ПКС при частичном или полном разрыве. Артроскопия Артроскопическая диагностика является уневирсальным методом обследования, результаты которого всегда сравнивают с данными других исследований. Наибольшую ценность артроскопия имеет при различной внутрисуставной патологии: повреждения менисков, ПКС, ЗКС, суставного хряща, патологическое состояние синовиальных складок и т.п. Особую актуальность артроскопия приобретает при острой травме, когда имеется крайне искаженная симптоматика и невозможность проведения объективного тестирования из-за болевого синдрома. При диагностической артроскопи, производимой в ближайшие дни после травмы, нужно тщательно отмывать сустав от крови, что в дальнейшем предупреждает прогрессирование гонартроза. Кроме того, это обеспечивает лучшую верификацию сопутствующей внутрисуставной патологии. Оперативное лечение нестабильности коленного сустава В настоящее время предложено около 250 различных методов оперативного лечения повреждений капсульно-связочного аппарата коленного сустава. В связи с использованием новых данных в области функциональной анатомии и биомеханики коленного сустава, совершенствованием инструментария и техники операций, увеличением прочности трансплантатов и более стабильной их фиксации, дающей возможности в более ранние сроки и интенсивнее проводить реабилитационные мероприятия, результаты лечения этой патологии улучшились. Трансплантаты Трансплантаты, используемые в целях замещения поврежденных связочных элементов, делятся на ауто-, алло- и синтетические. Биомеханические свойства трансплантатов определяются: а) прочностными характеристиками, а именно, конечной прочностью, то есть величиной максимальной нагрузки, при которой он разрушается; б) структурными свойствами комплексного трансплантата, зависящими от жесткости трансплантата и определяющимися кривой деформации нагрузки; в) материальными свойствами трансплантата, то есть из какой ткани он состоит, что определяется кривой стресс-растяжения ткани, на которую влияют ориентация, организация и тип коллагенновых волокон; г) скоростью нагрузки, при которой трансплантаты испытывают запредельное растяжение. Трансплантат, обладающий наибольшей прочностью, является не самым лучшим, так как он принимает всю нагрузку на себя до включения вторичных стабилизаторов. Другое свойство: эластичность обеспечивает толерантность к переменным силовым воздействиям. Вместе с тем, отсутствие достаточной прочности вызывает избыточное растяжение трансплантата, большинство его структур будут испытывать более высокие пиковые растяжения, что снижает способность выполнять стабилизирующую функцию. Требования, предъявляемые к прочности трансплантата, достаточно высокие – в среднем это 1700 N. За аналог взяты прочностные характеристики крестообразных связок. На эти показатели значительно влияют многие факторы: возраст, пол, вес, профессиональная деятельность, спортивная активность пациента и др. Аутотрансплантаты Чаще всего при оперативных стабилизациях коленного сустава используются различные аутотрансплантаты. Аутотрансплантаты из порции связки надколенника (Рис. 4) применяло большое число авторов, другие отдавали предпочтение аутотрансплантатам из сухожилий m. semitendinosus и m. Gracilis (Рис. 5). Сравнивая эти две группы аутотрансплантатов следует отметить, что жесткость и соответствующие прочностные характеристики у аутотранслантатов из связки надколенника выше, чем у трансплантатов задней группы мышц бедра. Несмотря на то, что метод фиксации трансплантата связки надколенника жестче, это не давало большого натяжения трансплантата. Наиболее слабое звено в трансплантатах сухожилий m. semitendinosus и m. gracilis – это фиксация мягкотканой части трансплантата к кости. Как результат – более длительный период до начала функционального восстановительного лечения. Ряд авторов сообщает об осложнениях в месте взятия аутотрансплантата из связки надколенника в виде переломов и отрывов. Проблемы, связанные с дегенеративным процессом в пателло-феморальном суставе бывают в обоих случаях. Аналогичные изменения возникают и при использовании аллотрансплантатов из tractus iliotibialis. Изокинетические исследования показали незначительное снижение силы после взятия трансплантата m. semitendinosus. При использовании трансплантата из связки надколенника в отдаленном послеоперационном периоде у пциентов несколько чаще наблюдался пателло-феморальный артроз. Это связано с тем, что после забора аутотрансплантата происходит перераспределение давления в пателло-феморальном сочленении на меньшую площадь контакта, то есть оно возрастает. В одном случае произошел перелом надколенника при формировании трансплантата из связки надколенника. Скручивание аутотрансплантатов на 90º по аналогии с нормально ПКС давало увеличение прочностных характеристик трансплантата на 30%, однако при перекруте на 180º возрастала возможность его разрушения при значительном увеличении жесткости и снижении эластичности. При использовании связки надколенника для пластических целей в большинстве случаев отдается предпочтение центральной порции, так как она имеет 168% от прочности ПКС. Необходимо отметить, что на этапах реваскуляризации и реорганизации прочность аутотрансплантатов уменьшается. Однако аутотрансплантаты из связки надколенника удовлетворяют всем требованиям даже с учетом этой ситуации. Толщина взятия аутотрансплантат из связки надколенника имеет определенную значимость от его прочностных характеристик. Так, 7 мм толщины центральной порции – 51% прочности ПКС, 15 мм толщины центральной порции – 46,6% прочности ПКС; 10 мм центральной порции – 70% прочности ПКС. Ниже приведены величины прочностных характеристик различных аутотрансплантатов (по сравнению с нормальной ПКС). Аутотрансплантат связки надколенника: А) центральная часть – 168%; Б) медиальная часть 159%; сухожилие m. semitendinosus – 70%; сухожилие m. gracilis – 49%; дистальная часть tractus iliotibialis (18 мм) – 44%; fascia lata (16 мм) – 36%. 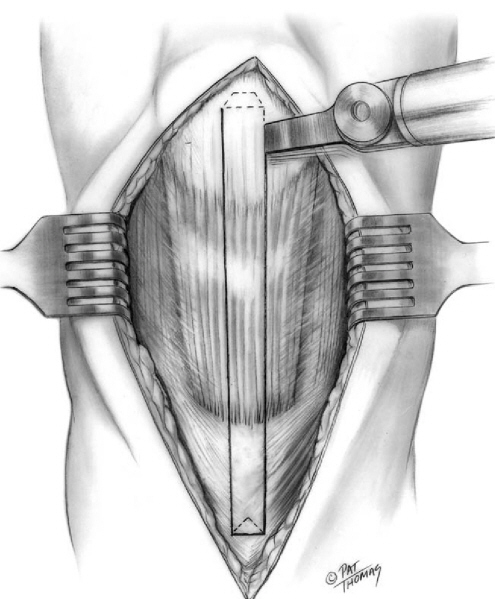 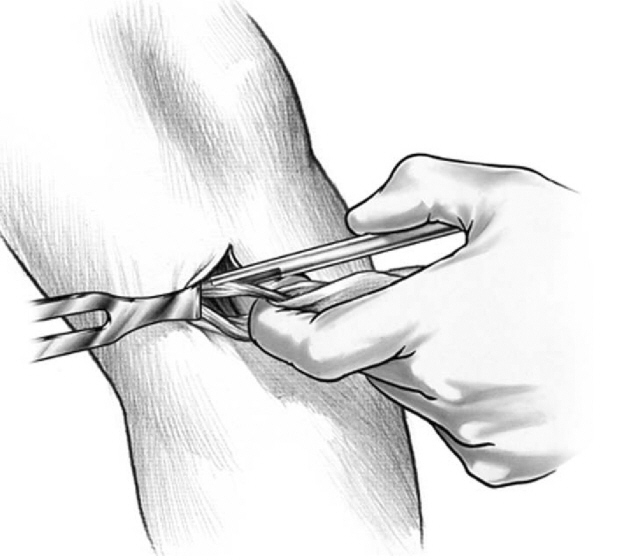 Рисунок 4. Трансплантат из порции Рисунок 5. Трансплантат из подколенных связки надколенника сухожилий Крайне важна гистологическая картина при использовании аутотрансплантатов в качестве заменителей поврежденных связок коленного сустава. Экспериментальные данные на животных показали, что после реконструкции ПКС наиболее быстро и широко реваскуляризируется перилигаментарная ткань, которая появляется к одному месяцу после операции и является основным источником питания в процессе клеточной пролиферации. Процесс ревасуляризации трансплантата в дальнейшем повышает его устойчивость к аутолизу, то есть к агрессивному воздействию синовиальной среды, хотя, безусловно, на начальном этапе его жизнеспособность зависит от синовиальной диффузии, а не от реваскуляризации. Внутрисуставное расположение трансплантата характеризуется определенными особенностями течения процесса его адаптации в суставе и называется лигаментизацией. Гистологические изменения в аутотрансплантате следующие: архитектура аутотрансплантата с широкой, грубой, слоистой характеристикой с течением времени замещается на тонкую, узкую, слоистую фактуру. Происходит клеточная трансформация, которая заключается в увеличении целлюлярности от произвольной ориентации фибробластов до продольно ориентированных волокон овальной формы. Наиболее исчерпывающим исследованием, подводящим итог всему вышесказанному, является работа B. Rougraff (1997), в которой описаны все этапы гистологических изменений после реконструктивных операций. Таким образом, процесс реадаптации аутотрансплантата в суставе длительный и включает определенные во временном аспекте этапы. Недостатки данного вида аутотрансплантата заключаются в том, что возможны разрывы в связке надколенника, ограничение движений, слабость четырехглавой мышцы бедра. Аутотрансплантаты сухожилий m. semitendinosus и m. gracilis имеют некоторые преимущества по сравнению с предыдущим типом трансплантата. Так, минимален операционный разрез для забора трансплантата, меньше осложнений со стороны разгибательного аппарата коленного сустава. Однако, имеются очевидные недостатки, а именно: меньшая прочность трансплантата, недостаточная жесткая фиксация, невозможность проведения быстрого курса функционального восстановительного лечения. Аутотрансплантаты из tractus iliotibialis обладает рядом недостатков, а именно: прочностные характеристики составляют 50% от нормальной ПКС, больший травматичный разрез для забора аутотрансплантата, отсюда и больший процент плохих отдаленных результатов лечения. В случае антеролоатеральной нестабильности использование данного вида аутотрансплантатов способствует увеличению патологического варусного отклонения голени. Аллотрансплантаты Наибольшее распространение для пластических целей получили следующие алломатериалы: порция связки надколенника, ахиллово сухожилие, сухожилия m. semitendinosus и m. gracilis, широкая фасция бедра. По данным ряда авторов, биомеханические, биохимические и гистологические характеристики алломатериалов схожи с анологичными данными аутотрансплантатов. Однако при использовании аллотканей необходимо учитывать другие более важные свойства – биологические. Так, R. Linn et al. (1993) показали увеличение внутрикостного туннеля при аллореконструкции связок по сравнению с аутоматериалами, что может быть связанно с отторжением в результате иммунной реакции. M. Fahey и P. Indelcato (1994) также показали увеличение диаметра внутрикостных туннелей при аллопластическом способе восстановления ПКС. Сообщалось о гуморальных и клеточно-обусловленных иммунных реакциях при использовании аллотрансплантатов, обнаруживались синовиальные антитела, что вело к лизису трансплантата. Другие авторы не отмечали подобного явления при использовании аналогичных пластических материалов. По всей видимости, данный феномен связан с этиленоксидом, который используется для обработки аллотрансплантатов. Отмечалось, что при выраженной иммунной реакции происходило лизирование аллотрансплантата. Однако самой большой проблемой, что значительно сдерживает распространение аллопластических методов реконструкции, является риск переноса различных заболеваний. Так, рядом авторов сообщалось о возможности переноса вируса СПИДА и гепатита В. Поэтому разработаны жесткие требования по отбору доноров аллопластического материала и принципы его обработки. Существует значительное количество способов стерилизации аллотрансплантатов (этиленоксид, гамма-облучение). Но при этом большинство авторов подчеркивают заметное ухудшение свойств и характеристик трансплантатов в результате вышеуказанных методов стерилизации. Учитывая все вышеизложенное, в том числе и более медленное заживление в результате местного отторжения при использовании аллотканей для пластических целей, целесообразно их применение у пациентов немолодого возраста, где нет необходимости в проведении быстрой активной реабилитации. Синтетические протезные материалы Ранее синтетические протезные материалы находили широкое применение в качестве заместителей поврежденных лигаментарных структур. В настоящее время, несмотря на уменьшение интереса к данному типу пластического материала, имеется значительное количество сообщений об использовании синтетических протезов. Однако в большей степени прослеживается тенденция использования синтетического материала в качестве усиления ауто- и аллотрансплантатов. Несмотря на то, что синтетические материалы обладают хорошими прочностными характеристиками, нет необходимости в дополнительном разрезе для забора трансплантата, имеются отрицательные моменты при их использовании. Синтетические протезы являются жесткими, неэластичными, что не прощает любого, даже небольшого смещения топики проведения внутрикостных туннелей. Возникает либо резорбция костной ткани или разрыв протеза. С течением времени прогрессирует деформирующий артроз, поскольку в создаваемой жесткой системе значительно возрастает давление на единицу площади суставной поверхности артикулирующих костей. Работы ряда исследователей подтверждают, что с течением времени может наступить расслабление протеза, которое ведет к его функциональной недостаточности и рецидиву нестабильности. Биохимические исследования последних лет наглядно показали, что при износе протеза его частицы в большом количестве пребывают в суставной жидкости, способствуя появлению в суставе разрушающих ферментов. Это является причиной рецидивирующего синовита. Фиксация трансплантатов Первоначально жесткая фиксация трансплантата имеет решающее значение при любом типе реконструкции ПКС. Достижение жесткой первоначальной фиксации трансплантата позволяет свести к минимуму неудачи и относительное удлинение участков фиксации трансплантата во время циклических нагрузок на коленный сустав до момента реорганизации трансплантата в месте его фиксации. Так как необходимо длительное время для костной интеграции трансплантатов из подколенных сухожилий, важно использовать сильную и жесткую фиксацию, которая снижает скольжение при циклических нагрузках, чтобы предотвратить прогрессирование нестабильности в послеоперационном периоде. Тем не менее, в настоящее время оптимальный метод фиксации трансплантата из подколенных сухожилий остается спорным, и нет консенсуса относительно того, при каком методе фиксации получены наилучшие результаты лечения. Бедренные варианты фиксации (Рис.6) Лабораторные биомеханические исследования продемонстрировали, что EndoButton и cross pins обеспечивают крепкую бедренную фиксацию при минимальном скольжении во время циклических нагрузок. Хотя внутритуннельная фиксация интерферентными винтами - популярная техника фиксации трансплантата из подколенных сухожилий, лабораторные биомеханические исследования продемонстрировали, что этот метод фиксации является самым слабым и имеет наибольшее скольжение во время циклических нагрузок. 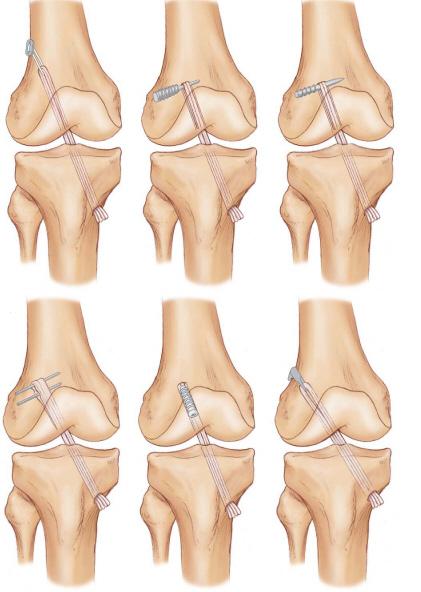 Рисунок 6. Варианты бедренной фиксации трансплантатов. Большеберцовые варианты фиксации (Рис. 7) При большеберцовой фиксации отмечается слабая связь фиксации трансплантатов ПКС, что является проблематичным. Проблемы с большеберцовым результатом фиксации прежде всего связаны с более низкой минеральной плотностью проксимального отдела голени и тем фактом, что большеберцовые устройства фиксации должны сопротивляться срезающим силам прикладываемым параллельно оси туннеля в большеберцовой кости. Кортикальные методы фиксации могут быть обращены к проблеме более низкой минеральной плотности проксимального отдела большеберцовой кости. Они часто видны и могут вызвать местное раздражение кожи и причинять боль, что может потребовать вторую операцию для их удаления. Внутритуннельная большеберцовая фиксация интерферентными винтами устраняет проблему их видимости; однако, лабораторные биомеханические исследования показали, что этот метод фиксации является самым слабым и демонстрирует самое большое скольжение при циклических нагрузках. На основании легкости использования и биомеханических исследований, которые демонстрируют высокую начальную силу фиксации и жесткость с минимальным скольжением при циклических условиях нагрузки, остается предпочитаем внутритуннельная большеберцовая фиксация с помощью IntraFix. 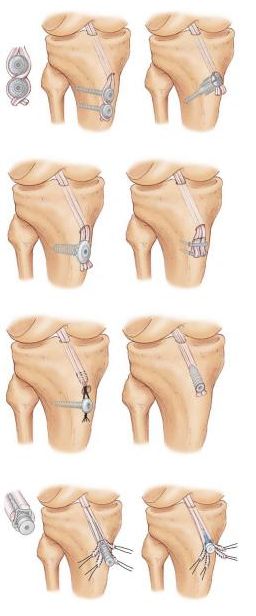 Рисунок 7. Варианты большеберцовой фиксации трансплантатов. Использованная литература 1. Brian J. Cole, Jon K. Sekiya “Surgical Techniques of the Shoulder, Elbow, and Knee in Sports Medicine “, 2008 2. Mark D. Miller, Brian J. Cole “Textbook of Arthroscopy”, 2004 3. Brian P. McKeon, James V. Bono, John C. Richmond “Knee Arthroscopy”, 2009 4. S. Terry Candle, James H. Beaty “Campbell’s operative orthopedics” eleventh edition, 2007 5. Миронов С.П., Орлецкий А.К., Цыкунов М.Е. “Повреждения связок коленного сустава”, 1999 |
