Отчёт по прктике Лабораторные животные. Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования Пензенский государственный аграрный университет
 Скачать 55.35 Kb. Скачать 55.35 Kb.
|
|
Министерство сельского хозяйства Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Пензенский государственный аграрный университет» Факультет технологический Кафедра Биология, биологические технологии и ветеринарно-санитарная экспертиза__ наименование кафедры, обеспечивающей проведение практики
ИНДИВИДУАЛЬНОЕ ЗАДАНИЕ
ПЕРЕЧЕНЬ ЗАДАНИЙ, ПОДЛЕЖАЩИХ РАЗРАБОТКЕ НА ПРАКТИКЕ
С заданием ознакомлена (подпись обучающегося) Министерство сельского хозяйства Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Пензенский государственный аграрный университет» Факультет Технологический Кафедра ______________________________________________________________________ наименование кафедры, обеспечивающей проведение практики
Рабочий график (план) __________________________________________________________________ указать вид и тип практики
Содержание практики и планируемые результаты Таблица 1 – Содержание практики
Таблица 2 – Планируемые результаты практики
Отзыв руководителя практики от образовательной организации на отчет о прохождении "Общепрофессиональная практика (биология) Студентка 2 курса группы 20.360301.1з Иноземцева Наталья Геннадьевна Направления подготовки Ветеринарно-санитарная экспертиза прошла _________________________________________________________________________ указать вид и тип практики в объеме ____________з.е. в период с _________________ по_____________________ место прохождения практики________________________________________________ __________________________________________________________________________ В период прохождения практики обучающийся__________________________ подтвердил/не подтвердил сформированность следующих компетенций
Краткая характеристика содержания отчета __________________________________________________________________________________________________________________________________________________________ Общая характеристика соответствия отчета индивидуальному заданию, качество оформления отчета, положительные и отрицательные аспекты отчета Качество выполнения работы в соответствии с индивидуальным заданием __________________________________________________________________ удовлетворительное, хорошее, отличное Руководитель практики _______________ ___________________________ Подпись ФИО, должность Техника безопасности при работе с лабораторными животными Сотрудники лаборатории должны быть защищены от естественных инфекционных болезней животных и от воспроизводимых на них экспериментальных инфекций, возбудители которых патогенны для человека. Наиболее часто встречается среди лабораторных животных такая естественная инфекция, как сальмонеллез. Заразившиеся люди переносят заболевание в гастроинтестинальной или тифоподобной (генерализованной) форме. Опасность для людей представляют также листериоз, псевдотуберкулез, туберкулез, туляремия. Поскольку многие инфекционные болезни животных протекают в бессимптомной персистирующей форме, животных необходимо периодически обследовать. Источником инфицирования людей могут служить экспериментально зараженные животные и их эктопаразиты. Профилактика заражения людей от животных проводится с учетом возможного пути передачи данного возбудителя. Состояние здоровья сотрудников лаборатории находится под медицинским контролем с учетом особенностей инфекции, с возбудителем которой работают сотрудники. При работе в лаборатории с вирусами бешенства, клещевого энцефалита, инфекционного гепатита и некоторыми другими инфекциями сотрудникам делают прививки против этих болезней. В случае необходимости проводят экстренную профилактику специфическим иммуноглобулином или сывороткой реконвалесцентов. Одновременно осуществляют весь комплекс противоэпидемических мероприятий, необходимый при данной инфекционной болезни. ВИДЫ ЛАБОРАТОРНЫХ ЖИВОТНЫХ Для большинства микробов с учетом их тропизма определяется круг восприимчивых животных и их возраст. В настоящее время доказано, что более восприимчивы молодые животные. Наиболее часто в микробиологических исследованиях находят применение белые мыши, крысы, морские свинки, хорьки, кролики, обезьяны, собаки, кошки. Иногда для опытов берут кур, уток, голубей, а также крупных животных - свиней, телят, овец, лошадей. Мыши. Используют преимущественно белых мышей инбредных линий весом 8 - 18 г. При работе с некоторыми микробами для опытов пригодны только новорожденные животные. Крысы. В качестве лабораторной модели применяют исключительно альбиносов инбредных линий. Крысы более устойчивы к вирусу, нежели мыши. Новорожденные крысята отбираются для исследований вирусов опухолей. Хомячки. Для изучения вирусов берут сирийского золотистого хомячка инбредной линии. При работе с микробами опухолей используют новорожденных хомячков. Морские свинки. В вирусологических исследованиях применяются гладкошерстные морские свинки, полученные посредством близкородственного разведения. Вес морских свинок, предназначенных для опыта, не должен превышать 250 г. Хорьки используются в опыте сравнительно редко из-за устойчивости ко многим вирусам, вызывающим заболевания человека и животных. Кролики находят широкое применение для постановки биопробы, а также при получении гипериммунных сывороток. Используют кроликов различного возраста и веса. Собаки. Специальных линий лабораторных собак нет. Рекомендуется использовать собак любой породы средней величины, крепких, спокойного нрава. Обезьяны. В микробиологической, медицинской практике для опытов берут индийских макак-резус, филиппинских макак и африканских мартышек. Куры. Следует использовать чистопородных особей. Возраст куропределяется целью исследований. Для биопробы берут цыплят, в качестведоноров крови - взрослых кур. Утята применяются для - постановки биопробы ввозрасте 1 —10 дней при работе с микробами, вызывающими болезни утят. Лошади - единственная модель при работе с вирусами инфекционной анемии лошадей, энцефаломиелита лошадей. Свиньи. В ветеринарной практике используют подсвинков в возрасте 2,5—5 мес. Молодые свиньи и поросята применяются для биопробы. Телята. При изучении ряда болезней телят используются животныев возрасте от нескольких дней до нескольких месяцев. Для медико-биологических целей крокодилов искусственно выводят в инкубаторах. В неволе крокодилы растут быстрее, чем в природных условиях. Эти животные весьма перспективны для широкого использования их в медико-биологических экспериментах. Гадюк используют для получения иммунных сывороток против змеиных ядов и для приготовления других лекарственных препаратов из яда. Угри интересны тем, что после удаления у них поджелудочной железы не происходит нарушения углеводного обмена Разводимые в аквариумах живородящие (гуппи) и яйцекладущие (медака, золотая рыбка) рыбы представляют собой ценные объекты для изучения разнообразных вопросов физиологии, онкологии, иммунологии, фармакологии и токсикологии. Гуппи используют для изучения тератогенного действия лекарственных веществ и различных химических соединений. Хроматофоры этих рыбок могут быть показателем содержания катехоламинов. Дельфины - млекопитающие отряда китов, Это стадные животные, которые хорошо поддаются дрессировке. Лучше других дельфинов жизнь в неволе (в дельфинариумах) переносят афалины, обитающие в Черном море. В условиях дельфинариумов афалины могут размножаться. Используют дельфинов для изучения поведенческих реакций, выяснения вопросов патогенеза и терапии заболеваний сердечнососудистой системы, язвенной болезни. Mopские ежи используются как объекты исследований в области биохимии, физиологии, фармакологии, токсикологии, молекулярной биологии, генетики, трансплантации органов и тканей. Животные съедобны и в природе их запасы истощаются. Морские звезды. Применяются в качестве объектов научных экспериментов для изучения механизмов сосудистых реакций, регенерации кожи, оценки токсичности веществ. Морской заяц — одна из лучших медико-биологических моделей для выполнения исследований в области нейрофизиологии. Гигантские аксоны осьминогов служат хорошим объектом для изучения механизмов передачи нервных импульсов. Беспозвоночные лабораторные животные. Разнообразные насекомые (мухи, комары, блохи, вши, москиты, тараканы, саранча) и их личинки используются для проведения научных исследований и ведения педагогического процесса в области генетики, фармакологии. Простейшие (инфузории) служат для изучения токсичности химических соединений и лекарственных препаратов, вопросов физиологии, биохимии. В научных целях используют жгутиковых (трихомонад), корненожек (амеб), споровиков (кокцидий), червей (аскарид), шистозом, пиявок, членистоногих (клещей). Содержание и кормление животных в лабораториях Мышей, крыс, хомяков и морских свинок в период опыта рекомендуется содержать в стеклянных банках с крышкой из проволочной сетки или перфорированного листового железа. В качестве подстилки применяют материалы, которые адсорбируют влагу и могут быть использованы животными для постройки гнезда: стружку для мышей, крыс, хомяков, морских свинок, хорьков, кур; опилки для крупных мышей, крыс, хомяков, хорьков, кур; солому для хомяков, морских свинок, кроликов, собак, кур; мякину для мышей, крыс; сено для мышей, крыс, хомяков, хорьков, кур; песок для кур. Следует использовать такую подстилку, которая образует как можно меньше пыли, так как последняя может привести к заболеванию органов дыхания. Любую подстилку необходимо предварительно стерилизовать при 100 °С в течение 30 мин. Помещения для лабораторных животных периодически дезинфицируют, особенно перед размещением новой партии животных. Это относится и к предметам ухода за животными (лопаты, скребки, метелки и др.), которые соприкасаются с навозом и различными отбросами из помещения. После окончания каждого опыта клетки обязательно обрабатывают дезинфицирующими растворами, чему должна предшествовать чистка как клеток, так и помещения. Посуду для корма и воды ежедневно смачивают дезинфицирующим раствором, после чего моют и споласкивают чистой водой. Помещения обрабатывают 1% раствором едкого натра, который используют в течение суток. Дезковрики пропитывают свежим раствором каждые 2 дня. Для дезинфекции предметов ухода, мытья полов и посуды рекомендуется использовать 3% раствор хлорамина, который должен быть применен в течение 2 ч. В виварии необходимо уничтожать вредителей: мух, комаров, блох, власоедов, клещей, вшей, муравьев, мышей, крыс. Лабораторных животных размещают так, чтобы, с одной стороны, было обеспечено функционирование всех систем организма в пределах физиологической нормы, с другой – исключено взаимное перезаражение и распространение инфекции за пределы вивария. Животных содержат в виварии с учетом их физиологической потребности в освещенности и температуре. Так, мышам, крысам нужны полумрак и температура воздуха около 20 °С, морским свинкам, кроликам и курам – дневной свет и температура в пределах 16–23, 14–18 и не ниже 0°С соответственно. Плотность посадки должна составлять примерно 1 г массы лабораторных животных на 1 см2 дна клетки. Животных обеспечивают регулярным и полноценным кормлением и постоянно питьевой водой. Если виварий один, зараженных животных содержат изолированно от здоровых и с последних начинают уборку помещения и кормление. Для ухода за зараженными животными используют отдельный инвентарь и кормушки. Лучше иметь два вивария: для содержания здоровых и зараженных животных. Обслуживающий персонал при работе в виварии пользуется спецодеждой: халатом, резиновыми перчатками, фартуком, непромокаемой обувью. В виварии ежедневно дезинфицируют инвентарь и проводят влажную уборку с применением дезинфицирующих веществ. По окончании эксперимента клетки дезинфицируют, погибших животных обезвреживают сжиганием в печах или автоклавированием. В группу для проведения опыта подбирают животных с одинаковыми показателями массы, температуры, состава крови и т. д. От этого в значительной степени зависит успех выделения, титрования и пассирования вируса. При этом учитывают восприимчивость животных к различным вирусам. Отобранных животных метят, распределяют по банкам или клеткам, отмечают дату постановки опыта, его номер, заражающую или профилактическую дозу препарата и, если необходимо, как мечены животные. Последнее важно, когда в одной банке или клетке находятся животные нескольких групп. Для содержания лабораторных животных необходим виварий, в состав которого входят: основные помещения для животных (боксы), кухня с холодильником, кладовая для хранения запасов корма, моечная, вскрывочная, гардероб и санитарные помещения для обслуживающего персонала, карантинное отделение, где содержат всех вновь поступивших животных, выясняя их пригодность для опытов. Виварий должен быть изолирован от остальных рабочих помещений и лабораторий, иметь самостоятельный выход. Инфицированные животные должны находиться в отдельных помещениях, надежно изолированных от имеющихся в виварии племенных, резервных и других животных. При виварии должны быть предусмотрены устройства для дезинфекции навоза и сточных вод. Все помещения должны быть защищены от доступа насекомых и грызунов. Боксы для животных должны иметь хорошую вентиляцию, легко дезинфицироваться, быть надежно изолированными друг от друга. В боксах целесообразно иметь термометр и гигрометр для поддержания оптимальных параметров. Для содержания лабораторных животных предложено огромное количество клеток самых разнообразных конструкций, сделанных из дерева, стекла, алюминия, оцинкованного листового железа. Деревянные клетки для содержания мышей, морских свинок, кроликов теплые, но неудобные для дезинфекции, применялись в основном в прошлом. Стеклянные банки с крышкой из проволочной сетки для содержания мышей, крыс, хомячков, морских свинок, очень легко очищаются и дезинфицируются. Однако при длительном опыте на дне банк и накапливается большое количество углекислого газа, отрицательно влияющего на организм. Металлические клетки для содержания мышей, крыс, хомяков, морских свинок, хорьков, собак, обезьян удобны для дезинфекции, но очень холодные, могут быть использованы только в хорошо отапливаемом помещении. Часто в металлических клетках разных конструкций, а также в специальных вольерах содержат обезьян. В качестве подстилки для клеток используют стружку (мыши, крысы, морские свинки, хорьки, куры), крупные опилки (мыши, крысы, хомячки, хорьки, обезьяны), солому (хомячки, кролики, собаки), мякину (мыши, крысы), сено (мыши, крысы, хомячки, хорьки, куры), песок (куры). Подстилочный материал перед применением стерилизуется в течение 30 мин при 100°С.Кормление лабораторных животных производится по рационам, которые составляются в соответствии с суточными нормами белков, углеводов, витаминов, минеральных солей, микроэлементов, установленными для различных видов и возрастов. К недостатку витаминов особенно чувствительны крысы. ДЕЗИНФЕКЦИЯ ПОМЕЩЕНИЙ И БОКСОВ Помещения, боксы, клетки, в которых содержатся лабораторные животные, чистят и моют, а затем дезинфицируют. Дезинфекция бывает профилактическая (перед размещением новых животных), текущая (через определенные промежутки времени),заключительная (после окончания опыта). В боксах с инфицированными животными вначале проводится дезинфекция подстилки и клеток, а затем их уборка. Метка лабораторных животных М 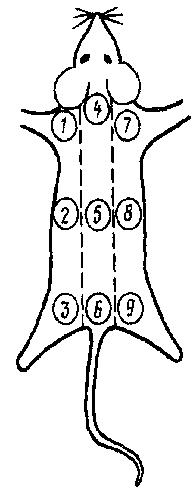 етка является непременным условием использования животных в эксперименте. На клетке, в которой помещены зараженные животные, укрепляют бирку с надписью, отражающей использованный для заражения вирус (или номер экспертизы исследуемого патологического материала), количество зараженных животных, дату заражения и, если надо, другие сведения. етка является непременным условием использования животных в эксперименте. На клетке, в которой помещены зараженные животные, укрепляют бирку с надписью, отражающей использованный для заражения вирус (или номер экспертизы исследуемого патологического материала), количество зараженных животных, дату заражения и, если надо, другие сведения.Для животных разных видов применяют разные способы индивидуальной метки. Для крупных животных и кур используют металлические бирки со штампованным номером. Бирки надевают на корень уха (кроликам), вставляют в ушную раковину по типу серьги (морским свинкам), надевают на ногу – окольцовывают (курам). При использовании в эксперименте небольшой группы животных и при непродолжительном сроке его можно выстригать шерсть знаками на спине, бедрах (у кроликов). Морских свинок можно различать по окраске, которую регистрируют в рабочем журнале. Метка белых мышей, белых крыс может быть проведена ампутацией отдельных пальцев на передних или задних конечностях, каждый из которых соответствует тому или другому порядковому номеру: на передних лапах – единицам, на задних – десяткам. Однако чаще пользуются методом нанесения цветных пятен на непигментированную шерсть. Насыщенный раствор пикриновой кислоты лучше других красителей (растворов фуксина, бриллиантовой зелени) удерживается на шерсти и коже животных. Цветные метки ставятся в местах, соответствующих определенному порядковому номеру животного. Так, если тело животного мысленно разделить на три продольные части (левый бок, спина, правый бок), то нанесение цветных пятен начинают с левого верхнего угла, т. е. лопатки, и это будет соответствовать 1 (рис. 8). Тогда, двигаясь назад, левый бок соответствует 2, а левое бедро – 3, далее затылок – 4, спина – 5, область репицы – 6, правое плечо – 7, правый бок – 8, правое бедро – 9. Используя два цвета красителей, можно дать обозначения одним из них – единиц, другим – десятков. ЗАРАЖЕНИЕ ЛАБОРАТОРНЫХ ЖИВОТНЫХ ИССЛЕДУЕМЫМ МАТЕРИАЛОМ Для большинства микробов установлен наиболее эффективный методинокуляции их лабораторным животным. При этом учитывается, в первую очередь, вид и тропизм микробов. Ниже приводятся методы заражения лабораторных животных, наиболее часто используемые в практике оральное заражение (per os). Для заражения исследуемый материал добавляют к обычному корму или питьевой воде, которые дают животным после 24 ч голодания. Реже заражение проводят через носоглоточный зонд (мышам, курам) или эластичный катетер (морским свинкам, кроликам). Заражение под кожу. Участок кожи в области спины, брюшка или паха освобождают от волосяного покрова, смазывают спиртовым раствором йода, оттягивают пальцами и в основание образовавшейся складки вводят иглой исследуемый материал: мышам - 0,1 - 0,3 мл, морским свинкам - 1- 2мл, кроликам - 2 - 5 мл. Место инъекции прижимают кусочком ваты, смоченным дезинфицирующим раствором. Внутримышечное заражение. Для этого способа выбирают место, где лучше всего развит мышечный слой, - мышцы бедра, груди и т. д. После обработки кожи на месте введения исследуемый материал вводят в мышцу примерно в тех дозах, что и при подкожном заражении. Внутрикожное заражение. Кожу тщательно освобождают от волос и протирают спиртом. Заражение проводят через тонкую острую иглу, которую вводят почти параллельно поверхности в толщу кожи так, чтобы конец ее просвечивал через эпидермис. Легким нажатием на поршень шприца инокулируют 0,1—0,2 мл исследуемого материала. При правильном введении на месте инъекции образуется припухлость. Заражение в брюшную полость. При этом способе за сутки дозаражения животных не кормят. Перед инъекцией кожу освобождают от волос, обрабатывают спиртом и 2% настойкой йода. Животное фиксируют вниз головой, чтобы органы брюшной полости сместились вниз к диафрагмеи не были травмированы во время инъекции. Для введения используют короткие тупые иглы. Место прокола находится между пупком и симфизом в стороне от средней линии, а у кур - между верхушкой грудной кости и клоакой, на половине высоты. Момент проникновения иглы в брюшную полость контролируют по исчезновению сопротивления брюшной стенки. Инокулируют материал в дозах: мышам - до 1 мл, морским свинкам - до 3мл, кроликам и курам - до 5 мл. Внутривенное заражение. Исследуемый материал мышам и крысам вводят в хвостовую вену, кроликам - в краевую вену уха, птицам - в подкрыльцевую вену. После общепринятой обработки место инъекции протирают ксилолом или погружают хвост в теплую воду (для увеличения просвета сосудов). Иглу вводят под острым углом в вену нижней трети хвоста (у мышей и крыс) или в краевую вену уха (у кролика). Если при инокуляции материала не ощущается сопротивления и вена на всем протяжении бледнеет, инъекция сделана правильно. Вену прижимают ниже места укола, извлекают иглу, место укола прижимают сухой стерильной ватой. Доза материала для внутривенного введения мышам - до 1 мл, кроликам и птице - до 5 мл. Интракардиальное введение (в сердце). Лабораторных животных тщательно фиксируют в положении на спине, кур - на боку. Определяют место инъекции, которое находится у мышей на расстоянии 0,5 см над верхушечным толчком сердца непосредственно у края грудной кости, у морской свинки - во втором межреберном пространстве на расстоянии 2 мм от края грудной кости, у курицы - в третьем-четвертом межреберном пространстве на линии плечелопаточного сустава и каудального конца грудной кости. Иглу вводят перпендикулярно поверхности тела до тех пор, пока не будет ощущаться пульсация сердца и в просвете иглы не появится кровь. Материал, предназначенный для внутривенного и внутрисердечного введения, не должен содержать крупных частиц и пузырьков воздуха, которые могут вызвать эмболию и внезапную гибель животного. Инъекцию проводят медленно, не превышая дозы: мышам - 0,5 мл, морским свинкам -1-2 мл, курам - 3 мл. Заражение через нос. Способ чаще всего используют для заражения мышей микробами, вызывающими респираторные заболевания. Введение материала производят под глубоким эфирным наркозом: мышей помещают в «плотно закрывающуюся банку, на дне которой находится кусочек смоченной эфиром ваты. Как только животные засыпают, их вынимают из банки и пастеровской пипеткой каплями вносят материал в нос. При правильной даче наркоза животные глубоко вдыхают инфицированный материал, который попадает прямо в легкие. При этом методе заражения необходимо избегать разбрызгивания инфицированного материала. Заражение в мозг. Интрацеребральную инъекцию у большинства лабораторных животных производят сбоку от средней линии, в серединемежду верхним краем глазной впадины и наружным слуховым проходом. Морских свинок, кроликов, белых мышей заражают путем прокола кости черепа иглой. Кожу темени смазывают 2% раствором йода и производят укол на глубину 2 - 5 мм. Испытуемый материал необходимо вводить медленно, чтобы не вызывать резкого повышения внутричерепного давления и предупредить обратный выход вводимого материала. У крупных животных (собак, свиней) производят трепанацию черепа. В образовавшееся отверстие под твердую мозговую оболочку вводят иглу и легким нажатием поршня шприца инокулируют 0,2 - 0,3 мл материала. Помимо перечисленных, широко распространенных способов, подопытных животных иногда заражают введением патологического материала на роговицу, в семенники, периферические нервы и др.Зараженных животных помещают в изолированные помещения вивария и устанавливают за ними постоянное наблюдение. Учитывают отклонения в их поведении, появление специфических признаков заболевания, проводят взвешивание и измерение температуры тела. Результаты наблюдений регистрируют в специальном журнале. Следует учитывать, что некоторые микробы вызывают лишь незначительные клинические симптомы, которые можно не заметить. При первичном заражении животные могут не заболеть, поэтому иногда «возникает необходимость провести 2 - 3 последовательных «слепых пассажа». Для этого через 5 - 7 дней после заражения животных убивают, взятым от них материалом заражают следующую партию животных, от которых вновь отбирают материал для очередного заражения, и так 2 - 3раза. Учитывая возможность бессимптомной инфекции, индикацию микроба в патологическом материале проводят дополнительно по серологическимреакциям, а также исследуют на питательных средах. Вскрытие зараженных животных Всех погибших или убитых после опыта животных необходимо вскрыть. Вскрытие проводится в специальном боксе, соблюдая все правила безопасности. Вскрытие животных производится стерильными инструментами сразу же после гибели, чтобы предотвратить микробную контаминацию. Животных фиксируют на спине, привязывая конечности к гвоздям, вбитым в доску по углам. Смачивают все тело дезинфицирующим раствором или спиртом, делают разрез кожи по средней линии от шеи до лобка, отпрепарировывают кожу с двух боков и убирают ее в стороны. Вначале производят вскрытие грудной полости. Для этого большими ножницами в над диафрагмальной области надрезают мышцы, вырезают грудную кость вместе с прилегающими отрезками ребер и отодвигают вверх, меняют инструменты, извлекают обнаженные органы для исследований. Для вскрытия брюшной полости с помощью стерильных ножниц открывают под диафрагмальную область, отделяя стенку живота от реберной дуги. Кишечник оттягивают пинцетом в сторону до тех пор, пока не обнаружат почки, печень и селезенку. Меняют инструменты, извлекают органы для исследований и помещают их стерильный контейнер. В случае необходимости вскрывают ротовую, носовую полости, черепную коробку и отбирают для исследований различные ткани. Трупы лабораторных животных после вскрытия сжигают. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
