химия. РК 2 ОПИ-22вв Кулушев Б.М.. Рубежный контроль 2
 Скачать 49.24 Kb. Скачать 49.24 Kb.
|
|
Рубежный контроль 2 Химическое равновесие – это состояние системы, когда ….. Химическое равновесие — состояние системы, при котором скорости прямой и обратной реакции равны. Такое равновесие является динамическим, т. е. химическая реакция продолжает идти в прямом и обратном направлении, но внешние изменения в системе не наблюдаются. Поскольку, согласно определению, в состоянии химического равновесия скорости прямой и обратной реакций равны, такая характеристика, как концентрация веществ, остается неизменной. В какую сторону сместится равновесие в системе 2NO + O2 ↔ 2NO2 + Q а) если повысить давление и б) если повысить температуру? при повышении температуры равновесие смещается в сторону эндотермической реакции, т.е. влево при понижении давления равновесие смещается в сторону увеличения объема, т.е. влево Процентная концентрация вещества в растворе показывает: Массовая доля (в процентах) или процентная концентрация (ω) – показывает число грамм растворенного вещества, содержащее-ся в 100 граммах раствора. Молярная концентрация раствора показывает…? Молярная концентрация раствора показывает число молей растворенного вещества в одном литре раствора. Число молей вещества определяется по формуле: n = m/ M, где m – масса растворенного вещества, в нашем примере 0,2 г, М – молярная масса вещества, М (NaOH) = 40 г/моль. Если сравнить температуры кипения раствора и чистого растворителя, то температура кипения раствора…. Например, вода под давлением 101,3 кПа кипит при 100° С потому, что при этой температуре давление водяного пара как раз равно 101,3 кПа. Если же растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. Чтобы довести давление пара полученного раствора до 101,3 кПа, нужно нагреть раствор выше 100° С. Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя. Если сравнить температуры замерзания раствора и чистого растворителя, то температура замерзания раствора…. Раствор закипает при более высокой температуре, так как концентрация молекул растворителя в нём всегда ниже, чем в чистом растворителе, и давление насыщенного пара раствора достигает атмосферного при более высокой температуре. Температура замерзания (кристализации) раствора ниже температуры замерзания чистого растворителя. Это обусловлено более низким давлением пара растворителя над раствором, чем над растворителем. Электролиты – это ….. Электролит - это среда, содержащая ионы, которая является электропроводящей благодаря движению этих ионов, но не проводящей электроны. Сюда входит большинство растворимых солей, кислот и оснований, растворенных в полярном растворителе, таком как вода. При растворении вещество распадается на катионы и анионы, которые равномерно распределяются по всему растворителю. Окислители – это атомы, молекулы или ионы, которые …. Окислитель – это атом, молекула или ион, которые прини-мают электроны, сами они при этом восстанавливаются. В про-цессе восстановления у атома окислителя степень окисления понижается. Например, 2Na0 + Cl20 → 2Na+Cl-Na0 – e → Na+ 1 2 процесс окисления (Na0 – восстановитель). Восстановители – это атомы, молекулы или ионы, которые ….. Восстановителями называются атомы, ионы или молекулы, отдающие электроны. Типичные металлы проявляют восстановительные свойства. К восстановителям относится также водород. Отдавая электроны, восстановители окисляются. Происходит процесс окисления. При этом степень окисления повышается. Ионы металлов и неметаллов могут принимать или отдавать электроны в зависимости от их степени окисления (заряда иона). Окисление – это процесс, при котором ….. При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов. В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул Восстановление – это процесс, при котором ….. Окислительно-восстановительные реакции (ОВР) — это встречно-параллельные химические реакции, которые протекают с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; Расставьте коэффициенты в уравнениях методом электронного баланса: Mg + HNO3→ Mg(NO3)2 + N2O + H2O, K2Cr2O7 + HI + H2SO4 →Cr2(SO4)3 + I2 + K2SO4 + H2O 4 Mg -2e--->Mg(+2) восстановитель 2 N(+5)+4e-->N(+1) окислитель 4 Mg + 10 HNO3 = 4 Mg(NO3)2 + 5H2O + N2O При электролизе растворов электролитов на катоде в чистом виде могут выделяться.... Электролиз расплавов рассмотрим на примере хлорида натрия (рис. 1). В расплаве хлорид натрия диссоциирует, образуя катионы и анионы хлора : На катоде всегда происходит процесс восстановления, а на аноде — процесс окисления. Таким образом, при электролизе расплава хлорида натрия на катоде происходит процесс восстановления катионов натрия, а на аноде — процесс окисления анионов хлора: Катодная реакция: || Анодная реакция: || Суммарный процесс: — расплав 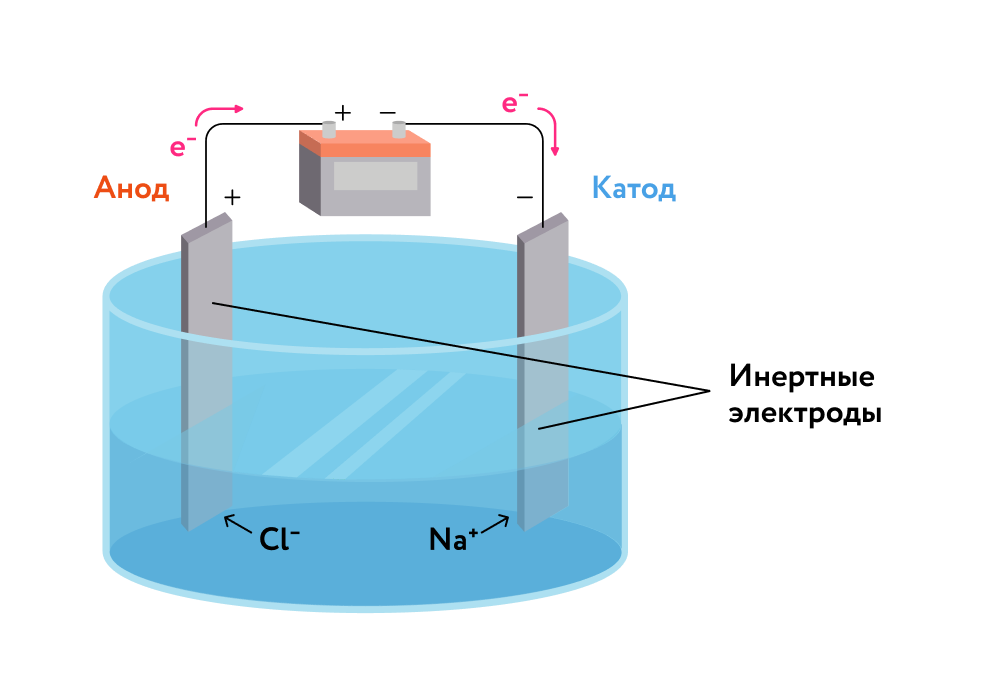 Рис. 1. Электролиз расплава хлорида натрия Электролиз расплавов солей (чаще всего хлоридов) используется в промышленности для получения щелочных и щёлочноземельных металлов. В чем физический смысл законов Фарадея? Физический смысл закона Фарадея заключается в том, что изменяющееся во времени магнитное поле порождает вихревое электрическое поле. А именно, при изменении во времени магнитного потока (Ф), пронизывающего поверхность, ограниченную замкнутым неподвижным проводником, в этом проводнике индуцируется ЭДС (ε i), равная по величине и противоположная по знаку скорости изменения этого потока: Это соотношение называют также «правилом потока». |
