Метод ВЖК и ультрацентрифугирование. Жайсанкулова У.Б. СРМ 3 ОБС. Самостоятельная работа обучающегося по дисциплине Отраслевая биотехнология и селекция (наименование дисциплины)
 Скачать 61.67 Kb. Скачать 61.67 Kb.
|
|
АО «АЛМАТИНСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ» Кафедра «Пищевая биотехнология» Самостоятельная работа обучающегося по дисциплине Отраслевая биотехнология и селекция (наименование дисциплины) Метод ВЖК и ультрацентрифугирование (наименование темы работы) Выполнил(а): Жайсанкулова Улжан Боранбаевна 1 курса, научно-педагогическое направление Специальности/ОП: 7M05101- Биотехнология Проверил(а): Габдуллина Ельзада Жумагалиевна Ассоциированный профессор, доктор биологических наук, доцент (должность, ученая степень, звание) АЛМАТЫ, 2020 ПЛАН Основные понятия и классификация методов жидкостной хроматографии Аппаратура для жидкостной хроматографии Сущность ВЭЖХ Применение ВЭЖХ Ультрацентрифугирование ВВЕДЕНИЕ Хроматографические методы часто оказываются незаменимыми для идентификации и количественного определения органических веществ со сходной структурой. При этом наиболее широко используемыми для рутинных анализов загрязнителей окружающей среды являются газовая и высокоэффективная жидкостная хроматография. Газохроматографический анализ органических загрязнителей в питьевой и сточных водах сначала основывался на использовании насадочных колонок, позднее распространение получили и кварцевые капиллярные колонки. Внутренний диаметр капиллярных колонок составляет обычно 0,20-0,75 мм, длина - 30-105 м. Оптимальные результаты при анализе загрязнителей в воде достигаются чаще всего при использовании капиллярных колонок с различной толщиной пленки из метилфенилсиликонов с содержанием фенильных групп 5 и 50%. Уязвимым местом хроматографических методик с использованием капиллярных колонок часто становится система ввода пробы. Системы ввода пробы можно подразделить на две группы: универсальные и селективные. К универсальным относятся системы ввода с делением и без деления потока, “холодный” ввод в колонку и испарение при программировании температуры. При селективном вводе используют продувку с промежуточным улавливанием в ловушке, парофазный анализ и т.д. При использовании универсальных систем ввода в колонку поступает вся проба полностью, при селективной инжекции вводится только определенная фракция. Результаты, получаемые при селективном вводе, являются существенно более точными, поскольку попавшая в колонку фракция содержит только летучие вещества, и техника при этом может быть полностью автоматизирована. Основные понятия и классификация методов жидкостной хроматографии Высокоэффективная жидкостная хроматография (ВЭЖХ) является идеальным методом для определения большого числа термически неустойчивых соединений, которые не могут быть проанализированы с помощью газовой хроматографии. Объектами анализа методом жидкостной хроматографии в настоящее время часто становятся современные агрохимикаты, в число которых входят метилкарбонаты и фосфорорганические инсектициды, другие нелетучие вещества. Высокоэффективная жидкостная хроматография получает все большее распространение среди других методов, применяемых в мониторинге окружающей среды, еще и потому, что имеет блестящие перспективы в плане автоматизации пробоподготовки. Жидкостную хроматографию подразделяют на несколько классов в зависимости от типа носителя неподвижной фазы. Простое аппаратурное оформление бумажной и тонкослойной хроматографий обусловили широкое использование этих методов в аналитической практике. Однако, большие возможности колоночной жидкостной хроматографии стимулировали совершенствование оборудования для этого классического метода и привели к быстрому внедрению ВЭЖХ. Пропускание элюента через колонку под высоким давлением позволило резко увеличить скорость анализа и существенно повысить эффективность разделения за счет использования мелкодисперсного сорбента. Метод ВЭЖХ в настоящее время позволяет выделять, количественно и качественно анализировать сложные смеси органических соединений. Распределительная хроматография. При распределительном варианте жидкостной хроматографии разделение смеси веществ осуществляется за счет различия их коэффициентов распределения между двумя несмешивающимися фазами - элюентом (подвижной фазой) и фазой, находящейся на сорбенте (неподвижная фаза). При нормально-фазовом варианте распределительной жидкостной хроматографии используются неполярный элюент и полярные группы, привитые к поверхности сорбента (чаще всего силикагеля). В качестве модификаторов поверхности силикагеля (привитых фаз) используются замещенные алкилхлорсиланы, содержащие полярные группы, такие как нитрильная, аминогруппа и т. д. (рис. 2). Применение привитых фаз позволяет тонко управлять сорбционными свойствами поверхности неподвижной фазы и добиваться высокой эффективности разделения. Обращенно-фазовая жидкостная хроматография основана на распределении компонентов смеси между полярным элюентом и неполярными группами (длинными алкильными цепочками), привитыми к поверхности сорбента (рис. 1). Рис. 3. Распределительная хроматография с привитой фазой (обращенно-фазный вариант). 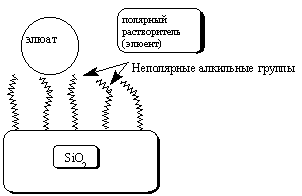 Менее широко используется вариант жидкостной хроматографии с нанесенными фазами, когда жидкая неподвижная фаза наносится на неподвижный носитель. Эксклюзивная (гельпроникающая) хроматография представляет собой вариант жидкостной хроматографии, в котором разделение веществ происходит за счет распределения молекул между растворителем, находящимся в порах сорбента и растворителем, протекающим между его частицами. Аффинная хроматография основана на специфических взаимодействиях разделяемых белков (антител) с привитыми на поверхности сорбента (синтетической смолы) веществами (антигенов), избирательно образующими с белками комплексы (коньюгаты). Ионообменная, ион-парная, лигандообменная хроматографии применяются в основном в неорганическом анализе. Основные параметры хроматографического разделения. Основными параметрами хроматографического разделения являются удерживаемый объем и время удерживания компонента смеси (рис. 4). Время удерживания tR - это время, прошедшее от момента ввода пробы в колонку до выхода максимума соответствующего пика. Умножив время удерживания на объемную скорость элюента F VR = tR . F Исправленое время удерживания - время, прошедшее с момента появления максимума пика несорбируемого компонента до пика соответствующего соединения: tR' = tR - t0; Приведенный или исправленный объем удерживания - это объем удерживания с поправкой на мертвый объем колонки V0, т. е. на объем удерживания несорбируемого компонента: VR' = VR - V0; Характеристикой удерживания является также коэффициент емкости k', определяемый как отношение массы вещества в неподвижной фазе к массе вещества в подвижной фазе: k' = mн / mп; Величину k' легко определить по хроматограмме: 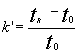 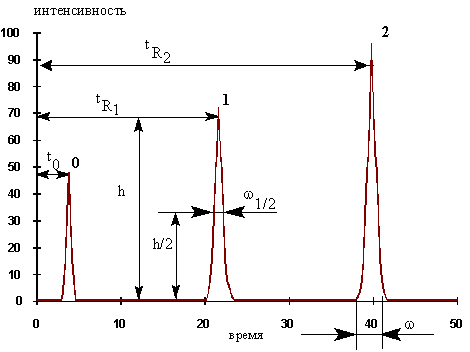 Важнейшими параметрами хроматографического разделения являются его эффективность и селективность. Эффективность колонки, измеряемая высотой теоретических тарелок (ВЭТТ) и обратно пропорциональная их числу (N) тем выше, чем уже пик вещества, выходящего при том же времени удерживания. Значение эффективности может быть вычислено по хроматограмме по следующей формуле: N = 5.54 . (tR / где tR - время удерживания, w 1/2 - ширина пика на половине высоты Зная число теоретических тарелок, приходящееся на колонку, длину колонки L и средний диаметр зерна сорбента dc, легко получить значения высоты, эквивалентной теоретической тарелке (ВЭТТ), и приведенной высоты (ПВЭТТ): ВЭТТ = L/N ПВЭТТ = ВЭТТ/dc Эти характеристики позволяют сравнивать эффективности колонок различных типов, оценивать качество сорбента и качество заполнения колонок. Селективность разделения двух веществ 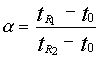 При рассмотрении разделения смеси двух компонентов важным параметром служит также степень разделения RS: 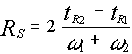 ; ;Пики считаются разрешенными, если величина RS больше или равна 1.5. Основные хроматографические параметры связывает следующее уравнение для разрешения: 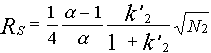 ; ;Факторами, определяющими селективность разделения, являются: 1) химическая природа сорбента; 2) состав растворителя и его модификаторов; 3) химическая структура и свойства компонентов разделяемой смеси; 4) температура колонки Аппаратура для жидкостной хроматографии В современной жидкостной хроматографии используют приборы различной степени сложности - от наиболее простых систем, до хроматографов высокого класса, снабженных различными дополнительными устройствами. На рис. 4. представлена блок-схема жидкостного хроматографа, содержащая минимально необходимый набор составных частей, в том или ином виде, присутствующих в любой хроматографической системе. 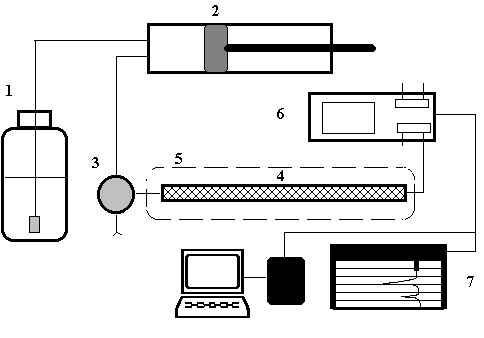 Рис. 2. Блок-схема жидкостного хроматографа. Насос (2) предназначен для создания постоянного потока растворителя. Его конструкция определяется, прежде всего, рабочим давлением в системе. Для работы в диапазоне 10-500 МПа используются насосы плунжерного (шприцевого), либо пистонного типов. Недостатком первых является необходимость периодических остановок для заполнения элюентом, а вторых - большая сложность конструкции и, как следствие, высокая цена. Для простых систем с невысокими рабочими давлениями 1-5 МПа с успехом применяют недорогие перистальтические насосы, но так как при этом трудно добиться постоянства давления и скорости потока, их использование ограничено препаративными задачами. Инжектор (3) обеспечивает ввод пробы смеси разделяемых компонентов в колонку с достаточно высокой воспроизводимостью. Простые системы ввода пробы - "stop-flow" требуют остановки насоса и, поэтому, менее удобны, чем петлевые дозаторы, разработанные фирмой Reodyne. Колонки (4) для ВЭЖХ представляют собой толстостенные трубки из нержавеющей стали, способные выдержать высокое давление. Большую роль играет плотность и равномерность набивки колонки сорбентом. Для жидкостной хроматографии низкого давления с успехом используют толстостенные стеклянные колонки. Постоянство температуры обеспечивается термостатом (5). Детекторы (6) для жидкостной хроматографии имеют проточную кювету, в которой происходит непрерывное измерение какого-либо свойства протекающего элюента. Наиболее популярными типами детекторов общего назначения являются рефрактометры, измеряющие показатель преломления, и спектрофотометрические детекторы, определяющие оптическую плотность растворителя на фиксированной длине волны (как правило, в ультрафиолетовой области). К достоинствам рефрактометров (и недостаткам спектрофотометров) следует отнести низкую чувствительность к типу определяемого соединения, которое может и не содержать хромофорных групп. С другой стороны, применение рефрактометров ограничено изократическими системами (с постоянным составом элюента), так что использование градиента растворителей в этом случае невозможно. Колонки для ВЭЖХ, которые чаще всего используют в анализах загрязнителей окружающей среды, имеют длину 25 см и внутренний диаметр 4,6 мм, заполняются они сферическими частицами силикагеля размером 5-10 мкм с привитыми октадецильными группами. В последние годы появились колонки с меньшим внутренним диаметром, заполненными частицами меньшего размера. Использование таких колонок приводит к уменьшению расхода растворителей и продолжительности анализа, увеличению чувствительности и эффективности разделения, а также облегчает проблему подключения колонок к спектральным детекторам. Колонки с внутренним диаметром 3,1 мм снабжают предохранительным картриджем (форколонкой) для увеличения срока службы и улучшения воспроизводимости анализов. В качестве детекторов в современных приборах для ВЭЖХ используются обычно УФ-детектор на диодной матрице, флуоресцентный и электрохимический. Следует иметь в виду, что в практической работе разделение часто протекает не по одному, а по нескольким механизмам одновременно. Так, эксклюзионное разделение бывает осложнено адсорбционными эффектами, адсорбционное — распределительными, и наоборот. При этом чем больше различие веществ в пробе по степени ионизации, основности или кислотности, по молекулярной массе, поляризуемости и другим параметрам, тем больше вероятность проявления другого механизма разделения для таких веществ. На практике, наибольшее распространение получила «обращённофазовая» (распределительная) хроматография, в которой неподвижная фаза не полярна, а подвижная полярна (т. е. обратна «прямофазной» хроматографии). В большинстве лабораторий мира группу из 16 приоритетных ПАУ анализируют методами ВЭЖХ или ХМС. Сущность ВЭЖХ В высокоэффективной жидкостной хроматографии (ВЭЖХ) характер происходящих процессов в хроматографической колонке, в общем идентичен с процессами в газовой хроматографии. Отличие состоит лишь в применении в качестве неподвижной фазы жидкости. В связи с высокой плотностью жидких подвижных фаз и большим сопротивлением колонок газовая и жидкостная хроматография сильно различаются по аппаратурному оформлению. В ВЭЖХ в качестве подвижных фаз обычно используют чистые растворители или их смеси. Для создания потока чистого растворителя (или смесей растворителей), называемого в жидкостной хроматографии элюентом, используются насосы, входящие в гидравлическую систему хроматографа. Адсорбционная хроматография осуществляется в результате взаимодействия вещества с адсорбентами, такими как силикагель или оксид алюминия, имеющими на поверхности активные центры. Различие в способности к взаимодействию с адсорбционными центрами разных молекул пробы приводит к их разделению на зоны в процессе движения с подвижной фазой по колонке. Достигаемое при этом разделение зон компонентов зависит от взаимодействия, как с растворителем, так и с адсорбентом. Наибольшее применение в ВЭЖХ находят адсорбенты из силикагеля с разным объемом, поверхностью и диаметром пор. Значительно реже используют оксид алюминия и другие адсорбенты. Основная причина этого: недостаточная механическая прочность, не позволяющая упаковывать и использовать при повышенных давлениях, характерных для ВЭЖХ; силикагель по сравнению с оксидом алюминия обладает более широким диапазоном пористости, поверхности и диаметра пор; значительно большая каталитическая активность оксида алюминия приводит к искажению результатов анализа вследствие разложения компонентов пробы либо их необратимой хемосорбции. Детекторы для ВЭЖХ Высокоэффективная жидкостная хроматография (ВЭЖХ) используется для детектирования полярных нелетучих веществ, которые по каким-либо причинам не могут быть переведены в форму удобную для газовой хроматографии, даже в виде производных. К таким веществам, в частности, относят сульфоновые кислоты, водорастворимые красители и некоторые пестициды, например производные фенил - мочевины. Детекторы: УФ - детектор на диодной матрице. «Матрица» фотодиодов (их более двухсот) постоянно регистрирует сигналы в УФ- и видимой области спектра, обеспечивая таким образом запись УФ-В-спектров в режиме сканирования. Это позволяет непрерывно снимать при высокой чувствительности неискаженные спектры быстро проходящих через специальную ячейку компонентов. По сравнению с детектированием на одной длине волны, которое не дает информации о «чистоте» пика, возможности сравнения полных спектров диодной матрицы обеспечивают получение результата идентификации с гораздо большей степенью достоверности. Флуоресцентный детектор. Большая популярность флуоресцентных детекторов объясняется очень высокой селективностью и чувствительностью, и тем фактором, что многие загрязнители окружающей среды флуоресцируют (например, полиароматические углеводороды). Электрохимический детектор используются для детектирования веществ, которые легко окисляются или восстанавливаются: фенолы, меркаптаны, амины, ароматические нитро- и галогенпроизводные, альдегиды кетоны, бензидины. Хроматографическое разделение смеси на колонке вследствие медлен-ного продвижения ПФ занимает много времени. Для ускорения процесса хроматографирование проводят под давлением. Этот метод называют вы-сокоэффективной жидкостной хроматографией (ВЖХ) Модернизация аппаратуры, применяемой в классической жидкостной колоночной хроматографии, сделала ее одним из перспективных и совре-менных методов анализа. Высокоэффективная жидкостная хроматография является удобным способом разделения, препаративного выделения и про-ведения качественного и количественного анализа нелетучих термола-бильных соединений как с малой, так с большой молекулярной массой. В зависимости от типа применяемого сорбента в данном методе используют 2 варианта хроматографирования: на полярном сорбенте с использованием неполярного элюента (вариант прямой фазы) и на неполярном сорбенте с использованием полярного элюента - так называемая обращенно-фазовая высокоэффективная жидкостная хроматография (ОфВЖХ). При переходе элюента к элюенту равновесие в условиях ОфВЖХ устанавливается во много раз быстрее, чем в условиях полярных сорбентов и неводных ПФ. Вследствие этого, а также удобства работы с водными и водно-спиртовыми элюентами, ОфВЖХ получила в настоящее время большую популярность. Большинство анализов при помощи ВЖХ проводят именно этим методом. Детекторы. Регистрация выхода из колонки отдельного компонента производится с помощью детектора. Для регистрации можно использовать изменение любого аналитического сигнала, идущего от подвижной фазы и связанного с природой и количеством компонента смеси. В жидкостной хроматографии используют такие аналитические сигналы, как светопоглощение или светоиспускание выходящего раствора (фотометрические и флуориметрические детекторы), показатель преломления (рефрактометрические детекторы), потенциал и электрическая проводимость (электрохимические детекторы) и др. Непрерывно детектируемый сигнал регистрируется самописцем. Хроматограмма представляет собой зафиксированную на ленте самописца по-следовательность сигналов детектора, вырабатываемых при выходе из ко-лонки отдельных компонентов смеси. В случае разделения смеси на внеш-ней хроматограмме видны отдельные пики. Положение пика на хроматограмме используют для целей идентификации вещества, высоту или площадь пика - для целей количественного определения. 4. Применение ВЭЖХ Наиболее широкое применение ВЭЖХ находит в следующих областях химического анализа (выделены объекты анализа, где ВЭЖХ практически не имеет конкуренции): Контроль качества продуктов питания — тонизирующие и вкусовые добавки, альдегиды, кетоны, витамины, сахара, красители, консерванты, гормональные препараты, антибиотики, триазиновые, карбаматные и др. пестициды, микотоксины, нитрозоамины, полициклические ароматические углеводороды и т.п. Охрана окружающей среды — фенолы, органические нитросоединения, моно— и полициклические ароматические углеводороды, ряд пестицидов, главные анионы и катионы. Криминалистика — наркотики, органические взрывчатые вещества и красители, сильнодействующие фармацевтические препараты. Фармацевтическая промышленность — стероидные гормоны, практически все продукты органического синтеза, антибиотики, полимерные препараты, витамины, белковые препараты. Медицина — перечисленные биохимические и лекарственные вещества и их метаболиты в биологических жидкостях (аминокислоты, пурины и пиримидины, стероидные гормоны, липиды) при диагностике заболеваний, определении скорости выведения лекарственных препаратов из организма с целью их индивидуальной дозировки. Сельское хозяйство — определение нитрата и фосфата в почвах для определения необходимого количества вносимых удобрений, определение питательной ценности кормов (аминокислоты и витамины), анализ пестицидов в почве, воде и сельхозпродукции. Биохимия, биоорганическая химия, генная инженерия, биотехнология — сахара, липиды, стероиды, белки, аминокислоты, нуклеозиды и их производные, витамины, пептиды, олигонуклеотиды, порфирины и др. Органическая химия — все устойчивые продукты органического синтеза, красители, термолабильные соединения, нелетучие соединения; неорганическая химия (практически все растворимые соединения в виде ионов и комплексных соединений). контроль качества и безопасности продуктов питания, алкогольных и безалкогольных напитков, питьевой воды, средств бытовой химии, парфюмерии на всех стадиях их производства; определение характера загрязнений на месте техногенной катастрофы или чрезвычайного происшествия; обнаружение и анализ наркотических, сильнодействующих, ядовитых и взрывчатых веществ; определение наличия вредных веществ (полициклические и другие ароматические углеводороды, фенолы, пестициды, органические красители, ионы тяжелых, щелочных и щелочно-земельных металлов) в жидких стоках, воздушных выбросах и твердых отходах предприятий и в живых организмах; мониторинг процессов органического синтеза, нефте- и углепереработки, биохимических и микробиологических производств; анализ качества почв для внесения удобрений, наличия пестицидов и гербицидов в почве, воде и в продукции, а также питательной ценности кормов; сложные исследовательские аналитические задачи; получение микроколичества сверхчистого вещества. 5. Ультрацентрифугирование Ультрацентрифугирование — метод разделения и исследования высокомолекулярных соединений, вирусов и субклеточных частиц с помощью ультрацентрифуги. Метод заключается в том, что белки в центрифужной пробирке помещают в ротор ультрацентрифуги. При вращении ротора скорость оседания белков пропорциональна их молекулярной массе: более тяжёлые белки образуют фракции, расположенные ближе ко дну кюветы, более лёгкие — к поверхности. Идея ультрацентрифугирования была предложена А. В. Думанским в 1913, однако разработка современной теории седиментационного анализа стала возможной только после того, как Т. Сведберг в 1926 сконструировал высокоскоростную ультрацентрифугу. При ультрацентрифугировании различные фракции седиментируют с различной скоростью и образуют отдельные полосы, которые можно выделить. Во избежание перемешивания осажденных компонентов солевой раствор должен содержать инертный и хорошо растворимый материал (например, сахарозу), плотность которого постепенно увеличивается сверху вниз, формируя градиент плотности. При седиментации сквозь такие градиенты сахарозы различные компоненты клетки собираются в отдельные полосы, которые можно выделить. Скорость седиментации каждого из компонентов определяется его размерами и формой и обычно выражается с помощью коэффициента седиментации, обозначаемого S. Скорость вращения до 80000 об/мин, так что на разделяемые частицы действуют силы, превосходящие силу тяготения более чем в 500000 раз. Под действием столь больших сил даже сравнительно небольшие макромолекулы, такие, как тРНК или простейшие ферменты, разделяются и распределяются в строгом соответствии со своими размерами. Измерение коэффициента седиментации макромолекулярных комплексов обычно используют для определения их общей массы и количества входящих в их состав субъединиц. Ультрацентрифуга разделяет клеточные компоненты не только по массе, но и по плавучей плотности. В этом случае образец седиментирует в крутом градиенте, образованном высококонцентрированным раствором сахарозы или хлористого цезия. Компоненты клеток опускаются по градиенту до тех пор, пока не достигнут участка, плотность раствора в котором равна собственной плотности компонентов. Дальнейшей седиментации компонентов не происходит, и они «застревают» на этом уровне. Таким образом в центрифужной пробирке возникает набор различных полос. Метод центрифугирования в градиенте хлористого цезия был разработан в 1957 году для доказательства полуконсервативности репликации ДНК. Литературы 1.Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В двух книгах: кн..1 – М.: Химия, 1990,-480с. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В двух книгах: кн..2 – М.: Химия, 1990,-480с. Васильєв В.П. Аналитическая химия. В 2 ч. Ч. 2. Физико – химические методы анализа: Учеб. для Химко – технол. спец. вузов. – М.: Высш. шк., 1989. – 384с. Гидрохимические материалы. Том 100. Методы и технические средства оперативного мониторинга качества поверхностных вод. Л.: Гидрометео-издат, 1991. – 200с. Лурье Ю.Ю. Аналитическая химия производственных сточных вод / Ю.Ю. Лурье; М.: ХимияЮ, 1984. - 448с. |
