Санкт-Петербургский государственный педиатрический медицинский университет
Кафедра общей и медицинской химии
|
Специальность
«Педиатрия»
|
Дисциплина «Химия»
|
Семестр 1
|
БИЛЕТ № 39
Вопрос №1 (Тест)
Как формулируется правило Вант–Гоффа?
1) скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам реакции
2) для большинства химических реакций скорость реакции увеличивается с ростом температуры
3) при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2 – 4 раза
4) для большинства химических реакций скорость реакции уменьшается с ростом температуры
Кs – константа растворимости (произведение растворимости, ПР). Если Кs(PbSO4) = 1,6∙10-8; Кs(SrSO4) = 3,2∙10-7; Кs(СаSO4) = 1,3∙10-4, то минимальная растворимость
1) у СаSO4 2) у SrSO4 3) у PbSO4 4) не может быть определена
Гемоглобин HHb (Kд=6,3·10-9) и оксигемоглобин HHbO2 (Kд=1,12·10-7) являются слабыми кислотами. Прочность связывания ионов H+
1) меньше у Hb- 2) больше у HbO2- 3) больше у Hb- 4) одинаковая у Hb- и HbO2-
Формула соли, гидролиз которой протекает необратимо – это
1) NaCN 2) Сr2S3 3) NH4CH3COO 4) NH4Cl
Буферный раствор состоит из
1) двух кислот 2) двух сильных электролитов 3) слабого электролита и его соли 4) двух оснований
Продуктами, выделяющимися на инертных электродах при электролизе водного раствора хлорида калия, являются вещества, формулы которых
1) K и О2 2) H2 и Сl2 3) К и Сl2 4) H2 и О2
Поглощение вещества поверхностью адсорбента называется
1) сорбцией 2) абсорбцией 3) адсорбцией 4) десорбцией
Пептизация – это
1) выпадение белка в осадок из раствора под действием больших количеств
негидролизующихся солей
2) переход свежеосажденного осадка в свободнодисперсное состояние
3) негидролитическое нарушение нативной структуры белка
4) объединение частиц в коллоидных системах с твердой дисперсной фазой
Для золя иодида серебра(I), полученного по реакции, уравнение которой AgNO3(изб) + KI →AgI ↓ + KNO3, коагуляцию вызывают
1) катионы и анионы одновременно 2) катионы электролита 3) нейтральные молекулы 4) анионы электролита
Укажите уравнение вязкости, характеризующее гибкость цепей макромолекул
1) 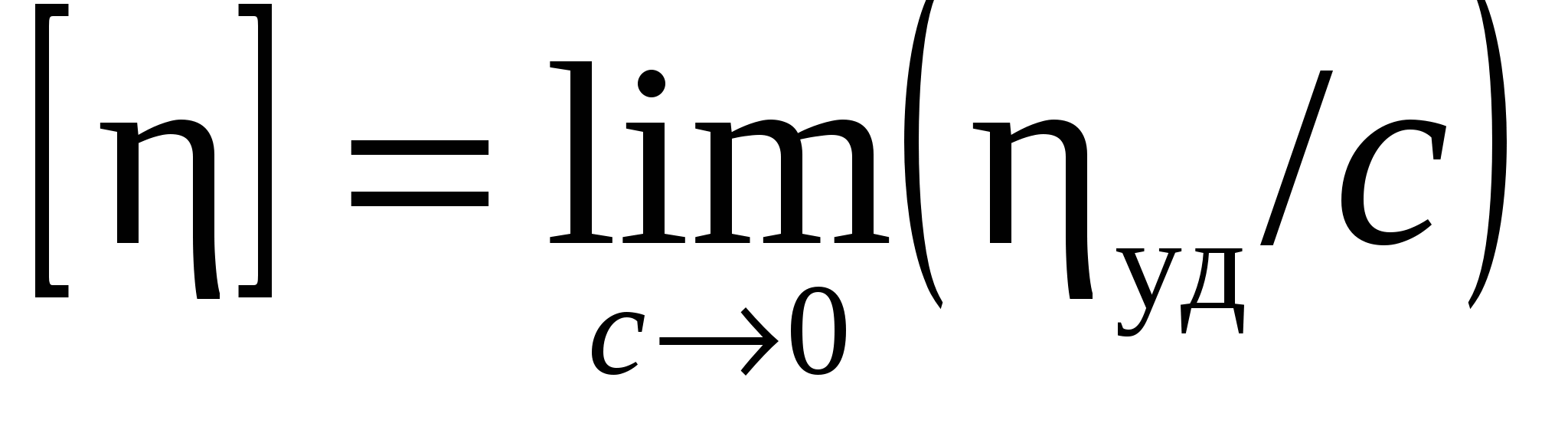 2) 2) 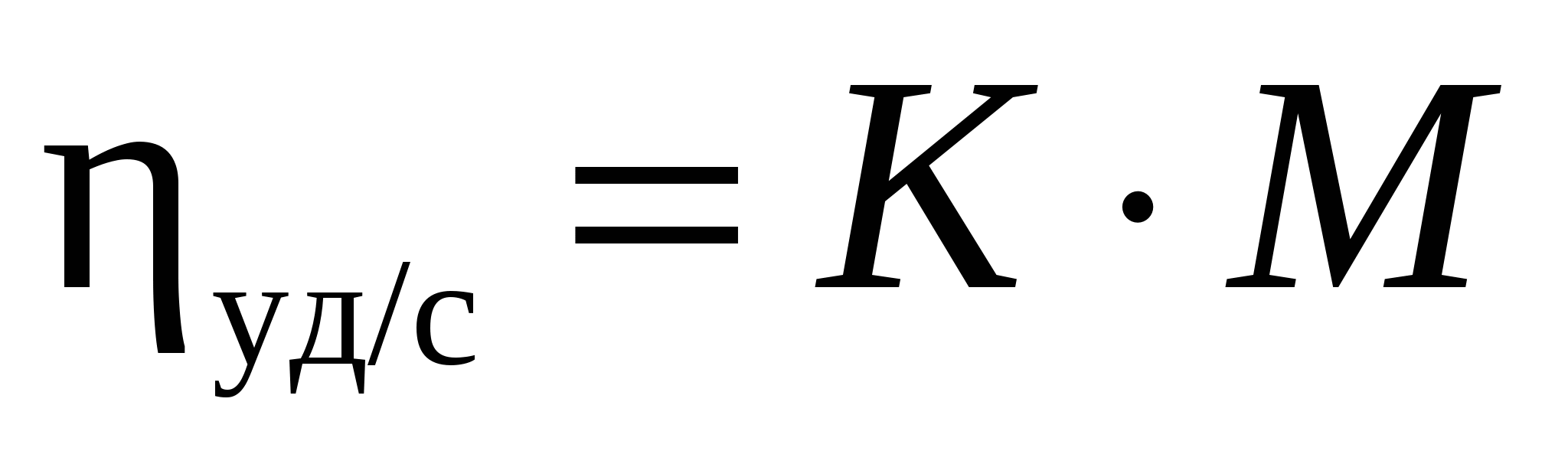 3) 3) 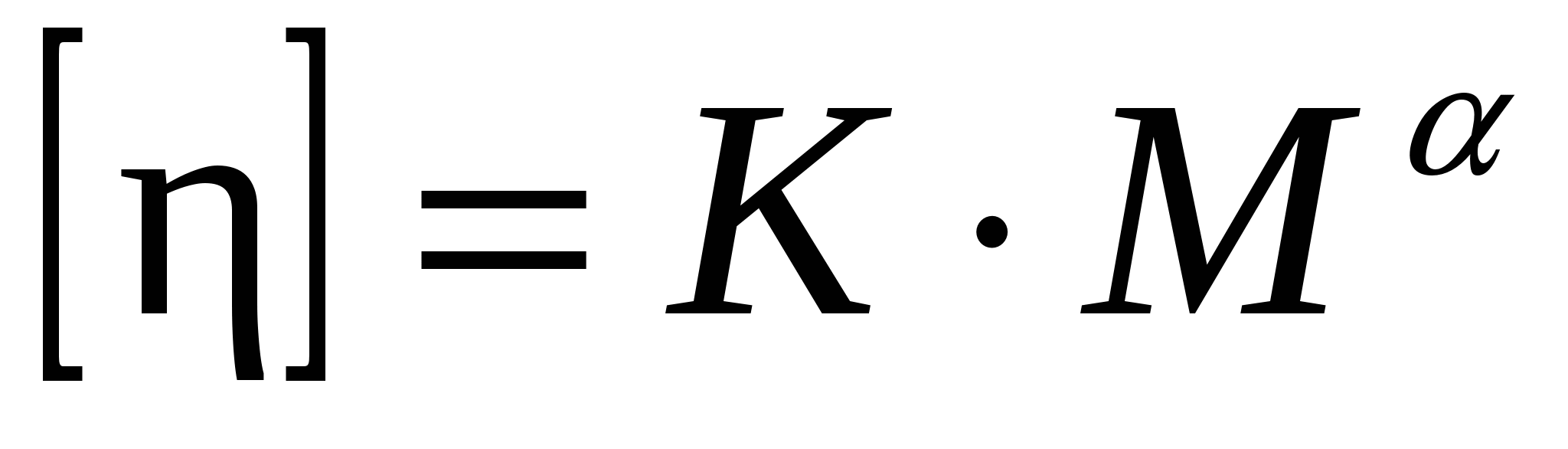 4) 4) 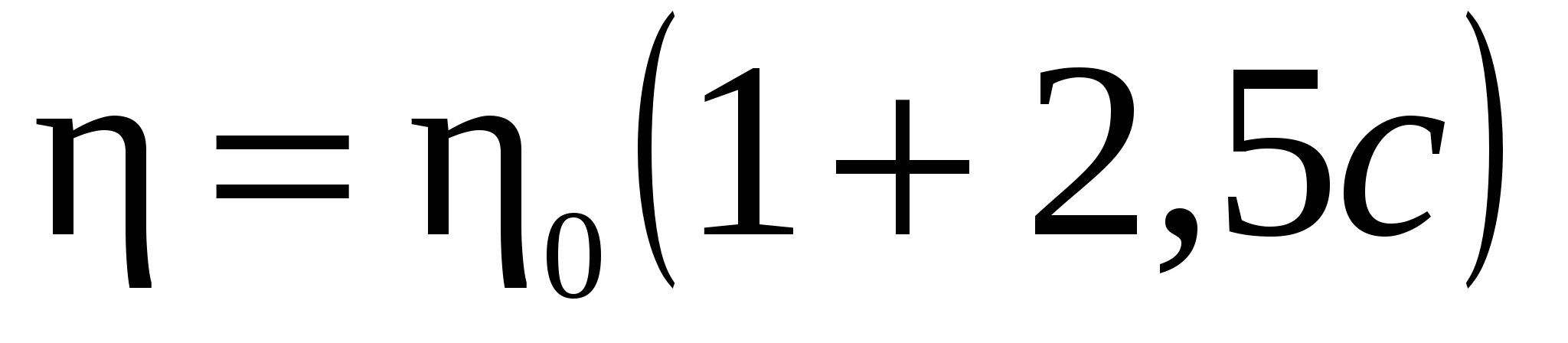
Вопрос №2
Ионное произведение воды. Понятие кислой, нейтральной и щелочной среды. Водородный и гидроксильный показатели. Расчет рН в растворах сильных и слабых электролитов. Границы изменения рН в водных растворах в зависимости от концентрации электролита и от температуры.
Вопрос №3
Коагуляция под действием электролитов: правило Шульце-Гарди, лиотропные ряды. Определение знака гранулы по порогам коагуляции (рассмотреть на конкретном примере).
Вопрос №4
Медный купорос CuSO4·5H₂O – антисептик, вяжущее средство. Рассчитайте См, Сн и титр 16%-ного раствора CuSO4 (ρ = 1,18 г/мл).
Вопрос №5
Аммиачный буферный раствор находится в почечной ткани. Какие объемы (мл) 0.1н раствора NH4OH и 0,4н раствора NH4Cl надо смешать, чтобы получить 960 мл раствора с рН = 7.7? (рКд основания = 4.76).
|
«Утверждаю»
Зав. кафедрой, профессор В.В.Хорунжий _______________________
| |
 Скачать 1.64 Mb.
Скачать 1.64 Mb.