Микробиологический синтез. Семинарским занятиям по курсу биотехнологии микробиологический синтез
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
Занятие 4. БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ. Цель занятия: изучить суть культивирования микроорганизмов в данных процессах. Биотехнологические процессы принципиально отличаются от процессов химического синтеза и могут быть двух типов: периодическими и непрерывными. Специфика биотехнологических процессов состоит в том, что в них участвуют живые клетки, субклеточные структуры или выделенные из клеток ферменты и их комплексы. Это оказывает довольно существенное влияние на процессы массопередачи (обмена веществ между различными фазами - перенос кислорода из газообразной фазы в жидкую) и теплообмена (перераспределение тепловой энергии между взаимодействующими фазами). Поэтому одним из важнейших компонентов биореакторов является система перемешивания, обеспечивающая однородность условий в аппарате, оптимальность массопередачи между фазами реактора, между культуральной жидкостью и клетками и т. д. Другим существенным различием между биотехнологическими и химическими процессами является необходимость создания аэробных или анаэробных условий, требуемых для культивирования соответствующего организма. Поэтому в определенных случаях необходимо подавать кислород и удалять образующиеся газообразные продукты иного рода, в первую очередь двуокись углерода (СО2). Системы аэрации зачастую бывают очень сложной конструкции, поскольку они должны обеспечить баланс между расходом О2 и его поступлением в нужных количествах, учитывая тот факт, что потребность в кислороде не одинакова на различных стадиях культивирования. Крайне важным является обеспечение должного уровня теплообмена в биореакторах, поскольку жизнедеятельность и метаболическая активность объектов зависит в значительной степени от колебаний температуры. Поддержание температуры в определенном узком диапазоне диктуется: 1) резким снижением активности ферментов по мере падения температуры и 2) необратимой инактивацией (денатурацией) макромолекул (в первую очередь белков) при ее повышении до критических значений. Температурный оптимум у каждого организма лежит в определенных пределах. Большинство биотехнологических процессов осуществляется в мезофильных условиях (30-500С). С одной стороны, это имеет преимущество, потому что лишь в редких случаях приходится обеспечивать повышенный подогрев реакторов. Однако, с другой стороны, возникает проблема удаления избыточного тепла, выделяющегося при интенсивном росте культивируемых клеток, поэтому биореактор должен быть оснащен эффективной системой охлаждения. Еще одной серьезной проблемой при культивировании в биореакторах является пенообразование, связанное с необходимостью аэрирования содержимого, в котором постоянно присутствуют поверхностно-активные вещества (ПАВ) продукты распада жиров (мыла) и белки (составные компоненты субстрата, например, белки соевой и кукурузной муки и т. п.). Образующийся слой пены опять же, с одной стороны, способствует росту аэробных микроорганизмов, а с другой - сокращает полезный объем реактора и способствует заражению культуры посторонней микрофлорой. Это заставляет интенсивно разрабатывать эффективные системы пеногашения. Специфическим элементом биореактора является система, обеспечивающая стерильность процесса. Стерилизация осуществляется на разных этапах процесса, как до его начала, так и при осуществлении и после окончания. Биотехнологически ценные продукты синтезируются как в экспоненциальной фазе (нуклеотиды, многие ферменты, витамины - так называемые первичные метаболиты), так и в стационарной фазе роста (антибиотики, пигменты и т. п. так называемые вторичные метаболиты). Довольно широко в биотехнологии используется периодическое культивирование с подпиткой, при котором, помимо первичного внесения питательного субстрата до засева культуры, в процессе культивирования в аппарат через определенные интервалы добавляют питательные вещества либо порциями, либо непрерывно "по каплям". Существует также отъемно-доливочное культивирование, когда часть содержимого биореактора периодически изымается и добавляется равное количество питательной среды. Такой прием обеспечивает регулярное "омолаживание" (обновление) культуры и задерживает (отдаляет) ее переход в фазу отмирания. Этот прием иногда называется полунепрерывным культивированием. Модификацией периодического культивирования является культивирование с диализом, при котором питательный субстрат постоянно поступает в реактор через специальную мембрану. Диализ ведет к снижению концентрации продуктов жизнедеятельности клеток, неблагоприятно влияющих на их жизнеспособность. Помимо этого, диализ удаляет из культуры часть жидкости, что позволяет получать в конце процесса концентрированную биомассу. В непрерывных процессах культивирования клетки постоянно поддерживаются в экспоненциальной фазе роста. С этой целью в биореактор непрерывно подается свежая питательная среда и обеспечивается отток из него культуральной жидкости, содержащей клетки и продукты их жизнедеятельности. Основным принципом непрерывных процессов (как уже отмечалось выше) является точное соблюдение равновесия между приростом биомассы вследствие деления клеток и их убылью в результате разбавления содержимого свежей средой. Различают хемостатный и турбидостатный режимы непрерывного культивирования. При хемостатном режиме культивирования саморегулируемая система возникает в силу следующих причин: если первоначальное поступление свежей питательной среды и вымывание биомассы превышает скорость деления клеток, то в результате разбавления культуры снижается концентрация веществ, ограничивающих ростовые процессы и скорость роста культуры повышается; увеличивающаяся популяция начинает активнее "выедать" субстрат, что в свою очередь приводит к торможению роста культуры. Конечным итогом этих процессов является (после серии затухающих колебаний) установление равновесия между скоростью роста культуры и ее разбавлением. Биореактор, работающий в хемостатном режиме культивирования, называют хемостатом. Его конструкция предусматривает наличие:
Последнее является наиболее важным и наиболее сложно осуществимым устройством. Турбидостатный режим культивирования базируется на прямом контроле концентрации биомассы. Наиболее распространенным методом ее определения является измерение светорассеивания с помощью фотоэлементов. Повышение концентрации клеток и соответственно оптической плотности автоматически ускоряет проток жидкости и наоборот. По своей конструкции турбидостаты отличаются от хемостатов лишь системами контроля скорости протока. Хемостаты применяются в процессах, характеризующихся малым протоком, когда концентрация клеток изменяется незначительно с изменением скорости протока, что облегчает саморегулировку системы. Область использования турбидостатов - высокие скорости разбавления, обусловливающие быстрое и резкое изменение концентрации биомассы. С технической точки зрения турбидостат может применяться только для культивирования одноклеточных микроорганизмов. При длительном культивировании в турбидостате возникает довольно серьезная проблема, связанная с прилипанием клеток к фотоэлементу. Однако имеются и определенные преимущества. Так, например, если засевается смешанная культура, то в турбидостате автоматически отбирается более быстро растущий вид, что может использоваться для предохранения от массивного заражения посторонней микрофлорой (если, конечно, она растет медленнее) и селекции определенных форм. Непрерывное культивирование в одном биореакторе называется одностадийным. Многостадийное выращивание предусматривает последовательное или каскадное расположение биореакторов, позволяющее обеспечивать внедрение принципа дифференцированных режимов в непрерывные биотехнологические процессы, основанные на создании системы биореакторов. При разработке новых биотехиологических процессов сначала прибегают к периодическому культивированию. На непрерывный режим пока еще переведено небольшое число процессов, однако перспективность его не вызывает сомнений, несмотря на более сложные конструкции аппаратов и систем контроля (иными словами, на более солидные капиталовложения). Конечно, и периодическое культивирование еще не исчерпало своих возможностей. Пока что выбор режима подчиняется соображениям экономической целесообразности. В последнее время в биотехнологию внедряется принцип дифференцирования режимов культивирования: разные этапы одного и того же процесса осуществляются при различных условиях - температура, рН, аэрация и т. п. Естественно, это создает новые (дополнительные) требования при конструировании реакторов. Таким образом, в соответствии с основными принципами реализации биотехнологических процессов современные биореакторы должны обладать следующими системами: • эффективного перемешивания и гомогенизации среды выращивания; • обеспечения свободной и быстрой диффузии газообразных компонентов системы (аэрирование в первую очередь); • теплообмена, обеспечивающего поддержание оптимальной температуры внутри реактора и ее контролируемые изменения; • пеногашения; • стерилизации сред, воздуха и самой аппаратуры; • контроля и регулировки процесса и его отдельных этапов. Открытые и замкнутые ферментационные системы. В практике современной индустриальной биотехнологии существует три главных типа биореакторов и две формы биокатализаторов. Биореакторы могут функционировать на основе разовой (однократной), восполняемой (не полностью) и непрерывной (продолженной) загрузки. А в самих реакторах культуры могут быть статическими и перемешивающимися, находиться в присутствии кислорода (аэробы) или без него (анаэробы), а также в водной фазе или условиях низкого увлажнения. Биокатализаторы (цельные клетки или ферменты) могут быть свободными или иммобилизованными путем прикрепления к поверхности биореактора или к специальным устройствам. Обычно реакции, протекающие в ферменторах, осуществляются при умеренных значениях рН (около нейтрального) и температуры (20-600С). При многих биотехнологических процессах конечные продукты метаболизма (так называемые целевые продукты) накапливаются в низких концентрациях в растворимой фазе (в водной среде) и требуют сепарации, прежде чем будут направлены на реализацию. Биореакторные системы для выращивания микроорганизмов могут быть классифицированы как "замкнутые" и "открытые". Система рассматривается в качестве замкнутой, когда многие компоненты данной системы не могут быть из нее удалены или добавлены. Так, например, в традиционных однократных (т. е. замкнутых) ферментационных системах все питательные компоненты добавляются в начале ферментации и, как результат этого, скорость роста, находящегося в таких условиях организма, в конечном счете, будет снижена до нуля вследствие уменьшения количества питательных веществ или накопления токсических продуктов отхода метаболизма. Системы, функционирующие в таких условиях, называются как batch-системы (замкнутые системы). Большинство современных биотехнологических систем функционируют как batch-процессы, при которых однажды оптимизированные условия обеспечивают максимальное накопление целевого (требуемого) продукта, например, приготовление пива, производство антибиотиков и ферментов и т. п. Модификацией процесса с разовой загрузкой является возобновляемая ферментация (feed batch - от feеd-насыщающий), при которой количество питательного вещества может быть добавлено в ходе ферментации с целью восполнения частично израсходованного субстрата или для активации процесса. Однако в своей принципиальной основе подобные системы остаются замкнутыми, поскольку у них нет постоянного оттока содержимого. В противоположность этому, ферментационная система, рассматривается как открытая, если ее компоненты (микроорганизмы и питательные субстраты) могут постоянно добавляться и удаляться из биореактора. Такие ферментеры оснащены приспособлениями, постоянно подающими свежую питательную среду и удаляющими биомассу и другие продукты. В таких системах скорость конверсии субстрата в биомассу или в целевой продукт должна быть точно сбалансирована со скоростью поступления вышеуказанных компонентов, что обеспечивает устойчивое состояние метаболических процессов в реакторе. Хотя непрерывные процессы приобрели широкое практическое применение в лабораторных условиях (масштабах), лишь немногие из них используются в промышленности. Однако непрерывные процессы довольно широко практикуются в производстве одноклеточного белка; например, продукция ICI Prutin на метаноле и производство микопротеина компанией Rank Hovis McDougall. Процесс периодического культивирования. Периодическое культивирование включает: а) стерилизацию сред и всего оборудования; б) загрузку биореактора питательной средой; в) внесение посевного материала (клеток или спор); г) выращивание культуры (это может совпадать во времени с последующим этапом или предшествовать ему); д) синтез целевого продукта; е) отделение и очистку готового продукта. Все этапы представлены во временном аспекте; после окончания последнего этапа производится мойка биореактора и подготовка его к новому циклу. При этом типе культивирования рост клеточной популяции подразделяется на несколько фаз:
.Процесс непрерывного (хемостатного) культивирования. Хемостатная, или непрерывная, культура представляет собой прочную культуру тех или иных микроорганизмов. В таком случае возможность продления жизни микробной популяции поддерживается с помощью непрерывной подачи свежей среды и постоянного отбора микробной биомассы или образовавшихся продуктов метаболизма, т.е. можно культуру микроорганизма как бы зафиксировать в одной, например стационарной, фазе роста и получать нужные продукты обмена или биомассу во времени столько, сколько требуется. Таким образом, максимальная производительность в хемостатной культуре всегда выше, чем максимальная производительность в периодической культуре. Для оптимизации биотехнологических процессов требуется постоянный и тщательный контроль за изменяющейся картиной ферментации, что обеспечивается наличием в биореакторах соответствующих датчиков, позволяющих осуществлять избирательный анализ определенных параметров ферментационного процесса. Неотъемлемой частью большинства ферментаций является та или иная степень компьютеризации. Системы перемешивания являются важным классификационным принципом биореакторов различного типа. Правда, поскольку биореакторы являются многопараметровыми аппаратами, они могут классифицироваться и по другим критериям: размерам, целевым назначениям (лабораторные, опытно-промышленные или пилотные, промышленные), режиму работы (периодического и непрерывного действия), условиям культивирования (аэробные и анаэробные, мезофильные и термофильные, для поверхностного и глубинного выращивания, для жидких и твердых питательных сред, газо-фазные). И все же система перемешивания имеет не последнее значение в классификации. По способу перемешивания и аэрации биореакторы подразделяются на аппараты с механическим, пневматическим и циркуляционным перемешиванием. Аппараты с механическим перемешиванием. Эти реакторы имеют механическую мешалку с центральным валом и лопастями (лопатками), число которых обычно равно 6, реже 8. Лопасти могут быть прямыми или изогнутыми, часто их располагают в несколько ярусов, что обеспечивает более эффективное перемешивание больших объемов жидкости. В систему входят также отражательные перегородки - узкие металлические пластинки, прикрепленные к внутренним стенкам биореактора. Они предотвращают возникновение водоворотов и обеспечивают вихревое движение жидкости, равномерно распределяемое, но всему объему реактора. В некоторых ферменторах используют полые мешалки, в которых воздух поступает в среду культивирования через отверстия в нижнем конце их валов и полые лопатки. Аппараты с механическим перемешиванием - наиболее распространенные конструкции в современной микробиологической промышленности. 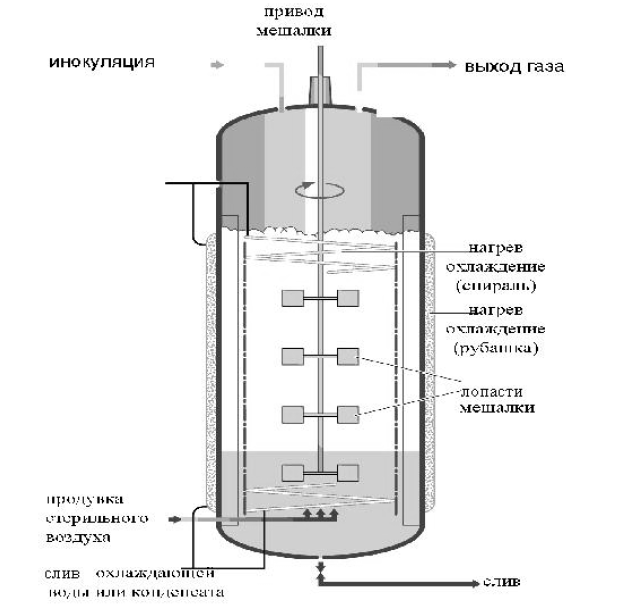 Ферментер с механическим перемешиванием. Аппараты с пневматическим перемешиванием. В такого типа аппаратах мешалка отсутствует и перемешивание жидкости осуществляется пузырьками газа. Естественно, что скорость массообмена в них намного ниже, чем в ферменторах с механическим перемешиванием (с мешалками). Классическим аппаратом такого типа является эрлифтный реактор (air lift - подъем воздуха). Биореакторы с пневматическим перемешиванием характеризуются более мягким (плавным) перемешиванием содержимого и получили распространение при выращивании клеток животных и растений. Пневматические аппараты привлекают также простотой конструкции и малыми энергозатратами. 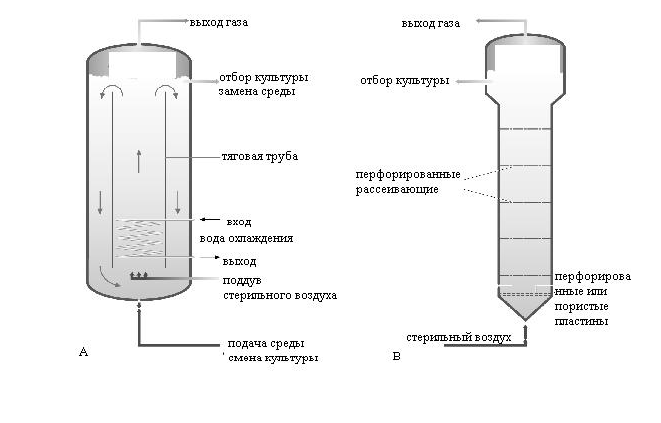 Ферментеры с пневматическим перемешиванием: а) эрлифтный; б) пузырькового типа Основной их недостаток - "тихоходность" Однако и это не всегда является недостатком, поскольку, например, в условиях "тихоходных" установок культуры клеток растений характеризуются биосинтетическими способностями, присущими целому растению. Так, клетки Digitalis lanata в эрлифтном ферменторе продуцируют ценный кардиологический препарат - р - метилдигоксин. Аппараты с циркуляционным перемешиванием. Биореакторы циркуляционного или гидродинамичесиого типа оснащены насосами и эжекторами, создающими направленный ток жидкости по замкнутому контуру (кругу). Жидкость увлекает за собой пузырьки газа и тем самым культуральная среда одновременно с перемешиванием может насыщаться либо атмосферным кислородом, либо (с использованием специальных устройств и эжекторов) газом иного типа. Эти аппараты (биореакторы) отличаются простотой конструкции и надежностью в эксплуатации. Ферменторы циркуляционного типа часто заполняются твердыми частицами (насадкой), которые способствуют лучшему перемешиванию содержимого реактора, препятствуют обрастанию стенок при длительном культивировании, а также обеспечивают диспергирование воздуха в жидкости. Некоторые микроорганизмы, прикрепляясь к таким насадкам (в частности, грибы и актиномицеты), развиваются намного лучше. От биореакторов с насадками - один шаг к ферменторам для иммобилизованных клеток или к аппаратам для иммобилизованных ферментов. В последнее время разрабатываются новые способы аэрации. Например, воздух может подаваться через специальные полипропиленовые мембраны. Это позволяет избегать пенообразования и очень хорошо зарекомендовало себя при выращивании клеток эукариотических организмов, в частности при промышленном получении интерферона. Система теплообмена. Теплообмен осуществляется с помощью труб с охлаждающим или нагревающим агентом, которые оплетают аппарат и образуют так называемую рубашку реактора. Иногда эта система труб располагается непосредственно в полости ферментора. Нагревающими агентами в промышленных биореакторах служат горячая вода или пар. Естественно, в лабораторных ферменторах чаще используется электрический подогрев. В качестве охлаждающих агентов применяют воду с низкой температурой (артезианскую или пропущенную через холодильную установку); более глубокое охлаждение достигается использованием этиленгликоля или фреонов. Проблема охлаждения ферменторов становится очень значительной в промышленных масштабах. Система пеногашения. Пеногашение - средство борьбы с избыточным ценообразованием. Существуют химические, механические, акустические и другие виды пеногашения. Наиболее часто применяют химические и механические способы пеногашения. К химическим средствам относятся поверхностно-активные вещества, которые, внедряясь в стенки пузырей, становятся центрами их неустойчивости. Эффективными пеногасителями служат растительные (соевое, рапсовое, кокосовое, подсолнечное, горчичное) масла, животные (сало, рыбий жир) и минеральные жиры. Недостатком этих пеногасителей является то, что при их утилизации микробными клетками сами по себе способствуют пенообразованию. Механические пеногасители представляют собой различные устройства, сбивающие пену: диски, лопасти, барабаны, располагающиеся в верхней части реактора. Более сложными приспособлениями являются сепараторы пены, которые одновременно служат для сбора биомассы, содержащейся в пенном слое. Все эти устройства, конечно же, приводят к дополнительным затратам и удорожают производство. Система стерилизации. Устройства и режим стерилизации определяется конструкцией биореактора, вспомогательного оборудования, используемых питательных сред и т. п. Наибольшее значение имеют термический метод стерилизации оборудования и сред и фильтрационный способ, применяемый для удаления микроорганизмов из подаваемого в ферменторы воздуха или другого газа. Режимы термальных способов стерилизации определяются химическим составом питательных сред. При этом определяющим является состояние компонентов среды после стерилизации; главное сохранность ее питательных качеств. Специализированные ферментационные процессы. Большинство ферментационных технологий связано с жидкими аэрируемыми системами, однако в настоящее время достаточно широко используются ферментационные технологии, основанные на утилизации плотных субстратов, при отсутствии воды или малом ее количестве, а также в без кислородных условиях. Анаэробные процессы. Биореакторы для таких процессов лишены приспособлении для аэрирования среды, хотя некоторые из анаэробных процессов сопровождаются потреблением газообразных продуктов водорода, метана, поэтому требуют соответствующих приспособлений для подачи газов в жидкую среду. Ведущим моментом является обеспечение анаэробиоза, что сопряжено со значительными сложностями. Твердофазные процессы. Многие биотехнологические процессы основаны на взаимодействии трех фаз: твердой, жидкой и газообразной. Существуют процессы, в которых роль жидкой фазы сведена до минимума: она лишь используется для увлажнения твердой поверхности или воздуха (газа). В зависимости от превалирующей фазы процессы и соответствующие им аппараты подразделяются на твердофазные и газо-фазные. Твердофазные осуществляются, как правило, на основе растительного сырья и используют чаще всего мицелиальные грибы и дрожжи или их комбинации. Различают три типа твердофазных процессов: • Поверхностные, когда слой субстрата не превышает 3-7 см ("тонкий слой"). В качестве "биореакторов" используются большие (до нескольких квадратных метров) подносы или культуральные камеры. • Глубинные процессы, идущие в не перемешиваемом слое ("высокий слой"). Биореакторы представляют собой глубокие открытые сосуды. Для аэробных твердофазных процессов разработаны приспособления, обеспечивающие диффузионный и конвекционный газообмен. • Перемешиваемые процессы, протекающие в перемешиваемой и аэрируемой массе субстрата, который может быть гомогенным (полужидкой консистенции) или состоять из частиц твердого вещества, взвешенных в жидкости (переходный вариант от твердофазного процесса к процессу в жидкой фазе). Для этого обычно используют биореакторы с низкоскоростным перемешиванием. Интерес к твердофазным процессам обусловлен их некоторыми преимуществами по сравнению с процессами, осуществляющимися в жидкой фазе: 1) они требуют меньших затрат на оснащение и более дешевые в эксплуатации; 2) характер субстрата облегчает отделение и очистку продукта; 3) низкое содержание воды препятствует заражению культуры продуцента посторонней микрофлорой; 4) твердофазные процессы не связаны со сбросом в окружающую среду больших количеств сточных вод. Однако и здесь существуют свои проблемы. Вследствие отсутствия хорошего перемешивания продуцент часто растет в виде колоний и лишь постепенно может распространяться по субстрату; при этом возникает локальная недостача питательных веществ, тогда как часть субстрата вообще не используется (не колонизируется) продуцентом; недостаточно эффективный контроль за аэрацией и др. Газо-фазные процессы. Процессы этого типа осуществляются в аппаратах с твердым наполнителем, через который пропускают газ. В таких аппаратах получают, например, спирт на основе дрожжей, а также их биомассу, мелкие агрегаты дрожжевых клеток, предварительно увлажненные концентрированной питательной средой, "парят" в потоке газа, подаваемого под сильным давлением через сопло в днище реактора. Газ, покидающий аппарат, несет с собой летучие продукты жизнедеятельности дрожжей (в том числе и спирт), которые конденсируются в холодильнике. Процесс может осуществляться как в аэробных, так и в анаэробных условиях (в зависимости от используемого газа). Особенности биотехнологии культивирования вирусов. Вирусы являются облигатными внутриклеточными микроорганизмами, поэтому на искусственных питательных средах они не растут. Для культивирования вирусов используют 3 живые системы:
При лабораторном культивировании вирусов используют культуры клеток, растущие на поверхности стенок тех или других емкостей (матрасах). В крупномасштабном производстве используют метод выращивания суспензионных клеточных культур. Этот метод впервые описал в 1953 г. Оуенс. Он показал способность клеток размножаться в жидкой среде в свободном суспендированном состоянии. Клетки перевиваемых линий могут длительно культивироваться во взвешенном состоянии. В таких условиях клетки размножаются, не прикрепляясь к стенкам культурального сосуда, благодаря постоянному перемешиванию среды. Перемешивание суспензионных культур проводят лопастными и магнитными мешалками, а также круговыми качалками. В настоящее время указанная клеточная система широко используется в вирусологических исследованиях для накопления больших количеств вируссодержащего материала при изготовлении вакцин, т.к. при оптимальном режиме выращивания клетки в суспензиях быстро размножаются и дают более высокий «урожай», чем в стационарных культурах. Суспензионные культуры готовят из однослойных клеточных культур. Клетки снимают со стекла с помощью растворов Версена и трипсина. Осадок клеток после центрифугирования ресуспендируют в свежей ростовой питательной среде. Приготовленную суспензию помещают в культуральные сосуды, реакторы, ферментеры и выращивают при постоянном и интенсивном перемешивании. Это делается для того, чтобы поддерживать клетки во взвешенном состоянии, препятствовать их осаждению и прикреплению к стенкам сосуда и в то же время не вызывать их механического повреждения. Способ суспензионного выращивания клеток в биологической промышленности стал применяться сравнительно недавно. Даже за короткий срок получены впечатляющие результаты. Большие успехи достигнуты при получении суспензионных постоянных культур клеток ВНК-21 для выращивания вируса ящура, вируса бешенства клеток почки поросят JBRS-2 для размножения вируса ящура, вируса везикулярной болезни свиней и др. Выращивание клеточных культур осуществляют в специальных реакторах емкостью 1000 и более литров при температуре 36-37°С, рН 7,4 и непрерывном перемешивании суспензии клеток при 300-350 об/мин. Несмотря на достижения по выращиванию суспензионных клеточных культур, на многих предприятиях биологической промышленности чаще используются методы получения клеточных линий в состоянии покоя или роллерным (динамичным) способом. Вопросы для контроля знаний и самопроверки:
|
