Задание №1.
Тема: Строение атома и электронные оболочки
Нужно знать: заряд ядра, знание определений протонов, нейтронов и электронов и как их определить; определение числа энергетических уровней; распределение электронов по энергетическим уровням; электронное строение атома, валентность
Шпаргалка на экзамене: таблица Менделеева
|
Атомы углерода и кремния имеют одинаковое
1. число нейтронов в ядре атома
2. значение относительной атомной массы
3. число протонов в ядре атома
4. число валентных электронов
|
Берем таблицу Менделеева
Определяем местоположение атомов углерода и кремния в таблице Углерод – находится в 4 группе, во 2 периоде
Кремний – находится в 4 группе, в 3 периоде
Определяем заряд ядра, число электронов, протонов, нейтронов, относительную атомную массу, количество энергетических уровней, количество валентных электронов и валентность атома
Углерод – заряд ядра +6, 6 электронов, 6 протонов, 16-6=6 нейтронов, атомная масса = 12, 2 энергетических уровня, 4 валентных электрона, валентность 4.
Кремний – заряд ядра +14, 14 электронов, 14 протонов, 28-14=14 нейтронов, атомная масса = 28, 3 энергетических уровня, 4 валентных электрона, валентность 4.
Сравниваем оба элемента по ответам, представленным в задании
У атомов углерода и кремния одинаковое число валентных электронов. Число нейтронов и протонов разные, как и разное значение относительной атомной массы.
Выбираем правильный ответ: 4
|
Задание №2.
Тема: Закономерности в таблице Д.И. Менделеева
Нужно знать: изменение свойств элементов в группе и периоде: электроотрицательность, радиус ядра, металлические и неметаллические свойства, изменение кислотности и основности элементов, изменение валености. Перекликается с заданием №1.
Шпаргалка на экзамене: таблица Менделеева
|
В ряду химичeских элементов Si – P – S
Увеличивается число валентных электронов в атомах
Уменьшается число валентных электронов в атомах
Уменьшается число протонов в ядрах атомов
Увеличиваются радиусы атомов
|
Берем таблицу Менделеева
Определяем местоположение атомов кремния, фосфора и серы в таблице
Кремний – находится в 4 группе, в 3 периоде
Фосфор – находится в 5 группе, в 3 периоде
Сера – находится в 6 группе в 3 периоде
Определяем свойства, которые изменяются в представленном ряду
От кремния к сере изменяются: заряд ядра атома – увеличение; электротрицательность – увеличение; неметаллические свойства – увеличиваются; число валентных электронов – увеличиваются; высшая степень окисления – увеличивается; радиус атома – уменьшается; не меняется число электронных слоев
Сравниваем полученный ответ с ответами к заданию
В ряду элементов Si – P – S из представленных ответов увеличивается только число валентных электронов в атомах.
Выбираем номер правильного ответа: 1
|
Задание №3.
Тема: Химическая связь и строение молекул
Нужно знать: строения молекул и химической связи, определения ковалентные связи, метталическая, ионная, металлы, неметаллы
Шпаргалка на экзамене: таблица Менделеева и собственные знания
|
Какое из указанных веществ имеет ковалентную полярную связь?
1.CH4
2.S8
3.CuO
4.Zn
|
Вспоминаем какие связи существуют и их определения
Металлическая – связь между атомами 1 или нескольких металлов
Ионная – связь между атомами металла и неметалла
Ковалентная полярная – связь между атомами двух разных неметаллов
Ковалентная неполярная – связь между атомами одного неметалла
Разбираем каждую молекулу по типам связи
СН4 – два разных атома неметалла – ковалентная полярная
S8 – один атом неметалл – ковалентная неполярная
CuO – атомы металла и неметалла – ионная
Zn – атом металла – металлическая
Выбираем правильный ответ из представленных: 1
|
Задание №4.
Тема: Степень окисления и валентность
Нужно знать: определения степени окисления и валентности, их различия, уметь рассчитать степень окисления атома в молекулах, уметь определять высшие и низшие степени окисления элементов
Шпаргалка на экзамене: таблица Менделеева, таблица растворимости (известные степени окисления) и собственные знания
|
Степени окисления фосфора в соединениях K3PO4 и Mg3P2 соответственно равны:
1.+5 и -3
2.+5 и +3
3.+3 и +5
4.+2 и -3
|
Определяем степени окисления известных нам элементов
Степени окисления К и Mg можем определить по таблице растворимости: у К в соединения степень окисления всегда +1, а у Mg - +2
У атома О в соединениях степень окисления всегда равна -2.
Вычисляем по уравнению степень окисления фосфора в каждом из соединений
K3PO4 – суммарная степень окисления самой молекулы равна 0
|
Mg3P2– суммарная степень окисления самой молекулы равна 0
|
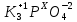 = 0 = 0
Умножаем индексы атомов на их степени окисления с учетом знаков: +1*3+Х+(-2)*4=0
Решаем уравнение с одним неизвестным: +3+Х-8=0↠Х=+5
|
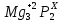 = 0 = 0
Умножаем индексы атомов на их степени окисления с учетом знаков: +2*3+2*Х=0
Решаем уравнение с одним неизвестным: +6+2Х=0↠Х=-3
|
Выбираем правильный ответ из представленных: 1
|
Задание №5.
Тема: Классификация веществ
Нужно знать: классы неорганических соединений, определения кислот, оснований, солей, оксидов, амфотерность, кислотность и основность веществ, знать, как записываются формулы неорганических молекул
Шпаргалка на экзамене: собственные знания и таблица растворимости
|
Гидроксиду натрия соответствует формула
1.NaH
2.NaOH
3.NaHCO3
4.Na2CO3
|
1. Вспоминаем определение оснований/классов неорганических соединений
Оксиды – сложные вещества, состоящие из двух химических элементов, один из которых - кислород.
Основания – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
Кислоты – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
Соли – это сложные вещества, состоящие из ионов металла и кислотных остатков.
2. Ищем вещество, которое соответствует данному определению
NaH - соединение металла натрия с водородом - такие соединения носят названия гидриды, но не гидроксиды.
NaOH образовано катионом металла - натрия и гидроксо- группой.
NaHCO3 - кислая соль - гидрокарбонат натрия. Она образована остатком угольной кислоты и катионом натрия.
Na2CO3 - средняя соль - карбонат натрия.
3. Выбираем правильный ответ из представленных: 2
|
Задание №6.
Тема: Классификация веществ
Нужно знать: химическая реакция, условия и признаки протекания химических реакций, химические уравнения, сохранение массы веществ при химических реакциях, классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
Шпаргалка на экзамене: собственные знания и таблица растворимости
|
Сумма коэффициентов в уравнении реакции между оксидом кальция и водой равна:
1.6
2.5
3.3
4.4
|
1. Составляем уравнение реакции
CaO + H2O = Ca(OH)2
2. Определяем коэффициенты
Всех элементов до реакции и после одинаковое количество Са до реакции был один, после реакции столько же, водород и кислород до реакции по 2 атома, после реакции также по 2 атома. Следует вывод, что коэффициенты перед молекулами равны 1.
1CaO + 1H2O = 1Ca(OH)2
Сумма всех коэффициентов в уравнении равна: 1+1+1=3
3. Выбираем правильный ответ из представленных: 3
|
Задание №7.
Тема: Электролитическая диссоциация
Нужно знать: определение электролитической диссоциации, электролитов и неэлектролитов, знать представителей сильных и слабых электролитов, писать уравнения диссоциации
Шпаргалка на экзамене: собственные знания и таблица растворимости
|
Одинаковое число молей катионов и анионов образуется при полной диссоциации в водном растворе 1 моль
1.H2SO4
2.(NH4)2S
3.BaCl2
4.CuSO4
|
1. Определяем сильный или слабый электролит
H2SO4 – серная кислота относится к сильным электролитам
(NH4)2S – сильных электролит, т.к. хорошо растворим в воде
BaCl2 – сильный электролит, т.к. хорошо растворим в воде
CuSO4– сильный электролит, т.к. хорошо растворим в воде
2. Пишем уравнения диссоциации электролита
H2SO4 = 2 H+ + SO42-
(NH4)2S = 2 NH4+ + S2-
BaCl2 = Ba2+ + 2Cl-
CuSO4 = Cu2+ + SO42-
3. Согласно условию задачи определяем число молей катионов и анионов
В данном случае необходимо определить ОДИНАКОВОЕ количество молей катионов и анионов, которому соответствует уравнение диссоциации под номером 4
4. Выбираем правильный ответ из представленных: 4
|
Задание №8.
Тема: Реакции ионного обмена
Нужно знать: реакции ионного обмена, условия их осуществления
Шпаргалка на экзамене: таблица растворимости
|
Газ выделяется при взаимодействии
1.MgCl2 и Ba(NO3)2
2.Na2CO3 и CaCl2
3.NH4Cl и NaOH
4.CuSO4 и KOH
|
1. Записываем уравнения реакции между веществами/элементами из каждого пункта
MgCl2 + Ba(NO3)2 = Mg(NO3)2 + BaCl2
Na2CO3 + CaCl2 = 2 NaCl + CaCO3
NH4Cl + NaOH = NH4OH + NaCl или NH4Cl + NaOH = NH3 + H2O + NaCl
CuSO4 + 2 KOH = Cu(OH)2 + K2SO4
3. Согласно условию задачи определяем образуется ли газ/осадок (по таблице растворимости) /вода
MgCl2 + Ba(NO3)2 = Mg(NO3)2 + BaCl2 - смотрим в таблицу растворимости: нитрат магния растворим (как и все нитраты), хлорид бария - тоже, поэтому реакция не идет, выделения газа не наблюдается
Na2CO3 + CaCl2 = 2 NaCl + CaCO3 - Карбонат кальция нерастворим, реакция ионного обмена идет, но газа в продуктах в ней нет
NH4Cl + NaOH = NH3 + H2O + NaCl – выделение газа NH3
CuSO4 + 2 KOH = Cu(OH)2 + K2SO4 - Гидроксид меди нерастворим, но газ не выделяется
4. Выбираем правильный ответ из представленных: 3
|
Задание №9.
Тема: Химические свойства металлов и неметаллов
Нужно знать: реакционную способность химических веществ - металлов и неметаллов
Шпаргалка на экзамене: ряд активности металла и собственные знания
|
С водой при комнатной температуре реагирует
1.Сu
2.Ag
3.Са
4.Hg
|
1. По ряду напряжений металлов определяем, что с водой реагируют металлы, стоящие в ряду напряжений до алюминия:

2. Определяем металл, который стоит до алюминия
До алюминия стоит только металл Са, все остальные элементы стоят после водорода
3. Выбираем правильный ответ из представленных: 3
|
Задание №10.
Тема: Химические свойства оксидов
Нужно знать: реакционную способность химических веществ - оксидов.
Шпаргалка на экзамене: ряд активности металла и собственные знания
|
Оксид цинка реагирует с каждым из двух веществ:
1.Na2O и H2O
2.SiO2 и Ag
3.NaOH и HCl
4.HNO3 и O2
|
1. Определить какой оксид указан в задании: кислотный/амфотерный/основный
Оксид цинка - амфотерный оксид
2. Вспомнить химические свойства данных оксидов
Т.к. он амфотерный, реагирует как с кислотами, так и с основаниями
3. Определяем, могут ли вещества из вариантов ответов реагировать с указанным в задании оксидом
Na2O (основный оксид) и H2O - Амфотерные оксиды реагируют с основными оксидами, но не реагируют с водой!
SiO2 и Ag - Оксид цинка должен реагировать с оксидом кремния при сплавлении, а с серебром нет - оно менее активно, чем цинк в ряде напряжений металлов
NaOH и HCl - Оксид цинка амфотерен и реагирует как соляной кислотой, так и с гидроксидом натрия. Данный вариант ответа подходит
HNO3 и O2 - С азотной кислотой все в порядке - она реагирует с оксидом цинка, а кислород нет - он уже и так окислил цинк до оксида.
4. Выбираем правильный ответ из представленных: 3
|
Задание №11.
Тема: Химические свойства кислот и оснований
Нужно знать: реакционную способность химических веществ – кислот и оснований, знание всех типов реакций (ионные реакции, овр и т.п.)
Шпаргалка на экзамене: ряд активности металла, таблица растворимости и собственные знания
|
В реакцию с соляной кислотой вступает:
1.нитрат серебра
2.нитрат бария
3.серебро
4.оксид кремния
|
1. Определить какое вещество указано в условии задания – класс соединений
Соляная кислота – класс соединений «кислоты» с химической формулой HCl
2. Вспомнить химические свойства данного класса
Кислоты реагируют с основными оксидами, амфотерными оксидами, со щелочами, солями, нерастворимыми основаниями, вытеснение слабых кислот из растворов их солей, металлами
3. Определяем, могут ли вещества из вариантов ответов реагировать с указанным в задании кислотой/основанием
1.Соляная кислота и нитрат серебра. Так как нитрат серебра - соль, обменная реакция возможна, если продукт реакции осадок либо газ. В качестве продукта может образоваться азотная кислота (растворима) и хлорид серебра (нерастворим - белый творожистый осадок). Значит, реакция возможна и ответ нам подходит.
2.Нитрат бария и соляная кислота. Продукты данной реакции обмена растворимы (азотная кислота и хлорид бария), поэтому реакция не идет.
3.Серебро стоит в ряду напряжений после водорода, поэтому не реагирует с кислотами-неокислителями.
4.Оксид кремния - кислотный оксид и с кислотами не реагирует.
4. Выбираем правильный ответ из представленных: 1
|
Задание №12.
Тема: Химические свойства солей
Нужно знать: реакционную способность химических веществ – соли, знание всех типов реакций
Шпаргалка на экзамене: ряд активности металла, таблица растворимости и собственные знания
|
Среди веществ: NaCl, Na2S, Na2SO4 – в реакцию с раствором Cu(NO3)2 вступает(-ют):
1.только Na2S
2.NaCl и Na2S
3.Na2S и Na2SO4
4.NaCl и Na2SO4
|
1. Берем в качестве шпаргалки таблицу растворимости
2. Пишем уравнения реакции нитрата меди с каждой из соли
NaCl + Cu(NO3)2 = 2 NaNO3 + Cu(Cl)2
Na2S + Cu(NO3)2 = 2 NaNO3 + CuS
Na2SO4 + Cu(NO3)2 = 2 NaNO3 + CuSO4
3. Определяем протекает реакция или нет
NaCl + Cu(NO3)2 = 2 NaNO3 + Cu(Cl)2 - Хлорид меди растворим, нитрат натрия тоже, значит данная реакция не идёт.
Na2S + Cu(NO3)2 = 2 NaNO3 + CuS - Нитрат натрия растворим, а сульфид меди - осадок, поэтому реакция идет.
Na2SO4 + Cu(NO3)2 = 2 NaNO3 + CuSO4 - Сульфат меди растворим, а значит реакция не идет.
4. Выбираем правильный ответ из представленных: 1
|
Задание №13.
Тема: Чистые вещества и смеси, правила безопасной работы в школьной лаборатории, лабораторная посуда и оборудование
Нужно знать: понятия чистые вещества и смеси, правила работы в школьной лаборатории, правила эксплуатации химической посуды и оборудования
Шпаргалка на экзамене: собственные знания
|
Верны ли следующие суждения об использовании лабораторного оборудования?
А. Фарфоровая ступка используется для измельчения твердых веществ.
Б. Делительная воронка используется для переливания жидкостей.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
|
1. Необходимо знать определения «Фарфоровая ступка» и «Делительная воронка»
Фарфоровая ступка - инструмент для толчения и растирания чего-либо, но она довольно хрупкая, поэтому ни в коем случае нельзя бить в ней по веществу, только растирать круговыми движениями с небольшими усилиями
|

|
Делительная воронка - сосуд конической формы, применяемый для разделения органической и неорганической фаз несмешивающихся жидкостей (либо для переливания жидкостей)
|

|
2. Исходя из определений можем сделать вывод о том, что утверждения об использовании лабораторного оборудования верны
3. Выбираем правильный ответ из представленных: 3
|
Задание №14.
Тема: Степень окисления химических элементов. Окислитель и восстановитель. ОВР.
Нужно знать: об окислении и восстановлении, понятия окислитель и восстановитель, окислительно-восстановительная реакция.
Шпаргалка на экзамене: собственные знания
|
Сера является окислителем в реакции:
1.H2S + I2 = S + 2HI
2.3S + 2Al = Al2S3
3.2SO2 + О2 = 2SO3
4.S + 3NO2 = SO3 + 3NO
|
1. Определить степени окисления каждого из элементов во всех молекулах, участвующих в реакции (до и после реакции)
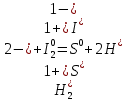
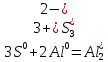
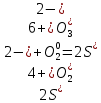
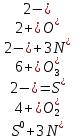
2. В каждой из реакций определить окислителя и восстановителя и реакции окисления и восстановления
H2S + I2 = S + 2HI: 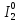 – окислитель/восстановления, – окислитель/восстановления, 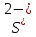 - восстановитель/окисления - восстановитель/окисления
3S + 2Al = Al2S3: 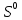 - окислитель/восстановления, - окислитель/восстановления, 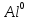 – восстановитель/окисления – восстановитель/окисления
2SO2 + О2 = 2SO3: 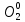 – окислитель/восстановления, – окислитель/восстановления, 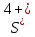 - восстановитель/окисления - восстановитель/окисления
S + 3NO2 = SO3 + 3NO: 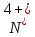 - окислитель/восстановления, - окислитель/восстановления, 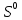 - восстановитель/окисления - восстановитель/окисления
3. Смотрим на условие задачи, что нужно найти
По условию необходимо определить, в какой из реакций сера является окислителем. Окислителем сера является во второй реакции
4. Выбираем правильный ответ из представленных: 2
|
Задание №15.
Тема: Массовая доля химического элемента
Нужно знать: о массовой доли химического элемента в веществе (молекуле) и формулу ее расчета
Шпаргалка на экзамене:
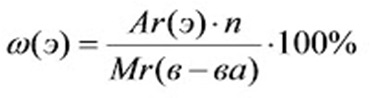 ω(э) – массовая доля элемента ω(э) – массовая доля элемента
Ar(э) – относительная атомная масса элемента
n – число атомов элемента Э в молекуле вещества
Mr – относительная молекулярная масса вещества
|
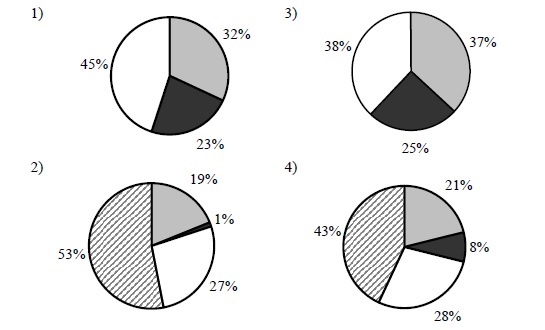
На какой диаграмме распределение массовых долей элементов отвечает количественному составу фосфата аммония?
|
|
1. Необходимо точно вычислить массовую долю одного из элементов, затем найти нужное значение на диаграмме и выбрать данный вариант ответа.
2. Найдем массовую долю фосфора в фосфате аммония. Для начала найдем молекулярную массу фосфата аммония:
Mr ((NH4)3PO4) = (14+4) * 3 + 31 + 16 * 4 = 149
3. Найдем массовую долю фосфора
w(P) = 31 / 149 • 100% = 20,8% = 21%, Значение 21% встречается на 4 диаграмме, значит ответ 4.
4.Выбираем правильный ответ из представленных: 4
|
|
Задание №16.
Тема: Периодический закон Д.И.Менделеева. Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов.
Нужно знать: см. Задание №2
Шпаргалка на экзамене: таблица Менделеева
|
Общим для магния и кремния является:
1.наличие трёх электронных слоёв в их атомах
2.существование соответствующих им простых веществ в виде двухатомных молекул
3.то, что они относятся к металлам
4.то, что значение их электроотрицательности меньше, чем у фосфора
5.образование ими высших оксидов с общей формулой ЭО2
|
Берем таблицу Менделеева
Определяем местоположение атомов кремния и магния в таблице
Кремний – находится в 4 группе, в 3 периоде
Магний – находится во 2 группе, в 3 периоде
Определяем свойства, которые изменяются в ряду от Mg к Si
От кремния к сере изменяются: заряд ядра атома – увеличение; электротрицательность – увеличение; неметаллические свойства – увеличиваются; число валентных электронов – увеличиваются; высшая степень окисления – увеличивается; радиус атома – уменьшается; не меняется число электронных слоев
Сравниваем полученный ответ с ответами к заданию
Mg и Si оба имеют 3 электронных уровня и электроотрицательность ниже, чем у фосфора
5. Выбираем номер правильного ответа: 1,4
|
Задание №17.
Тема: Первоначальные сведения об органических веществах: предельных и непредельных углеводородах и кислородсодержащих веществах
Нужно знать: классы органических соединений, химический и физические свойства, строение веществ и классификация ИЮПАК
Шпаргалка на экзамене: органические соединения сгорают до углекислого газа и воды
спирты являются жидкостями и реагируют со щелочными металлами
карбоновые кислоты реагируют с металлами и щелочами
|
Для этанола верны следующие утверждения:
1.в состав молекулы входит один атом углерода
2.атомы углерода в молекуле соединены двойной связью
3.является жидкостью (н.у.), хорошо растворимой в воде
4.вступает в реакцию со щелочными металлами
5.сгорает с образованием угарного газа и водорода
|
1. Определить класс органических соединений
Этанол – класс спирты
2. Вспомнить все корни, которым соответствуют число атомов углерода в углеродной цепи
Корень –эт‒, который говорит о том, что в углеродной цепи 2 атома углерода
3. Вспомнить химические и физические свойства данного класса органических соединений
Этанол – прозрачная жидкость, хорошо растворимая в воде
4. Выбираем номер правильного ответа: 3,4
|
Задание №18.
Тема: Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе.
Нужно знать: знать и распознавать качественные реакции на катионы и анионы, понятие «индикатор»
Шпаргалка на экзамене: собственные знания, таблица растворимости
|
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Вещества:
А) Na2CO3 и Na2SiO3
Б) К2CO3 и Li2CO3
В) Na2SO4 и NaOH
Реактив:
1) CuCl2
2) HCl
3) MgO
4) K3PO4
|
Рассматриваем каждый случай по отдельности
Na2CO3 и Na2SiO3
1.с хлоридом меди реакция не идет в обоих случаях, так как карбонат и силикат меди разлагается в водном растворе
2.с соляной кислотой в случае карбоната натрия выделяется газ, а в случае силиката выпадает осадок - это качественная реакция на силикаты
3.с оксидом магния данные вещества не реагируют, и оксид магния не вступает в реакции ионного обмена
4.с фосфатом также нет качественных реакций на натрий
К2CO3 и Li2CO3
1.с хлоридом меди данные вещества не реагируют (на самом деле выпадает осадок гидроксида меди, но этой реакцией не отличить два реагента)
2.с соляной кислотой оба реагируют с выделением углекислого газа
3.с оксидом магния данные вещества не реагируют, и оксид магния не вступает в реакции ионного обмена
4.с фосфатом выпадает литий в виде фосфата, а калий нет
Na2SO4 и NaOH
хлорид меди. С гидроксидом натрия выпадает гидроксид меди, а с сульфатом реакция не идет
Выбираем номер правильного ответа: 241
|
Задание №19.
Тема: Химические свойства простых и сложных веществ Нужно знать: необходимо вспомнить все химические свойства - как простых веществ, так и сложных, качественные реакции на катионы и анионы
Шпаргалка на экзамене: собственные знания, таблица растворимости
|
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
НАЗВАНИЕ ВЕЩЕСТВА
А) сера
Б) оксид цинка
В) хлорид алюминия
РЕАГЕНТЫ
1.CO2, Na2SO4(р-р)
2.HCl, NaOH(р-р)
3.AgNO3(р-р), KOH(р-р)
4.H2SO4(конц.), О2
|
Также рассматриваем каждый случай по отдельности
Сера. Сера как простое вещество не вступает в реакции обмена, поэтому все варианты, где присутствуют растворы, нам не подходят.
Остается последний вариант - концентрированная серная кислота и кислород.
С кислородом сера взаимодействует с образованием оксида серы 4 (SO2), и в серной кислоте окисляется:
2H2SO4(конц.) + S → 3SO2↑ + 2H2O
Оксид цинка - амфотерный оксид, а значит будет реагировать как с кислотами, так и с щелочами. Данный вариант ответа присутствует во втором варианте - это раствор соляной кислоты и гидроксида натрия.
Хлорид алюминия. Осталось два варианта ответа. В первом варианте не подходит и углекислый газ, и раствор сульфата натрия - реакции не идут, разве что гидролиз хлорида алюминия в растворе.
Остается третий вариант. С нитратом серебра выпадает осадок - хлорид серебра - это качественная реакция на хлорид ион. В растворе едкого калия выпадает гидроксид алюминия.
Выбираем номер правильного ответа: 423
|
Задание №20.
Тема: Метод электронного баланса и уравнения химических реакций
Нужно знать: составление уравнения химической реакции методом электронного баланса
Шпаргалка на экзамене: собственные знания
|
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI + H2SO4 → I2 + H2S + H2O
Определите окислитель и восстановитель
|
1. Вычисляем изменение степени окисления каждого элемента в уравнении химической реакции
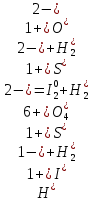
2. Выбираем только те элементы, которые поменяли степень окисления
меняют степени окисления сера и йод. Сера находилась в степени окисления +6, а в продуктах - -2. Йод имел степень окисления -1, а стал 0.
3. Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
S+6 + 8ē → S–2
2I–1 – 2ē → I2
4. Находим наименьшее общее кратное для переданных электронов
Наименьшее общее кратное 8, и дополнительные множители 1 и 4
S+6 + 8ē → S–2 |8 |1
2I–1 – 2ē → I2 |8 |4
5. Полученные значения и есть коэффициенты в уравнении (за редким исключением)
Расставляем коэффициенты в уравнении реакции согласно полученным данным:
8HI + H2SO4 = 4I2 + H2S + 4H2O
6. Определяем окислитель и восстановитель
сера в степени окисления +6 является окислителем, а иод в степени окисления –1 – восстановителем.
|
Задание №21.
Тема: вычисление по химическим
уравнениям массы (объема, количества) исходных веществ и продуктов
реакции.
Нужно знать: формулы массовой доли вещества, нахождение количества моль вещества, правильное составление условия (дано-найти-решение)
Шпаргалка на экзамене: собственные знания
|
Через 40 г раствора с массовой долей NaOH 6% пропустили углекислый газ до образования карбоната натрия. Вычислите объем (н.у.), вступившего в реакцию газа.
Как должно выглядеть решение данной задачи
Дано:
m(р-ра NaOH)=40г
w(NaOH) = 6% или 0,06
|
Решение:
2NaOH + 2моль
CO2 =
1моль =Na2CO3 + H2O
|
Найти: V(CO2)- ?
|
1) Рассчитываем массу и количество вещества NaOH:
а) m(NaOH)=40г × 0,06=2,4г
V(CO2)- ? б) n(NaOH)=2,4г:40г/моль=0,06 моль
2)Определяем объем CO2:
а)по уравнению реакции n(NaOH):n(CO2)=2:1, значит, n(CO2)=0,03 моль
б)V(CO2)=22,4л/моль × 0,03 моль=0,672л
Ответ: V(CO2)=0,672 л
|
1.Прочитайте задачу и составьте для нее краткое условие.
Дано:
m(р-ра NaOH)=40г
w(NaOH)=6% или 0,06
|
Решение:
|
Найти: V(CO2)- ?
|
2.Составьте уравнение происходящей химической реакции и расставляем коэффициенты
2NaOH + CO2 = Na2CO3 + H2O
3.Вычислите молярные массы известного и искомого веществ.
М(NaOH) = 40г/моль; М (CO2) = 44 г/моль
4.Вычислите количество того вещества, которое известно по условию задачи.
Для этого можно воспользоваться следующими формулами:
n = m : M или n =V : Vm
1) Рассчитываем массу и количество вещества NaOH:
а) m(NaOH)=40г × 0,06=2,4г
V(CO2)- ? б) n(NaOH)=2,4г:40г/моль=0,06 моль
5.Под химическим уравнением запишите количественное соотношение
между веществом, заданным по условию задачи, и искомым веществом.
Количественное соотношение определяется по коэффициентам, записанным
перед формулами соответствующих веществ в химическом уравнении.
По количественному соотношению определите количество искомого
вещества.
2NaOH + CO2 = Na2CO3 + H2O
2моль 1моль
6. Вычислите массу (или объем) искомого вещества. Для этого можно
использовать следующие формулы: m = n × M или V= n × Vm
2)Определяем объем CO2:
а)по уравнению реакции n(NaOH):n(CO2)=2:1, значит, n(CO2)=0,03 моль
б)V(CO2)=22,4л/моль × 0,03 моль=0,672л
7. запишите правильно ответ:
Ответ: V(CO2)=0,672 л
|
Задание №22.
Тема: практическая работа, составление уравнений химических реакций
Нужно знать: планировать проведение эксперимента на основе предложенных веществ; описывать признаки протекания химических реакций; составлять молекулярные и сокращенные ионные уравнения этих реакций
Шпаргалка на экзамене: собственные знания
|
Даны вещества: растворы NaOH, ZnSO4, BaCl2 ,NaNO3, ZnCl2. Используя воду и необходимые вещества только из этого списка, получите в две стадии Zn(OH)2. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
|
1. Составить схему эксперимента, чтобы в конечном итоге получить вещество, указанное в условии: Zn(OH)2
Схема эксперимента:
ZnSO4 → ZnCl2 → Zn(OH)2
2. Составить уравнения химических реакций согласно предложенной схеме, определить тип реакции
1) ZnSO4 + BaCl2 = ZnCl2 + BaSO4 ↓ - Реакция ионного обмена
2) ZnCl2 + 2 NaOH = Zn(OH)2 ↓ + 2NaCl - Реакция ионного обмена
3. Описать признаки протеканий реакций для каждой из стадий
Признаки протекания реакций:
1) Для первой реакции – выпадение белого плотного осадка;
2) Для второй реакции – образование белого студенистого осадка.
4. Составить сокращенное ионное уравнение для реакции ионного обмена
Сокращенное ионное уравнение для 2-ой реакции:
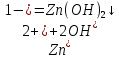
|
 Скачать 150.16 Kb.
Скачать 150.16 Kb.