курсовая по химии. 172511_б_ХМТН_31_2020_19_Ялымова (зачтено). Синтез и анализ хтс в производстве серной кислоты
 Скачать 472.35 Kb. Скачать 472.35 Kb.
|
1.1.3 Способы получения серной кислотыЕще в XIII в. серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4, поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса. В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце XIX и начале XX в. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты. В контактном методе получения серной кислоты процесс окисления SO2 в SO3 проводят на твердых катализаторах. Триоксид серы переводят в серную кислоту на последней стадии процесса ̶ абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции: SO3 + H2O = H2SO4 При проведении процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота. Окисление в жидкой фазе и конечным продуктом является серная кислота: SO2 + N2O3 + H2O = H2SO4 + 2NO В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью. 1.1.4 Применение серной кислотыСерная кислота находит самое широкое применение (рис - 1.1.) 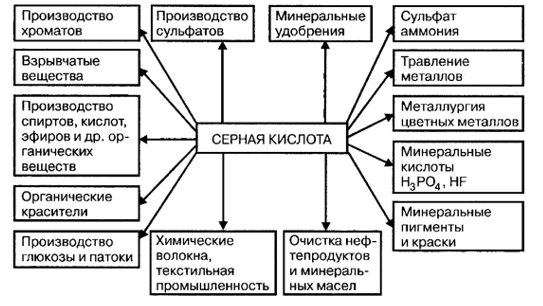 Рисунок - 1.1 Применение серной кислотыСамый крупный потребитель серной кислоты ̶ производство минеральных удобрений. На 1 т Р2О5 фосфорных удобрений расходуется 2,2 ̶ 3,4 т серной кислоты, а на 1 т (NH4)2SO4 — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений. Серная кислота также используется для получения соляной, азотной, фосфорной, плавиковой и многих органических кислот методом обмена, органических сульфосоединений, для очистки различных газов, входит в состав нитрующих смесей, используется в производстве красителей, для зарядки аккумуляторов, в металлургии серную кислоту применяют для обнаружения микротрещин в готовой продукции, на металлообрабатывающих заводах серную кислоту используют в цехах гальванопокрытий. Как известно, перед нанесением на металлические изделия электрическим методом никеля, хрома, меди их нужно тщательно очистить, протереть, обезжирить и, наконец, выдержать непродолжительное время в ванне с раствором серной кислоты. При этом она растворяет тончайший слой металла и с ним удаляются следы загрязнений. В то же время поверхность металла становится более шершавой: на ней появляются микроскопические углубления и выступы. Электролитические покрытия к такой поверхности лучше пристают и более прочно сцеплены с металлом. Также серная кислота необходима для переработки различных руд и ископаемых. При переработке руд редких металлов большое значение имеет кислотный способ их расщепления. Обычно для этой цели используют наиболее дешевую нелетучую серную кислоту. Измельченную руду смешивают в определенной пропорции с серной кислотой и нагревают. Полученный раствор и осадок дальше перерабатывают химическим путем, исходя из химических свойств того элемента, который нужно выделить из раствора. На химическую переработку руд редких элементов расходуют тысячи тонн серной кислоты. Большое количество серной кислоты требуется нефтеперерабатывающей промышленности для очистки нефти и ее различных фракций. В органическом синтезе концентрированная серная кислота ̶ необходимый компонент при получении многих красителей и лекарственных веществ. Широко применяются соли серной кислоты. Сульфат натрия (глауберова соль Nа2SO4  10Н2О) применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4 10Н2О) применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4 2Н2О) и безводной соли ангидрита (СаSO4). Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600 ̶ 700оС) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а также искусственного мрамора, бесшовных настилов полов и др. 2Н2О) и безводной соли ангидрита (СаSO4). Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600 ̶ 700оС) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а также искусственного мрамора, бесшовных настилов полов и др. Сульфат магния, или горькая соль (МgSO4  7Н2О) применяется в медицине как слабительное. Сульфат железа (II) или железный купорос (FеSO4 7Н2О) применяется в медицине как слабительное. Сульфат железа (II) или железный купорос (FеSO4 7Н2О) применяется для приготовления желтой кровяной соли (К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева. Сульфат меди, или медный купорос (СuSO4 7Н2О) применяется для приготовления желтой кровяной соли (К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева. Сульфат меди, или медный купорос (СuSO4 5Н2О) применяется для борьбы с различными грибками - вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди. 5Н2О) применяется для борьбы с различными грибками - вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди. Из растворов, содержащих сульфат трехвалентного металла (Fе3+, Аl3+, Сг3+) и сульфат одновалентного металла (К+, NН4+, Rb+), выкристаллизовываются двойные соли типа К2SO4Al2(SO4)3  4H2O или КАl(SO4)3 4H2O или КАl(SO4)3 12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как две самостоятельные соли, то есть как смесь сульфатов одно- и трехвалентных металлов. 12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как две самостоятельные соли, то есть как смесь сульфатов одно- и трехвалентных металлов. Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В электротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту применяют как компонент реакционной среды в процессах нитрования, в частности, при получении взрывчатых веществ. |
