курсовая по химии. 172511_б_ХМТН_31_2020_19_Ялымова (зачтено). Синтез и анализ хтс в производстве серной кислоты
 Скачать 472.35 Kb. Скачать 472.35 Kb.
|
1.4 Описание технологического процессаПроцесс получения серной кислоты в данном случае осуществляется контактным способом. Контактный способ производства – самый распространенный, и он выполняет следующие задачи: Получается продукт, удовлетворяющий потребности максимального количества потребителей. Во время производства сокращается вред для окружающей среды. При контактном способе в качестве сырья используются такие вещества: пирит (серный колчедан); сера; оксид ванадия (это вещество вызывает роль катализатора); сероводород; сульфиды различных металлов. Последовательность процессов следующая: 1. Сжигание серы. При получении обжигового газа путем сжигания серы отпадает необходимость очистки от примесей. Стадия подготовки будет включать лишь осушку газа и утилизацию кислоты. При сжигании серы протекает необратимая экзотермическая реакция (с выделением очень большого количества теплоты): S + O2 = SO2 Расплавленная жидкая сера, подаваемая на сжигание, испаряется (кипит) при температуре 444,6°С. Теплота испарения составляет 288 кДж/кг. Как видно из приведенных данных, теплоты реакции горения серы вполне достаточно для испарения исходного сырья, поэтому взаимодействие серы и кислорода происходит в газовой фазе (гомогенная реакция). Сжигание серы в промышленности проводят следующим образом. Серу предварительно расплавляют (для этого можно использовать водяной пар, полученный при утилизации теплоты основной реакции горения серы). Так как температура плавления серы сравнительно низка, то путем отстаивания и последующей фильтрации от серы легко отделить механические примеси, не перешедшие в жидкую фазу, и получить исходное сырье достаточной степени чистоты. Для сжигания расплавленной серы используют два типа печей - форсуночные и циклонные. В них необходимо предусмотреть распыление жидкой серы для ее быстрого испарения и обеспечения надежного контакта с воздухом во всех частях аппарата. Из печи обжиговый газ поступает в котел-утилизатор и далее в последующие аппараты. Концентрация диоксида серы в обжиговом газе зависит от соотношения серы и воздуха, подаваемых на сжигание. Обычно при сжигании серы получают обжиговый газ, содержащий 13 - 14% SO2. 2. Контактное окисление SO2 в SO3. Реакция окисления диоксида серы характеризуется очень высоким значением энергии активации и поэтому практическое ее осуществление возможно лишь в присутствии катализатора. В промышленности основным катализатором окисления SO2 является катализатор на основе оксида ванадия V2O5 (ванадиевая контактная масса). Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке. Так как реакция окисления SO2 относится к типу экзотермических, температурный режим ее проведения должен приближаться к линии оптимальных температур. SO2 + 0,5 O2 = SO3 Чаще всего в промышленности используют полочные контактные аппараты с наружным теплообменом. Схема теплообмена предполагает максимальное использование теплоты реакции для подогрева исходного газа и одновременное охлаждение газа между полками. Одна из важнейших задач, стоящих перед сернокислотной промышленностью, - увеличение степени превращения диоксида серы и снижение его выбросов в атмосферу. Эта задача может быть решена несколькими методами. 3. Абсорбция триоксида серы. Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту. nSO3 + H2O = H2SO4 + (n-1)SO3 + Q если n >1, то получается олеум (раствор SO3 в H2SO4); если n =1, то получается моногидрат (98,3% H2SO4); если n <1, то получается разбавленная серная кислота. При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3 из газовой фазы. Оптимальным абсорбентом является 98,3%-ная серная кислота (техническое название - моногидрат), соответствующая азеотропному составу. Действительно, над этой кислотой практически нет ни паров воды, ни паров SO3. Протекающий при этом процесс можно условно описать уравнением реакции: SO3 + nH2SO4 + H2O = (n+1)H2SO4 Использование в качестве поглотителя менее концентрированной серной кислоты может привести к образованию сернокислотного тумана. На рисунке 1.6 наглядно изображена технологическая схема производства серной кислоты. 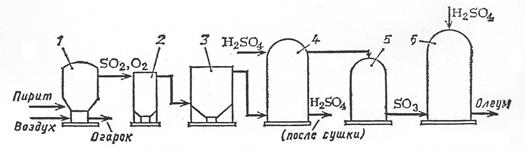 1– печь для обжига; 2,3 – пылеулавливатели; 4 – осушительная башня; 5– контактный аппарат; 6 – поглотительная башня. Рисунок 1.6 - Технологическая схема производства |
