Синтез, очистка и идентификация карбоната лития Li 2 co 3
 Скачать 204.1 Kb. Скачать 204.1 Kb.
|
|
БУ ВО «Сургутский государственный университет» Институт естественных и технических наук Кафедра химии КУРСОВОЙ ПРОЕКТ По дисциплине «Неорганическая химия» На тему «Синтез, очистка и идентификация карбоната лития Li2CO3» Выполнил: студент 302-91 гр. 2-го курса института естественных и технических наук Попов Артем Вадимович Научный руководитель: Ст. пр. Крайник Виктория Викторовна Сургут 2020 СОДЕРЖАНИЕ ВВЕДЕНИЕ………………………………………………………………............3 ГЛАВА 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ……………………...………................5 1.1. Историческая справка………………………...………………...……5 1.2. Области применения…………………………………………………6 1.3. Методы получения………………………………………………..….8 1.4. Физико-химические свойства……………………………………….9 1.5. Биологическая роль………………………………………………....12 ГЛАВА 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ……................................….....14 2.1. Методика синтеза и исходные вещества……………………..….14 2.2. Техника безопасности при выполнении синтеза…………..……14 2.3. Синтез…………………………………………………………..….16 ГЛАВА 3. РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА И ИХ ОБСУЖДЕНИЕ……..17 3.1. Расчет выхода продукта и его идентификация …….…………..…17 3.2. Испытание на чистоту полученного вещества…………….…...…18 3.2. Исследование свойств соединения……..........................................18 ВЫВОДЫ………………………………………………………………….…....20 СПИСОК ЛИТЕРАТУРЫ……………………………………………………...21 ВВЕДЕНИЕ За последние несколько лет мировой уровень потребления литиевой продукции увеличился более чем в 2,5 за счет появления новых бурно развивающихся отраслей (фармацевтики, производства синтетических каучуков, термоэластопластов, высокочистых литиевых солей, различных химических источников тока). Современное мировое производство литиевой продукции, в целом, отличается высокой стабильностью и имеет неплохую перспективу развития, поскольку открытие и разработка богатейших месторождений литиеносного гидроминерального сырья (ЛГМС) в Южной Америке произвели коренной переворот на рынке литиевой продукции за счет резкого снижения себестоимости переработки данного вида сырья в товарные литиевые соли, вообще, и в карбонат лития, в частности [1]. В качестве основных областей применения карбоната лития можно выделить: аккумуляторную промышленность (карбонат лития используются для производства катодного материала), строительную промышленность (все более важным становится применение карбоната лития в качестве добавки к быстросхватывающимся цементам, которые влияют на время схватывания и упрочнение цементов и строительных растворов с высоким и средним содержанием алюминия), а также примеси лития очень эффективны для процесса плавления стекла. Применение карбоната лития в качестве добавки стало важным при производстве стекла, эмали и также в керамической промышленности [1]. Целью данной работы является изучение процессов синтеза, очистки и идентификации такого вещества, как карбонат лития. Задачами работы будут являться: изучение методов получения, исследование физико-химический свойств, изучение применения вещества вычисление масс реагирующих веществ для получения 5 г карбоната лития. ГЛАВА 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ. Историческая справка В отличие от карбонатов других щелочных металлов (соды – карбоната натрия и поташа – карбоната калия) карбонат лития плохо растворим в воде, и поэтому теоретически может накапливаться в природе в виде минерала. Минерал, основным компонентом которого является карбонат лития – забуелит был обнаружен в 1987 у озера Забуйе в Тибете, однако это скорее исключение – карбонат лития практически не встречается в природе [1]. Низкая растворимость карбоната лития облегчает его получение из растворимых солей лития, обычно того самого хлорида лития, который, в свою очередь, можно выделить из месторождений поваренной соли. Особенно богаты хлоридом лития некоторые минеральные источники Южной Америки – Чили и Аргентины. Карбонат лития был впервые получен шведским химиком Йоханом Августом Арфведсоном (Johan August Arfwedson) в 1817 году вместе с другими полученными им соединениями лития [1]. Карбонат лития оказался в арсенале врачей не более, чем через 25 лет после открытия – первоначально его применяли для растворения камней в мочевом пузыре, затем в XIX веке его назначали для лечения головной боли, ревматизма и подагры. Помогал ли карбонат лития от этих хворей или нет – непонятно. В XIX веке врачи часто использовали новые соединения «от всего» – псевдонародная медицина под маской научности, при этом не забываем, что эффект плацебо работал и тогда [2]. Эффект плацебо или реальная польза от карбоната лития привели к тому, что он был запатентован как лекарство, а затем как компонент популярных напитков. Так, в 1929 был создан новый литийсодержащий напиток «Литиированная содовая с лимоном и лаймом». В этом напитке литий содержался до 1940 года, сейчас же этот напиток (уже без лития) известен нам как 7 Up [2]. Значительное расширение областей применения лития и его соединений и усовершенствование технологии их получения за последние 30 лет привели к возникновению самостоятельной крупной литиевой промышленности в ряде стран, многократному увеличению производственных мощностей и номенклатуры выпускаемых промышленностью соединений лития и его лигатур. Здесь можно ограничиться указанием на то, что мощность действующих литиевых заводов в США составляет в настоящее время 25 тыс. т (в пересчете на карбонат лития); это превышает уровень предвоенного 1940 г. более чем в 40 раз и обеспечивает создание больших резервов для дальнейшего увеличения производства как металлического лития, так и его многочисленных производных. [7]. Области применения 1. Карбонат лития используется в промышленном производстве батарей и комплексов сохранения энергии, включая использование литиевых батарей в аэрокосмической индустрии благодаря развитию новых технологических процессов по обработке продукта. 2. Используется в фармацевтической индустрии для производства широкого спектра лекарственных препаратов. В частности для лечения биполярных расстройств, депрессий различного генезиса вплоть до длительных депрессионных эпизодов с шизопатическими отклонениями. Карбонат лития включен в список одних и самых необходимых препаратов для психиатрии и фармакалогии, используемых для лечения психических расстройств. 3. Используется для производства смазочных материалов, используемых во множестве промышленных и технологических производства для увеличения параметров долговечности обрабатываемых материалов и инструментов. 4. Используется для производства веществ, используемых в производстве промышленных и домашних средств для фильтрации и очищения воздуха. 5. Является сырьевым продуктом в промышленном производстве аллюминия, используемый на этапе плавки аллюминиевого сырья. 6. Используется как сырье для изготовления продукции из стекла, отличающиеся повышенной плотностью и легкостью обработки продукции. В стеклоделии карбонат лития применяется как в чистом виде (в том числе и оксид лития), так и в составе различных минералов, таких как: петалит Li2O·Al2O3·8SiO2 (4,3-5,7 % Li2O), сподумен Li2O·Al2O3·4SiO2 (7,3-8 % Li2O), лепидолит (3,9-6 % Li2O), амблигонит (7-10 % Li2O). Оксид лития сильно повышает химическую стойкость стекла, при его применении вместе с оксидом натрия. В состав стекла как правило вносят (0,1-0,4 %Li2O). Свыше 0,15 % Li2O в составе стекла приводит к: понижению температуры плавления (выступает в роли флюса), что в свою очередь снижает энергозатраты и продлевает кампанию печи. снижению вязкости стекломассы. повышению качества и блеска готовой продукции, улучшает колер стекла 7. Используется в керамической промышленности на всех этапам обжига продукции для придания не только дополнительных цветовых гамм, но и для увеличения плотности и изностойкости конечного продукта. 8. Используется в аэрокосмической промышленности для изготовления обшивок для кораблей, нуждающихся в выходе в космос. Благодаря своим свойствам обшивка из карбоната натрия позволяет многократное использование после перезахода космического корабля в атмосферу. 9. Используется в автомобильной индустрии в промышленном производстве автомобилей нового поколения, называемых умными автомобилями. 10. Используется в строительной промышленности для добавки в растворы цемента, давая конечному продукту свойства быстрого схватывания. 11. Используется в производстве стяжек и плитки, как вещество, способствующее добавлению конечному продукту свойств дополнительной устойчивости к механическому воздействию, а так же повышенным параметрам прочности и долговечности [4]. Методы получения В промышленности Li2CO3 получают действием поташа или воды (в виде сухих солей или растворов) на растворы солей лития вблизи их температуры кипения, например при 90оС. Так как Li2CO3 растворим в растворах LiCl или LiNO3 значительно меньше, чем в растворе Li2SO4, то наиболее выделение карбоната лития может быть осуществлено из раствора LiCl или LiNO3; однако обычно осаждение проводят из технических растворов Li2SO4, так как они непосредственно получаются после разложений рудных концентратов лития [7]. Также существует способ получения карбоната лития из литийсодержащих природных рассолов (рис 1.): Можно привести следующие используемые лабораторные методы получения [3]: 1. Карбонат лития можно получить путем взаимодействия оксида лития и углекислого газа: Li2O + CO2 = Li2CO3 2. При комнатной температуре, в результате взаимодействия гидроксида лития и углекислого газа образуется карбонат лития и вода: 2LiOH + CO2 = Li2CO3↓ + H2O 3. В результате обменной реакции между хлоридом лития и, например, карбонатом калия, происходит образование карбоната лития: 2LiCl + K2CO3 = Li2CO3↓ + 2KCl Именно этот метод выбран в качестве проводимого синтеза в данной работе. 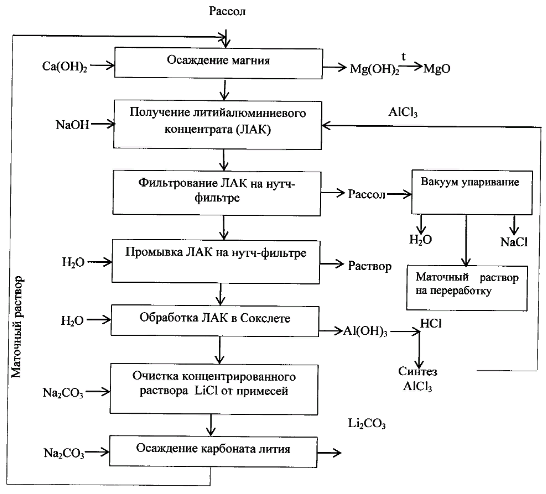 Рис.1 Технологическая схема получения карбоната лития из литийсодержащего природного рассола Физико-химические свойства Карбонат лития представляет собой вещество, являющееся порошком в своем изначальном агрегатном состоянии. Не имеет ярковыраженного запаха. Растворим в водных средах. Выше температуры плавления начинает разлагаться до оксида лития и углекислого газа. Давление разложение достигает атмосферного при 1310 оС. В термическом отношении Li2CO3 наименее устойчив среди карбонатов других щелочных металлов, что объясняется высокой поляризующей способностью иона лития и отчетливо видно из рис 2. На основании приведенной на рис. 3 политермы растворимости в системе Li2CO3 – H2О следует, что растворимость карбоната лития в воде с повышением температуры непрерывно уменьшается и при приближении к критической температуре воды выражается всего лишь сотыми долям процента. Таблица 1. Показатели вещества карбоната лития
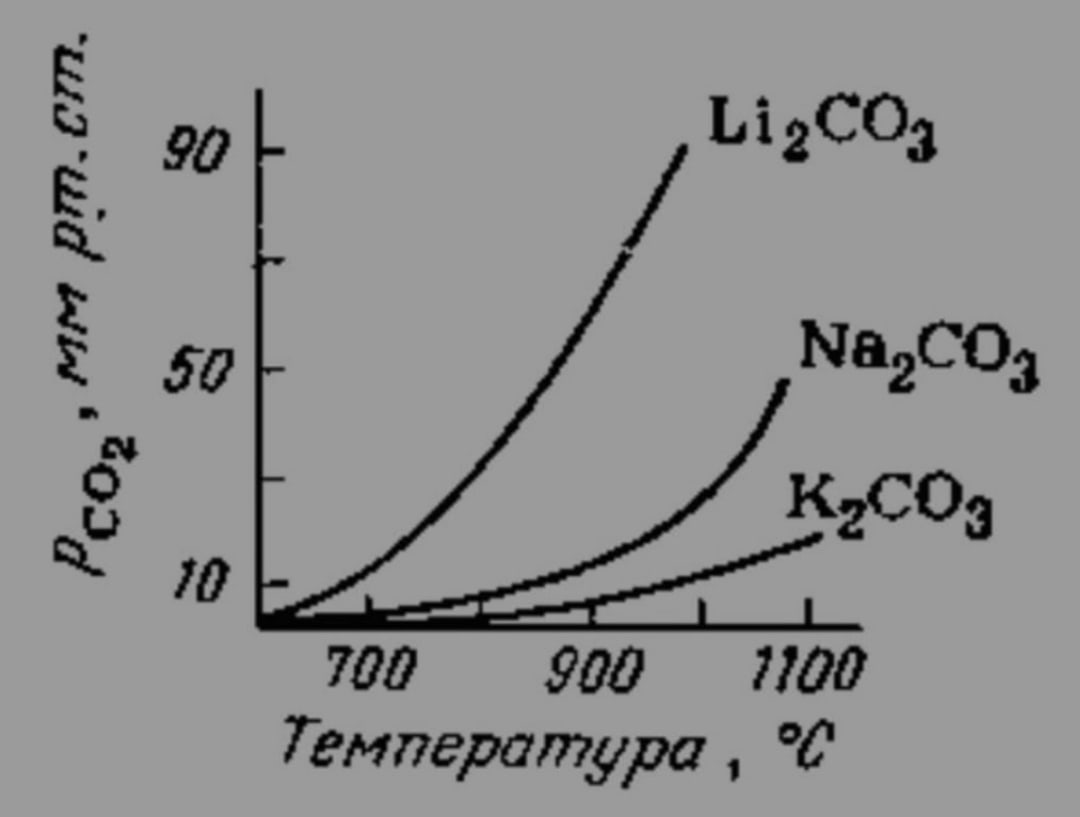 Рис. 2. Зависимость давления СО2 при диссоциации карбонатов щелочных металлов от температуры Кристаллогидратов Li2CО3 не образует. В водном растворе карбонат лития постепенно гидролизуется, рН насыщенного раствора равен 11; при кипячении гидролиз усиливается [7]. 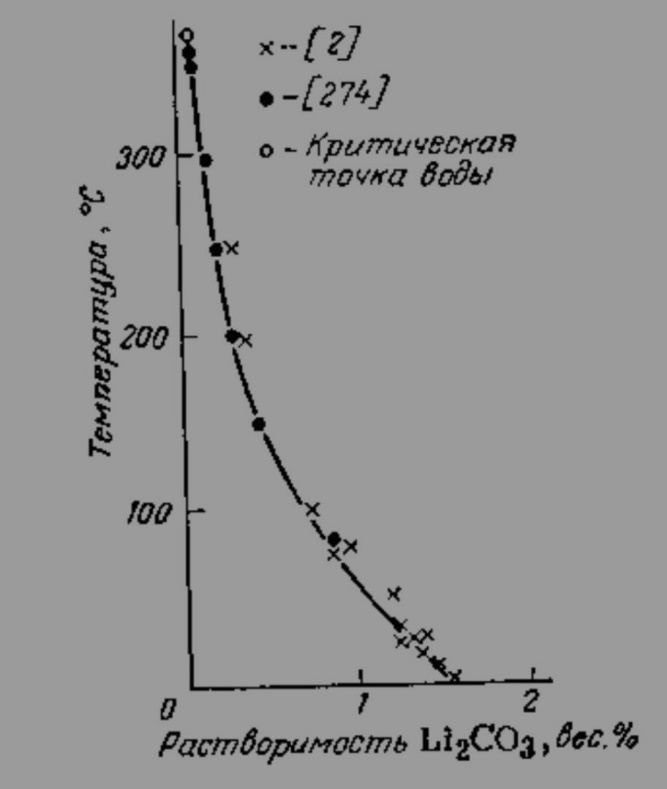 Рис.3. Политерма растворимости карбоната лития в воде. Химические свойства: 1. Карбонат лития разлагается при температуре от 730º до 1270º с образованием оксида лития и углекислого газа: Li2CO3 = Li2O + CO2 2. Карбонат лития может реагировать с простыми веществами: Карбонат лития реагирует с углеродом. При этом образуется оксид лития и угарный газ: Li2CO3 + C(кокс) = Li2O + 2CO С магнием карбонат лития реагирует с образованием лития, оксида магния и углекислого газа: Li2CO3 + Mg = 2Li + MgO + CO2 3. Карбонат лития вступает в реакцию со многими сложными веществами: Карбонат лития реагирует с водой и углекислым газом, образуя гидрокарбонат лития: Li2CO3 + H2O + CO2 ↔ 2LiHCO3 Карбонат лития может реагировать с гидроксидом кальция с образованием гидроксида лития и карбоната кальция: Li2CO3 + Ca(OH)2 = 2LiOH + CaCO3 При взаимодействии с хлороводородной кислотой карбонат лития образует хлорид лития, углекислый газ и воду: Li2CO3 + 2HCl = 2LiCl + CO2↑ +H2O 4. Карбонат лития способен реагировать с некоторыми оксидами: Карбонат лития при сплавлении реагирует с оксидом кремния. Взаимодействие карбоната лития с оксидом кремния приводит к образованию силиката лития и углекислого газа: Li2CO3 + SiO2 = Li2SiO3 + 2CO2 Карбонат лития взаимодействует с оксидом алюминия. При этом образуются алюминат лития и углекислый газ: Li2CO3 + Al2O3 = 2LiAlO2 + CO2 При взаимодействии карбоната лития с оксидом хрома и кислородом выделяется хромат лития и углекислый газ: 4Li2CO3 + 2Cr2O3 + 3O2 = 4Li2CrO4 + 4CO2 [4]. Биологическая роль Нормотимическое средство (нормализует психическое состояние, не вызывая общей заторможенности). Оказывает также антидепрессивное, седативное и антиманиакальное действие. Эффект обусловлен ионами лития, которые, являясь антагонистами ионов натрия, вытесняют их из клеток и тем самым снижают биоэлектрическую активность нейронов мозга. Ускоряет распад биогенных аминов (снижается концентрация норэпинефрина и серотонина в тканях мозга). Повышает чувствительность нейронов гиппокампа и других областей мозга к действию допамина. Взаимодействует с липидами, образующимися при метаболизме инозита. В терапевтических концентрациях блокирует активность инозил1-фосфатазы и снижает концентрацию нейронального инозита, который участвует в регуляции чувствительности нейронов. Благоприятное действие лития при мигрени может быть связано с изменением концентраций серотонина и гистамина в тромбоцитах. Антидепрессивное действие может быть связано с усилением серотонинергической активности и снижением регуляции функции β-адренорецепторов [5]. Токсическое действие. Клиническая картина острого отравления проявляется общей заторможенностью, угнетением реакции на внешние раздражители, судорогами в первые часы после отравления и параличами в последующий период. Смерть наступает в течение первых суток. У человека симптоматика острого отравления наблюдалась при криминальных случаях и при передозировке препаратов в курсе лекарственной терапии психических расстройств. Острая токсичность на мышах ЛД50 (средняя доза вещества, вызывающая гибель половины членов испытуемой группы) (мг/кг) при введении в кожу – 413, в желудок – 531, внутрибрюшинно – 360 [6]. ГЛАВА 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. Методика синтеза и исходные вещества. Исходные вещества: LiCl – хлорид лития K2CO3 – карбонат калия. Методика синтеза: К насыщенному раствору хлорида лития прибавляют равный объем воды, а затем горячий раствор, содержащий теоретически рассчитанное количество соды или поташа. Благодаря низкой растворимости (1,33 г при температуре 20°C в 100 г воды) карбонат выпадает в осадок. Его отфильтровывают, 2-3 раза промывают небольшими порциями горячей воды и высушивают при 60-80°C. Для очистки карбонат можно перекристаллизовать. Приготовляют на холоде насыщенный раствор соли, профильтровывают его и нагревают до кипения. Растворимость при нагревании уменьшается (при 100°C растворяется в 100 г воды 0,72 г карбоната), часть карбоната выпадает в осадок. Горячий раствор отфильтровывают, осадок промывают один раз горячей водой и высушивают при 60-80°C. На воздухе карбонат лития устойчив [4]. Техника безопасности при выполнении синтеза Хлорид лития — белый мелкокристаллический порошок, на воздухе, притягивая влагу, расплывается. Хранить только в хорошо закрытой склянке или в запаянной ампуле. В виде пыли вызывает раздражение слизистых оболочек дыхательных путей. Краткая характеристика опасности: вредно при проглатывании, при попадании на кожу вызывает раздражение, при попадании в глаза вызывает выраженное раздражение. Меры предосторожности: использовать перчатки/спецодежду/средства защиты глаз/лица. При попадании: промыть большим количеством воды с мылом. При попадании в глаза: Осторожно промыть глаза водой в течение нескольких минут. Снять контактные линзы, если Вы ими пользуетесь, и если это легко сделать. Продолжить промывание глаз. Специальные меры первой помощи: если раздражение глаз продолжается, то необходимо обратиться к врачу. Карбонат калия: Краткая характеристика опасности: может причинить вред при проглатывании или при попадании на кожу, вызывает раздражение кожи, вызывает серьезное раздражение глаз. Меры предосторожности: после работы тщательно вымыть руки, а также необходимо пользоваться защитными перчатками/защитной одеждой/средствами защиты глаз/лица. При попадании на кожу: осторожно промыть большим количеством воды. При попадании в глаза: осторожно промыть глаза водой в течение нескольких минут. Снять контактные линзы, если вы пользуетесь ими и если это легко сделать. Продолжить промывание глаз. Обратиться в токсикологический центр или к врачу/специалисту в случае плохого самочувствия. Карбонат лития: Краткая характеристика опасности: вредно при попадании внутрь, может причинить вред при попадании на кожу, вызывает серьезное раздражение глаз, вызывает повреждение органов при длительном или неоднократном воздействии, токсично для водной флоры и фауны с долговременными последствиями. Меры предосторожности: перед использованием получить специальные инструкции. Избегать вдыхания пыли/дыма/газа/тумана/паров/распылителей жидкости. При оказании воздействия или обеспокоенности: обратиться в токсикологический центр/к врачу/специалисту. Хлорид калия: Краткая характеристика опасности: может причинить вред при проглатывании. Меры предосторожности: обратиться за медицинской помощью при плохом самочувствии [4]. Синтез Производственный расчёт исходных количеств веществ для получения 5 г карбоната лития: По уравнению: 2LiCl + K2CO3 = 2KCl + Li2CO3Рассчитаем молярные массы веществ: М(LiCl) = 42 г/моль М(K2CO3) = 138 г/моль М(KCl) = 75 г/моль М(Li2CO3) = 74 г/моль Рассчитаем количество вещества: n(Li2CO3) = 5/74 = 0,068 моль n(LiCl) = 2n(Li2CO3) = 0,136 моль n(K2CO3) = n(Li2CO3) = 0,068 моль Найдем массы веществ, необходимых для синтеза: m(LiCl) = 0,136 * 42 = 5,712 г m(K2CO3) = 0,068 * 138 = 9,384 г ГЛАВА 3. РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА И ИХ ОБСУЖДЕНИЕ. Расчет выхода продукта и его идентификация. Расчет выхода продукта: Выход (%) = (практический выход (г) / теоретический выход (г)) . 100% mтеор(Li2CO3) = 5 г В соответствии с литературными данными [3] обычно получается 3,821 г вещества, следовательно, выход составит: ɳ = 3,821/5 * 100% = 76,42% Идентификация: 1) определение катионов лития Li+: а) после растворения лития карбоната в соляной кислоте – пламя горелки окрашивается в карминово-красный цвет ионами лития; б) с гидрофосфатом натрия в нейтральной или слабощелочной среде растворимые соли дают белый осадок лития фосфата: 3Li+ + НPO42-+ OH- = Li2PO4 + H2O Для более полного осаждения лития фосфата в реакционную смесь добавляют этанол; в) ионы лития с оксихинолином образуют красный оксихинолинат лития C9H6NOLi, при УФ-облучении которого наблюдается голубая флуоресценция. 2) реакция на карбонат-ион CO32-: Карбонат-ион даёт реакцию с хлористоводородной кислотой, которая сопровождается выделением углекислого газа. Эта реакция основана на вытеснении сильной минеральной кислотой кислоты угольной из её солей. Кислота угольная нестойкая и выделяет CO2 в виде пузырьков газа, который даёт белый осадок при пропускании через известковую воду: Li2CO3 + 2HCl = 2LiCl + CO2 + H2O [7]. Испытание на чистоту полученного вещества Чистоту препарата проверяют по отсутствию железа, тяжёлых металлов, хлоридов, сульфатов, кальция. Содержание влаги должно составлять не более 1%. Наличие щелочных металлов проверяют по следующей методике – 0,2 г препарата растворяют в 1 мл соляной кислоты и раствор выпаривают досуха; остаток должен полностью раствориться в 3 мл 96% спирта. Прозрачность (мутность) и цветность оценивают, действуя азотной кислотой на суспензию, приготовленную смешиванием 10 г препарата в 30 мл воды. Раствор нейтрализуют раствором натрия гидроксида концентрацией 2 моль/л и разбавляют дистиллированной водой до объёма 100 мл. Раствор должен быть прозрачным и бесцветным [8]. Исследование свойств соединения. Образует бесцветные кристаллы. Кристаллизуется в моноклинной сингонии (а = 0,839 нм, b = 0.500 нм, с = 0,621 нм, b = 114,5°, z = 2, пространств. Группа С2/с), умерено растворяется в холодной воде и плохо в горячей. Температура плавления 732 °C. Неустойчив и при температуре плавления начинает разлагаться: Li2CO3 → Li2O + CO2↑ (730 ° C) Разлагается разбавленными кислотами: Li2CO3 + 2HCl → 2LiCl + CO2↑ + H2O Вытесняется из соли более активными металлами: Li2CO3 + Mg → 2Li + MgO + CO2↑ (500 ° C) В холодных водных растворах обратимо взаимодействует с углекислым газом с образованием кислой соли: Li2CO3 + H2O + CO2 ⇄ 2LiHCO3 [9]. Реакции вещества: Выше температуры плавления начинает разлагаться до оксида лития и углекислого газа. Давление разложения достигает атмосферного при 1270 Реагирует в водном растворе с углекислым газом образуя, устойчивый только в водном растворе, более растворимый гидрокарбонат лития. Разлагается углем с образованием оксида лития. При нагревании с алюминием воспламеняется с образованием лития. При нагревании с магнием бурно реагирует (со взрывом) с образованием лития [9]. ВЫВОДЫ В результате выполнения данной работы удалось изучить процессы синтеза, очистки и идентификации такого вещества, как карбонат лития посредством выполнения конкретных задач: изучение методов получения, исследование физико-химический свойств, изучение областей применения и биологической роли, изучение техники безопасности при проведении синтеза и вычисление масс реагирующих веществ для получения 5 г карбоната лития. Таким образом, удалось выяснить, что для получения карбоната лития в ходе взаимодействия хлорида лития и карбоната калия потребуется 5,712 г LiCl и 9,384 г K2CO3, соответственно. А также был определен выход рассматриваемого вещества, он составил 76,42%. СПИСОК ЛИТЕРАТУРЫ 1. Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с. 2. Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2.- 1168 с. 3. Неорганические синтезы. Сборник 1. Перевод с английского Е.А. Терентьевой. Под редакцией проф. Д.И. Рябчикова. Издательство иностранной литературы. Москва – 1951 г.- 190 с. 4. Остроушко Ю.И., Бучихин П.И. и др. Литий, его химия и технология. - М.: ИГУИАЭ, 1960.- 200 с. 5. Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Биогенные свойства солей лития [Текст] / Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. // «Казанский государственный энергетический университет». - 2012 г.- С. 1-3. 6. Иванов С.В. Применение иммуногистохимиеческого метода оценки цитопротективного действия антидиабетических препаратов [Текст] / Иванов С.В. // Фармакокинетика и фармакодинамика. - 2018 г. - С. 2-4. 7. Плющев В.Е., Степин В.Д. Химия и технология соединений лития, рубидия и цезия. Издательство: Москва. Год издания: 1970.- 206 с. 8. Р.А. Лидин, В.А. Молочко, Л.Л. Андреева. Химические свойства неорганических соединений: 3-е издание, исправленное. Дата последней компиляции - 22.09.2004.- 162 с. 9. Вредные химические вещества: Неорганические соединения элементов I-IV групп. Справочник. - Л.: Химия, 1988.- 512 с. |
