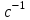ЛАБ. Лаб.работы по химии 2. Скорость химических реакций и химическое равновесие
 Скачать 74.02 Kb. Скачать 74.02 Kb.
|
|
Лабораторная работа 2 СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ Цель и содержание.Изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры. Методика и порядок выполнения работы ОПЫТ 1. Влияние концентрации реагирующих веществ на скорость реакции в гомогенной системе Взаимодействие тиосульфата натрия с серной кислотой протекает по уравнению: 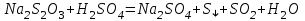 . .Приготовим три раствора тиосульфата натрия ( 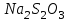 ) различной концентрации. Для этого в три сухие пробирки внесем: ) различной концентрации. Для этого в три сухие пробирки внесем:в первую – 5 капель раствора 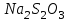 и 10 капель воды, и 10 капель воды, во вторую – 10 капель раствора 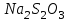 и 5 капель воды, и 5 капель воды, в третью – 15 капель раствора 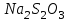 без воды. без воды. Первую и вторую пробирки осторожно встряхнем. Таким образом, концентрация 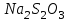 (в моль) будет: в пробирке № 1 –с, в пробирке № 2 – 2с, в пробирке № 3 – 3с. (в моль) будет: в пробирке № 1 –с, в пробирке № 2 – 2с, в пробирке № 3 – 3с.В пробирку № 1 добавим одну каплю серной кислоты ( 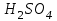 ) и одновременно включим секундомер. По секундомеру измерим время от момента добавления кислоты до появления в растворе заметной опалесценции. Также добавим по одной капле серной кислоты в пробирки № 2 и № 3; отмечая время до появления в растворе опалесценции. Данные опыта занесем в таблицу 5. ) и одновременно включим секундомер. По секундомеру измерим время от момента добавления кислоты до появления в растворе заметной опалесценции. Также добавим по одной капле серной кислоты в пробирки № 2 и № 3; отмечая время до появления в растворе опалесценции. Данные опыта занесем в таблицу 5.Таблица 5 – Зависимость скорости химической реакции от концентрации реагента.
 Постройте график зависимости скорости реакции от концентрации Постройте график зависимости скорости реакции от концентрациис 2с 3с Вывод: _______________________________________________________________  ОПЫТ 2. Влияние температуры на скорость реакции ОПЫТ 2. Влияние температуры на скорость реакциив гомогенной системе Чтобы выяснить, как влияет температура на скорость реакций, проведём реакцию тиосульфата натрия с серной кислотой, отмечая время её протекания секундомером, три раза: одно наблюдение выполним при комнатной температуре, второе – при температуре на 10 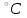 выше комнатной, третье – на 20 выше комнатной, третье – на 20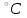 выше комнатной. выше комнатной. Для выполнения данной работы возьмём 3 пробирки с 10 каплями раствора 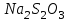 . .Сначала добавить в одну каплю серной кислоты и одновременно включить секундомер. Измерим время от момента добавления кислоты до появления заметной опалесценции. Аналогично проведём измерения со второй и третьей пробирками после их нагревания в термостате до соответствующих температур. Полученные данные занесем в таблицу 6. Таблица 6 – Зависимость скорости химической реакции от температуры
Постройте график зависимости скорости реакции от температуры   Скорость Вывод: ______________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ https://www.youtube.com/watch?v=Oruq6wqu1Kw ОПЫТ 3. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе Поместите в одну пробирку гранулы цинка, а в другую и примерно такое же по порошка цинка . В обе пробирки одновременно добавить одинаковое количество (10-20 капель) концентрированной 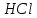 . Отметить в какой из пробирок реакция прошла быстрее (приблизительно). . Отметить в какой из пробирок реакция прошла быстрее (приблизительно).Напишите уравнение протекающнй реакции Наблюдения: ______________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ Вывод: ____________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ https://www.youtube.com/watch?v=wmuglTWP0rA ОПЫТ 4. Влияние катализатора на скорость реакции. В две пробирки внесем по 10 капель раствора роданида калия ( 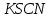 ) и по 1 капле раствора хлорида железа (III) ( ) и по 1 капле раствора хлорида железа (III) (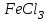 ). В результате реакции образуется роданид железа (III) ). В результате реакции образуется роданид железа (III) 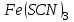 темно-красного цвета: темно-красного цвета: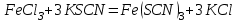 . .В одну из пробирок добавим 1 каплю раствора сульфата меди ( 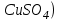 . Затем в обе пробирки внести по 3 капли тиосульфата натрия ( . Затем в обе пробирки внести по 3 капли тиосульфата натрия (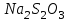 ). Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия: ). Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия: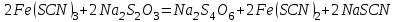 . .В какой из пробирок раствор обесцветился быстрее? Какую роль играет сульфат меди (II)? Наблюдения: ______________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ Вывод: ____________________________________________________________ ОПЫТ 5. Влияние концентрации реагирующих веществ насмещение химического равновесия https://www.youtube.com/watch?v=IU46z7SwkcI Реакция хлорида железа (III) с роданидом калия ( 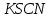 ) является обратимой: ) является обратимой: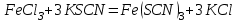 . .В результате реакции образуется роданид железа (III) 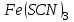 темно-красного цвета. Это позволяет рассмотреть, как влияют добавки реактивов на смещение равновесия по интенсивности окраски раствора. темно-красного цвета. Это позволяет рассмотреть, как влияют добавки реактивов на смещение равновесия по интенсивности окраски раствора.Вчетыре пробирки внесем по 5-7 капель разбавленных растворов 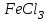 и и 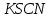 , и перемешаем. Одну пробирку с полученным раствором оставим для сравнения результатов опыта (эталон). В остальные пробирки добавим следующие реактивы: в первую – 1 каплю насыщенного раствора , и перемешаем. Одну пробирку с полученным раствором оставим для сравнения результатов опыта (эталон). В остальные пробирки добавим следующие реактивы: в первую – 1 каплю насыщенного раствора 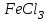 , во вторую – 1 каплю насыщенного раствора , во вторую – 1 каплю насыщенного раствора 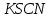 , в третью – несколько кристалликов хлорида калия. Сравните интенсивность окраски полученных растворов с интенсивностью окраски эталона. , в третью – несколько кристалликов хлорида калия. Сравните интенсивность окраски полученных растворов с интенсивностью окраски эталона.Наблюдения и выводы (вычеркните в каждом предложении ненужное слово, написанное курсивом): 1) Окраска раствора в 1-ой пробирке относительно эталона более /менееинтенсивна. Равновесие сместилось вправо /влево. 2) Окраска раствора во 2-ой пробирке относительно эталона более /менееинтенсивна. Равновесие сместилось вправо /влево. 3) Окраска раствора в 3-ой пробирке относительно эталона более /менееинтенсивна. Равновесие сместилось вправо /влево. |

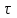 , с
, с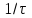 ,
,