химия. 05 Скорость и равновесие. Скорость и равновесие основы химической кинетики
 Скачать 319 Kb. Скачать 319 Kb.
|
|
2. КОНСТАНТА РАВНОВЕСИЯ И СВЯЗЬ ЕЕ С ТЕРМОДИНАМИЧЕСКИМИ ФУНКЦИЯМИ Можно показать, что ΔrG0 (298К) = ΔrН0(298К) - Т ΔrS0(298К) = -RTlnKр (4) При замене натурального логарифма на десятичный (ln a = 2,303 lg a) получаем удобную для использования формулу: ΔrG0 (298К) = ΔrН0(298К) - Т ΔrS0(298К) = -2,3RТlgKр = -19,147ТlgKр (5) Константа равновесия не зависит от энергии активации. От нее зависит лишь время достижения состояния равновесия. Поэтому катализаторы не влияют на константу равновесия, а, снижая энергию активации ускоряют достижение равновесия. Константа равновесия зависит от температуры, изменения энтальпии (теплового эффекта) реакции и от изменения энтропии. Не зависит от давления (если оно не слишком высокое) и от концентрации реагентов. 3. ПРИНЦИП ЛЕ-ШАТЕЛЬЕ Установившееся равновесие характеризуется определенными соотношениями концентраций веществ. Но состав равновесной смеси можно изменить, изменяя температуру системы, концентрации веществ и давление. Изменение состояния равновесия в результате изменения условий принято называть смещением химического равновесия. Принцип Ле-Шателье позволяет предсказать, в какую сторону будет смещаться равновесие системы при изменении внешних условий. Принцип Ле-Шателье: если на систему, находящуюся в состоянии равновесия, оказывают внешнее воздействие путем изменения какого-либо из условий, определяющих положение равновесия (Т, V, P), то оно смещается в направление того процесса, протекание которого ослабляет эффект произведенного воздействия. 1. Влияние температуры на состояние равновесия 1) Определение направления сдвига равновесия на основании принципа Ле-Шателье. Направление сдвига равновесия зависит от знака изменения энтальпии в химической реакции. Повышение температуры ведет к сдвигу равновесия в ту сторону, которая идет с поглощением теплоты (т.е. эндотермической реакции), а понижение температуры ведет в сторону той реакции, которая протекает с выделением теплоты (экзотермической реакции). Следует только правильно определить знак теплового эффекта прямой и обратной реакций. Например, для обратимого процесса: 4НCl (г) + O2 (г) <=> 2Cl2 (г) + H2O(г) ; ∆r H = -116,4 кДж, прямая реакция является экзотермической, а обратная – эндотермической. Для такой реакции, повышение температуры сдвигает равновесие в сторону обратной, эндотермической реакции, а понижение температуры сдвигает равновесие в сторону прямой экзотермической реакции. 2. Влияние изменения концентраций (парциальных давлений) участников реакции на смещение равновесия. Например, для реакции: 2SO2(г) + O2(г) <=> 2SO3(г); 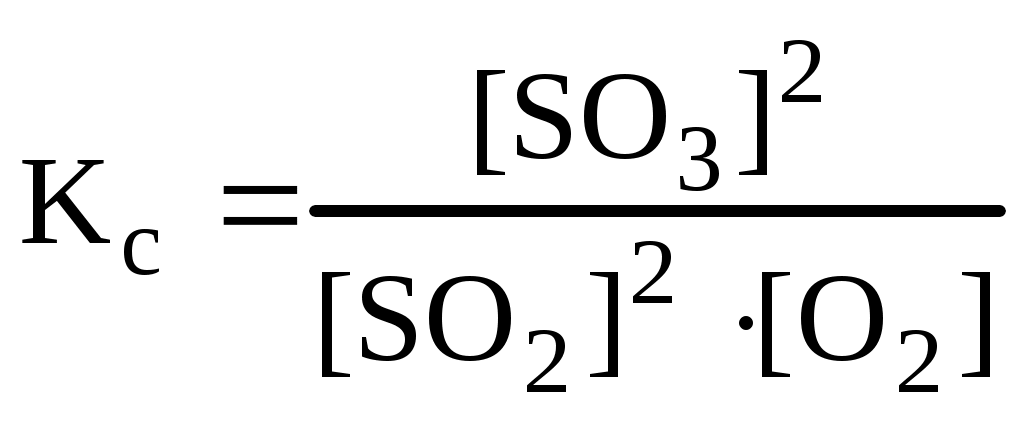 , ,Увеличение концентрации кислорода приведет к увеличению скорости прямой реакции. Чтобы константа равновесия не изменилась, необходимо, чтобы соответственно увеличилась скорость обратной реакции, а это в свою очередь связано с возрастанием концентрации продукта, по сравнению с первоначальной величиной. Возрастание концентрации SO3 после изменения условий означает сдвиг реакции вправо. 3. Влияние изменения общего давления в системе. Давление оказывает влияние на положение равновесия только в системах, включающих газообразные вещества. В общем случае для реакции увеличение общего давления смещает равновесие в сторону меньшего числа моль газообразных веществ, а уменьшение давления, наоборот, сдвигает равновесие в сторону большего числа моль газов. Для реакции: 2SO2(г) + O2(г) <=> 2SO3(г); 3 моль ↔ 2 моль С увеличением общего давления равновесие смещается в сторону прямой реакции, т.е. в сторону образования меньшего числа моль газов. С уменьшением общего давления равновесие смещается в сторону обратной реакции, т.е. в сторону образования большего числа моль газов. Если реакция протекает без изменения числа моль газов, то изменение общего давления практически не влияет на состояние равновесия. Например, увеличение общего давления не оказывает влияния на смещение равновесия в реакции: Н2 (г) + I 2 (г) <=> 2HI (г) 2 моль ↔ 2 моль УРОВЕНЬ В При погружении цинковой пластины в раствор хлороводородной кислоты за одно и то же время при температуре 293 К выделилось 8 см3 водорода, а при температуре 303 К – 17 см3 водорода. Водород собран над водой при давлении 740 мм рт. ст. Давление паров воды составляет 17,54 мм рт. ст. Рассчитать энергию активации протекающей реакции.
Скорость гетерогенной реакции определяем по уравнению: где S – площадь цинковой пластины, см2; τ – время протекания реакции, мин. Определяем отношение скоростей выделения водорода при двух различных температурах (площадь пластины и время протекания реакции постоянны): По уравнению Менделеева-Клапейрона P (P – P где Р – общее давление газов , мм. рт. ст; P V Т – температура опыта, К; R – универсальная газовая постоянная. Из уравнения (5.6) n Подставив выражение (5.7) для температур Т1и Т2 в отношение (5.5), получим = откуда = 53,1 кДж/моль Ответ: На основании принципа Ле Шателье определить, в каком направлении сместится равновесие: 2SO2(г) + O2(г) <=> 2SO3(г), а) понижении температуры, б) повышении концентрации SO3, в) повышении давления. Записать выражение для константы равновесия реакции. Ответы обосновать.
а) Выражение зависимости константы равновесия от термодинамических характеристик реакции имеет вид: -2,3RTlgKP =  Смещение равновесия реакции при изменении температуры зависит от знака изменения стандартной энтальпии реакции  будет возрастать, а значит и значение Крбудет возрастать. будет возрастать, а значит и значение Крбудет возрастать.  возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие 2SO2(г) + O2(г) <=> 2SO3(г) будет смещено вправо (→). б) Константа равновесия в) В соответствии с принципом Ле Шателье увеличение давления смещает равновесие в сторону той реакции, которая сопровождается уменьшением давления или уменьшением суммарного числа моль газообразных веществ. Следовательно, при повышении давления равновесие системы смещается вправо (→). Вычислить константу равновесия для гомогенной системы 4NH3(г) +3O2(г) <=> 2N2(г) + 6H2O(г), если исходные концентрации NH3(г) и O2(г) соответственно равны 6,0 и 5,0 моль/л, а равновесная концентрация N2(г) равна 1,8 моль/л.
Равновесная концентрация исходных веществ равна разности исходной концентрации и концентрации прореагировавших веществ. Равновесная концентрация продуктов реакции равна количеству образовавшихся продуктов реакции, т.к. в исходном состоянии их количество было равно нулю. Обозначим через х количество моль прореагировавших или образовавшихся веществ. Тогда, с учетом коэффициентов в уравнении реакции, отношения концентраций во второй строке под уравнением реакции равны: ( Последовательность расчетов равновесных концентраций веществ, участвующих в реакции, показана ниже:
По условию задачи равновесная концентрация N2 равна 1,8 моль/л. В то же время [N2] = 2х. Следовательно, 2х = 1,8, а х = 0,9. Тогда равновесные концентрации веществ равны, моль/л: [NH3] = 6,0 – 4·0,9 = 2,4 моль/л, [O2] = 5,0 – 3·0,9 = 2,3 моль/л, [N2] = 1,8 моль/л, [H2O] = 6,0·0,9 = 5,4 моль/л. Kc Ответ: Kс= 198,95. | ||||||||||||||||||||||||||||||||

 = – 284,2 кДж
= – 284,2 кДж




 х
х