химия. 05 Скорость и равновесие. Скорость и равновесие основы химической кинетики
 Скачать 319 Kb. Скачать 319 Kb.
|
|
Энергия активации некоторой реакции равна 60 кДж/моль. Во сколько раз изменится скорость этой реакции: а) при повышении температуры от 320 до 360К? б) если она протекает при 298 К в присутствии катализатора (
тогда б) зависимость скорости реакции от наличия катализатора выражается уравнением: откуда Ответ: а) при повышении температуры от 320 до 360К скорость реакции возрастает в 12,3 раза; б) в присутствии катализатора скорость реакции возрастает в 129 раз. 4. Скорость гетерогенных химических реакций. Гетерогенные реакции встречаются в природе и технике чаще чем гомогенные химические реакции. К гетерогенным химическим реакциям относят процессы коррозии, твердения вяжущих материалов, процессы горения кускового топлива (С + О2 = СО2). Реакции в гетерогенных системах осуществляются на поверхности раздела фаз. Вследствие этого, особенность гетерогенных реакций проявляется в: 1) механизме реакций 2) в том, что суммарная скорость реакции зависит, и от концентрации исходных веществ, и от реакционной поверхности. Поэтому, концентрацию газообразных и жидких веществ, участвующих в реакции, измеряют количеством молей этих веществ, приходящихся на единицу реакционной поверхности (моль/м2), и называют поверхностной концентрацией СS. Тогда средняя и истинная скорость гетерогенной реакции м.б. представлена соответственно как: Или v = K'S·C = к"СS (12) где S - суммарная поверхность, приходящаяся на единицу массы твердого вещества (м2/г). Последняя формула показывает, что величина поверхности, входит в константу скорости реакции к". В целом, например, для реакции: СО2 + СаО = СаСО3 скорость определяется как: V = KCS(CO2) Условно механизм протекания гетерогенных реакций можно подразделить на 4 этапа: 1) подвод исходных веществ к границе раздела фаз 2) адсорбция газообразного вещества поверхностью твердого вещества на границе раздела фаз. 3) химическое взаимодействие реагирующих веществ 4) отвод продуктов реакции из зоны взаимодействия. 5. Катализ. Одним из способов ускорения химической реакции является использование катализаторов. Следует отметить, что примерно 95% выпускаемой химической продукции производится с применением катализаторов: получение серной и азотной кислот, аммиака и водорода, синтетического каучука, крекинг-процесс и другие. В отсутствии катализатора схема гомогенной реакции может быть представлена как Аг + Вг → АВг. В присутствии катализатора схема этой реакции будет иметь следующий вид: Аг + Вг + Кг = АВг + Кг . Однако катализатор не является инертным веществом. Механизм его действия заключается в том, что он на первой стадии избирательно реагирует с одним их исходных веществ, образуя нестойкий промежуточный активированный комплекс, например: Аг + Кг → АКг* Последующее взаимодействие этого комплекса с веществом В приводит к образованию нового соединения (АВ) и регенерации катализатора: АКг* + Вг → АВг + Кг Причиной ускорения катализируемых химических реакций является снижение энергии активации катализатором и, как следствие, возрастание скорости химической реакции. Т.е. катализатор направляет ход реакции через такие промежуточные соединения, образование которых не требует большой затраты энергии на активацию реагентов (рис.4).  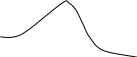      Е ∆Еа Е ∆Еа Еакт АК* ВК*     АВ АВ Е1 Е1 А+В Еа АВ  Путь реакции Рис. 4. Уровень потенциального барьера для реакции А + В без катализатора и с катали- затором. Если реагирующие вещества и катализатор находятся в различных агрегатных состяниях, то такой катализ называется гетерогенным. Согласно уравнению Аррениуса константы скорости реакции без катализатора (К) и с катализатором (Ккат) при одной и той же температуре Т могут быть описаны следующими уравнениями: Прологорифмировав оба выражения, определим отношение констант скорости реакции с участием катализатора и без него: ПРИМЕР (А4). Энергия активации некоторой реакции при 298К в отсутствие катализатора равна 60 кДж/моль. Во сколько раз изменится скорость реакции в присутствии катализатора, если ее энергия активации при 298К составляет 48 кДж/моль. РЕШЕНИЕ. Зависимость скорости реакции от наличия катализатора выражается как: откуда где 103 - пересчет кДж/моль в Дж/моль. З  начит, в присутствии катализатора скорость реакции возрастет в 125,9 раза. начит, в присутствии катализатора скорость реакции возрастет в 125,9 раза.ХИМИЧЕСКОЕ РАВНОВЕСИЕ Содержание лекции Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия и ее связь с термодинамическими функциями. Принцип Ле-Шателье. 1. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В ГОМОГЕННЫХ И ГЕТЕРОГЕННЫХ СИСТЕМАХ. Все химические реакции можно разделить на два вида: необратимые и обратимые. Необратимые реакции протекают до полного исчезновения одного или нескольких реагирующих веществ. Примером необратимой реакции может быть реакция разложения нитрата аммония: NH4NO3 Даже в тех случаях, когда химическая реакция возможна и по термодинамическим, и по кинетическим критериям, многие химические реакции не проходят до полного исчезновения исходных веществ. . Реакции, которые при одной и той же температуре в зависимости от соотношения реагентов могут протекать как в прямом, так и в обратном направлении, называются обратимыми. Примером обратимой реакции может быть реакция взаимодействия водорода с газообразным иодом: Н2 (г) + I 2 (г) < = > 2HI (г) В данной обратимой гомогенной химической реакции соотношение скоростей прямой и обратной реакций, согласно закону действующих масс, зависит от соотношения концентраций реагирующих веществ. Скорость прямой реакции выражается уравнением: где скорость обратной реакции: где Если Н2 и I 2 – исходные вещества, то в начальный момент времени скорость прямой реакции определяется их начальными концентрациями, а скорость обратной реакции равна нулю. По мере израсходования Н2 и I 2 и образования HI, скорость прямой реакции уменьшается, а скорость обратной реакции возрастает. Изменение скоростей прямой и обратной реакции представлено на рис. 1. По мере прохождения реакции наступает такой момент времени (τравн.), когда скорости прямой и обратной реакции окажутся равными, кривые Химическое равновесие является динамическим равновесием. При химическом равновесии концентрации всех участников реакции постоянны и не изменяются со временем, хотя одновременно осуществляется прямая и обратная реакции. Как показано выше, с наступлением химического равновесия скорости прямой и обратной реакции становятся равными: Поэтому равны и правые части уравнений (1) и (2): Скорость           τравн Время Рис. 1. Изменение скорости прямой ( Поскольку константы скоростей прямой и обратной реакций не зависят от концентраций, то можно записать: 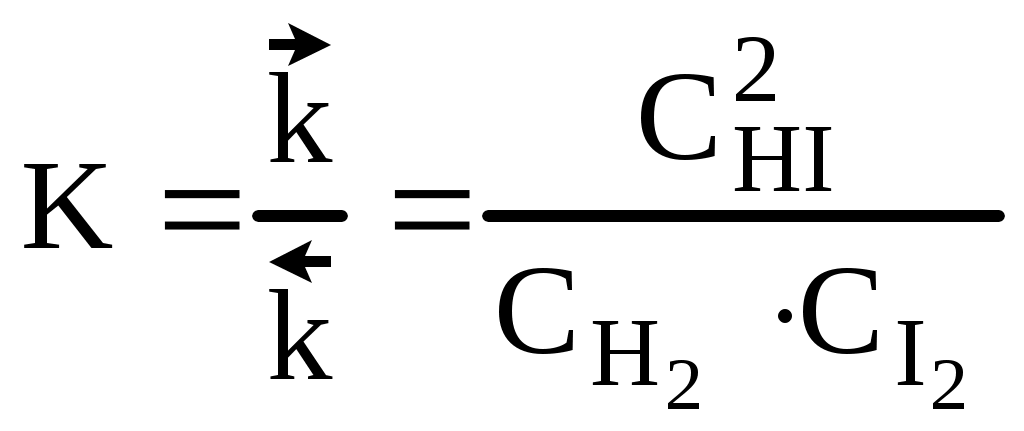 (4) (4)Отношение констант скоростей прямой и обратной реакций называется константой равновесия химической реакции и обозначается К. Константа скорости реакции может быть выражена как через концентрации участников реакции, так и через их парциальные давления. Для того, чтобы подчеркнуть обратимость реакции, вместо знака равенства используют знак обратимости <=>. Для реакций, с участием газообразных веществ, например, как в реакции: N2 (г) + 3H2 (г) <=> 2NH3 (г) константу равновесия лучше выразить через парциальные давления участников реакции. В таком выражении она обозначается КР: 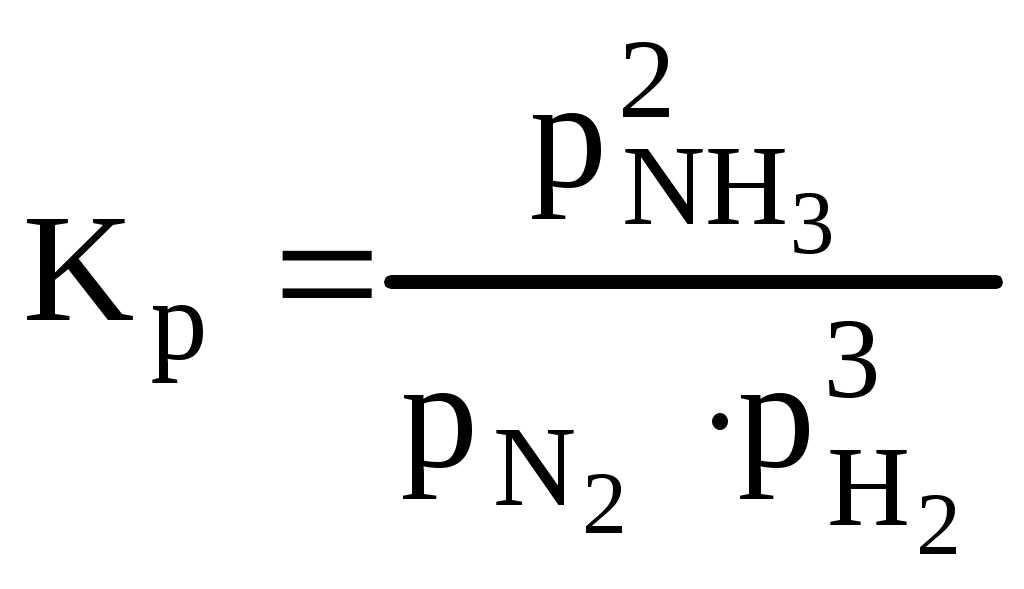 (5) (5)В реакции, где реагирующие вещества жидкости константу равновесия выражают через их молярные концентрации. Реакция взаимодействия этанола с уксусной кислотой – пример обратимой реакции в жидкой среде. С2Н5ОН (ж) + СН3СООН(ж) <=> СН3СООС2Н5 (ж) + Н2О (ж) Константа равновесия, выраженная через молярные концентрации участников реакции, обозначается КС. Молярные концентрации веществ в состоянии равновесия (равновесные концентрации) принято обозначать формулой вещества в квадратных скобках: 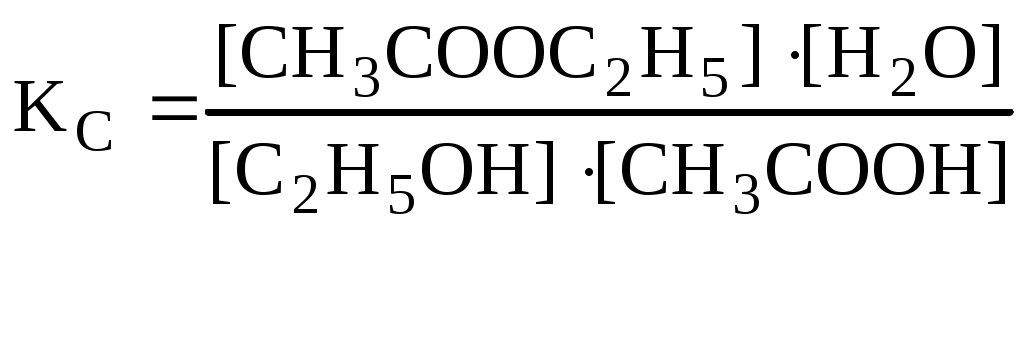 Приведенные выражения для констант равновесия реакций являются примерами общего закона равновесия: Константа равновесия является величиной постоянной при Т = const, равной отношению произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ, в степенях, равных стехиометрическим коэффициентам. т.е. для реакции: аА + вВ = dD+ fF Большинство химических реакции в гомогенных газовых системах или водных растворах протекает с очень большой скоростью, и равновесие устанавливается почти мгновенно. В гетерогенных системах скорость реакции часто бывает невелика, и равновесие устанавливается медленно, иногда за десятки часов. Особенностью гетерогенного химического равновесия является то, что в уравнения констант гетерогенного химического равновесия не входят участвующие в реакции твердые вещества. Так, реакция: Fe2O3 (к) + 3H2 (г) <=> 2Fe(к) + 3H2O (г) включает твердые вещества, поэтому выражение для константы этого равновесного процесса выглядит следующим образом: 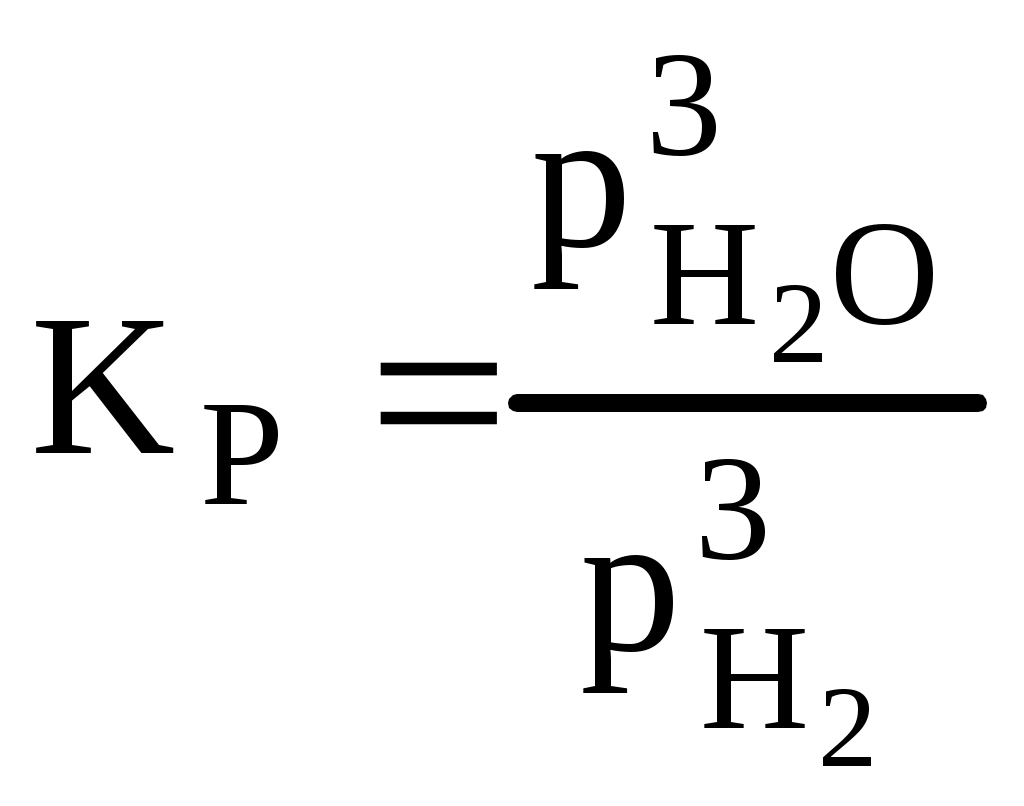 т.е. в выражение для КР включают только газовые молекулы. |
