химия. 05 Скорость и равновесие. Скорость и равновесие основы химической кинетики
 Скачать 319 Kb. Скачать 319 Kb.
|
|
СКОРОСТЬ И РАВНОВЕСИЕ ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ 1. Скорость химических реакций. Средняя и истинная скорость реакций. Кинетикой химических реакций называется учение о скоростях химических реакций и влиянии на них различных факторов. Все реакции можно подразделить на гомогенные (идущие в объеме одной фазы) и гетерогенные (протекающие на поверхности раздела нескольких фаз). Пример гомогенной реакции:: 2H2(г) + О2(г) = 2Н2О(г), К гетерогенным реакциям относят процессы коррозии, твердения вяжущих веществ, горения твердого топлива, и др. C(к) + O2(г) = CO2(г) Скоростью химической реакции называется изменение концентрации вещества за единицу времени в единице объема или на единице поверхности. Для гомогенной химической реакции скорость измеряется изменением концентрации одного из веществ в единицу времени. Если концентрация С выражается в моль/л, а время - в мин или с, то размерность скорости реакции моль/л·с или моль/л·мин. В химической кинетике различают среднюю и истинную скорость (мгновенную). Средняя скорость т.к. скорость реакции всегда является величиной положительной, то знак " - " - ставят в тех случаях, когда скорость реакции рассчитывают по исходным данным вещества, концентрация которых со временем уменьшается (рис. 1). ∆С = С1 - С0 < 0, ∆τ = τ1 - τ0 > 0 С  , моль/л , моль/лгде С0 - исходная концентрация  С0 веществ, во время τ0, С1 - кон- С0 веществ, во время τ0, С1 - кон-центрация веществ в последую- С1 щий момент времени τ1. А знак     а " + " - когда скорость рассчи- а " + " - когда скорость рассчи- тывается по продуктам реакции: тывается по продуктам реакции: ∆С = С1* - С0* > 0. ∆С = С1* - С0* > 0.  τ0 τ1 Время С  , моль/л , моль/лгде С0 - исходная концентрация С1 веществ, во время τ0, С1 - кон- центрация веществ в последую- С2 v щий момент времени τ1. А знак  " + " - когда скорость рассчи- " + " - когда скорость рассчи-тывается по продуктам реакции:    С1 ∆С = С1* - С0* > 0. С1 ∆С = С1* - С0* > 0.  С0 С0τ0 τ1 Время Рис. 1. Изменение концентрации исходных (а) и конечных продуктов реакции от времени. Истинная скорость реакции: 2. Зависимость скорости реакции от концентрации реагирующих веществ. Чтобы реакция имела место, необходимо чтобы произошло столкновение между молекулами. Увеличение числа частиц в объеме приводит к более частым столкновениям молекул, а, следовательно, и увеличению скорости реакции. В 1867 году норвежскими химиками К. Гульдбергом и П. Вааге был сформулирован закон, согласно которому для произвольной гомогенной реакции: mAг + nBг = рСг + qDг (3) при постоянной температуре скорость химической реакции (v), прямо пропорциональна произведению концентраций реагирующих веществ (САи СВ), взятых в степенях, равных стехиометрическим коэффициентам (m и n) в уравнении реакции: V = k∙CmA∙Cn B (4) где: k- коэффициент пропорциональности, называемый константой скорости химической реакции. Это выражение называется законом действующих масс. Константа скорости реакции зависит от тех же факторов, что и скорость данной реакции, а именно: от природы реагирующих веществ, от температуры, от пристуствия катализатора, но не зависит от концентрации исходных веществ, участвующих в реакции. Константа скорости характеризует способность веществ взаимодействовать друг с другом. Физический смысл константы скорости заключается в том, что v = k, если: а) произведение концентраций СА и СВ равно 1 или б) СА = СВ = 1 (моль/л). Реакции, проходящие при одинаковых условиях, можно сравнивать по их константам скорости. Закон действующих масс справедлив только для простых по механизму реакций. Для сложных реакций, протекающих в несколько стадий закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Молекулярность реакции определяется числом молекул, одновременным взаимодействием между которыми осуществляется акт химического превращения. В связи с этим различают реакции: 1. Мономолекулярные: I2 → 2I 2. Бимолекулярные: Н2 + I2 → 2HI 3. Тримолекулярные: 2Н2 + О2 = 2Н2О Молекулярности реакций выше трех не известны. В тех случаях, когда уравнение реакции указывает, что в реакции принимает участие больше молекул, например 4NН3 + 5О2 = 4NО +6Н2О, это означает, что процесс проходит сложным путем: через две или большее число стадий. Однако большей частью любую сложную реакцию можно рассматривать как определенную совокупность последовательно или параллельно сочетающихся простых реакций. В качестве примеров решение задач (1 и 2) уровня А. УРОВЕНЬ А Реакция между веществами А и В выражается уравнением: А(г) + 2В(г) = 2С(г). Константа скорости этой реакции равна 0,1. Начальные концентрации реагирующих веществ 0,1 моль/л.
Уменьшение концентрации вещества А на 0,1 моль/л сопровождается уменьшением концентрации вещества В на 0,2 моль/л, так как исходные вещества реагируют между собой согласно стехиометрическим коэффициентам в уравнении реакции: 1моль А – 2 моль В 0,1 моль А – х моль В х = тогда В связи с уменьшением концентрации реагирующих веществ в ходе реакции скорость реакции уменьшается: Ответ: При уменьшении концентрации вещества А на 0,1 моль/л скорость реакции уменьшилась в 2,37 раза. 2. Как изменится скорость реакции: 2CO(г) + O2(г) = 2CO2(г), если: а) уменьшить давление в системе в 2 раза; б) уменьшить объем системы в 3 раза?
 = k· = k·тогда: б) уменьшение объема в системе в 3 раза равносильно увеличению концентрации реагирующих веществ во столько же раз: тогда: Ответ: а) при уменьшении давления в 2 раза скорость реакции уменьшится в 8 раз; б) при уменьшении объема системы в 3 раза скорость реакции увеличится в 27 раз. 3. Энергия активации. Уравнение Аррениуса. Скорость химической реакции зависит также от температуры Увеличение скорости химической реакции с возрастанием температуры объясняется тем, что молекулы любого вещества движутся с различными скоростями. Поэтому при обычных условиях только часть молекул (незначительная) может преодолеть некоторый потенциальный барьер для осуществления химической реакции, т.е. для разрыва старых и возникновения новых связей. Эта энергия называется энергией активации. Энергию активации можно рассматривать как избыточную энергию, (потенциальный барьер, который необходимо преодолеть, чтобы реакция могла произойти). Энергия системы (рис. 2) в переходном состоянии максимальная, а это значит, что активированный комплекс крайне неустойчив (τ = 10-14 – 10-11 с.). По ходу реакции он превращается в продукты взаимодействия С и D. В рассматриваемом примере средний уровень энергии молекул продуктов реакции Е2 ниже среднего уровня энергии молекул исходных веществ Е1. Это означает, что процесс протекает с выделением энергии (реакция экзотермическая).
рис. 2 Энергетическая диаграмма рис. 3 Энергетическая диаграмма для экзотермической реакции для эндотермической реакции Средний уровень энергии молекул продуктов реакции Е2 может быть выше среднего уровня энергии молекул исходных веществ Е1 (рис.3). Процесс протекает с поглощением энергии из окружающей среды (реакция эндотермическая). Разность Е2 - Е1 равна тепловому эффекту процесса ΔΗ. В 1889 г С.Аррениус показал, что константа скорости реакции связана с температурой уравнением где Т - абсолютная температура, К, А – предэкспоненциальный множитель. Еа - количество дополнительной энергии (кДж/моль), необходимой для перехода системы из исходного состояния в состояние активированного комплекса. А и Еа – постоянные для данной реакции величины. (10) В качестве примера решение задачи (3) уровня А. |




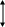 Е'
Е'


 Координата реакции
Координата реакции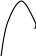
 Е'
Е'