химическая кинетика и катализ. тема 4. химическая кинетика и катализ. Основные понятия и терминология раздела
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНОЛОГИЯ РАЗДЕЛА химическая кинетика изучает механизм протекания химических процессов и их скорость, в то время как термодинамика изучает законы, которые описывают энергетические превращения сопровождающие биол химич и физич процессы. хим реакции делятся на гомог и гетерог гомог - вещества имеют границу раздела между собой и реакция проходит по всему объему; реаг вещества находятся в одном агрегатном состоянии гетерог - вещества имеют границу раздела, реаг вещества находятся в разных агрегатных состояниях скорость реакции ( моль/(л*с) ) определяется изменением концентрации веществ в единицу времени v = | Δc |/Δ t истинная скорость хим реакции - скорость в данный момент времени средняя скорость хим реакции по компоненту - усредненная скорость за некоторое время реакции делятся на простые и сложные: простые или элементарные реакции - реакции проходящие в одну стадию сложными называются реакции протекающие в несколько стадий каждая из которых явл простой реакцией стадии сложных реакций: последовательно параллельно последовательно-параллельно циклически в сложных реакциях скорость стадий может быть разной и определяют скорость сложн реакции по самой медленной - скоростьопределяющей / лимитирующей стадии ФАКТОРЫ ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОМОГЕННЫХ РЕАКЦИЙ на скорость гомог реакций влияют: природа реаг веществ температура конц вещест катализатор закон действующих масс: скорость гомог реакции при пост темп равна произведению конц реаг вещест возведенные в степени численно равные их стехиометрическим коэффициентам: aA + bB = dD + fF v = kca(A)cb(B) это уравнение явл кинетич только для простой реакции константа скорости реакции является индивидуальной характеристикой реакции. Значение константы скорости реакции зависит от природы реагирующих веществ, температуры системы и наличия в ней катализатора. Значение к для данных условий реакции не зависит от концентрации реагентов, и поэтому константа скорости остается неизменной в течение реакции и является ее фундаментальным кинетическим параметром. Значение константы скорости реакции численно равно скорости реакции при концентрациях реагентов, равных моль/ л. константа скорости реакции численно равно скорости реакции при конц реаг веществ равных 1/моль кинетическое уравнение для реакции: v=kcnA(A)cnB(B) где nA и nB - порядок реакции по реагентам А и В соответсвенно порядок реакции по реагенту равен показателю степени, в которую надо возвести конц данного реагента в кинетическом уравнении сложной реакции, чтобы вычисленная по этому уравнению скорость была равна скорости найденной экспериментально влияние температуры на скорость реакции описано в правиле Вант-Гоффа: с увеличением температуры на каждые 10 К скорость реакции увеличивается в 2-4 раза v2=v1 * yT2-T1/10 y - температурный коэффициент реакции показывающий во сколько увеличивается скорость реакции при увеличении температуры на каждые 10 К для обычных реакций у = 2-4, а для ферментативных у = 7-9 теория активных столкновений: - не каждое столкновение приводит к акту химического взаимодействия - к химич взаимод приводят только те столкновения частиц которые обладают энергией необходимой для осуществления хим реакции - при соударении частицы должны относительным образом сориентированы друг от друга энергия активации - это минимальная энергия взаимод частиц необходимая для вступления частиц в реакцию (Еа, кДж/моль) чем меньше энергия активации тем выше скорость реакции уравнение Аррениуса: k = A * e-Еа/RT   катализатор способствует уменьшению энергии активации что приводит к увеличению скорости реакции  многие реакции имеют цепной механизм; для цепных реакций характерны три стадии: - стадия зарождения (образование промежуточных активных частиц) - стадия развития (образование новых активных частиц с а) без разветвления цепи (из одной частицы одна частица), б) с разветвлением (из одной частицы два или более частиц) - стадия обрыва (полностью расходуются активные вещества и цепная реакция обрывается самопроизвольно или под действием ингибиторов)  если Кравн > 1, то в системе выше содержание конечных продуктов, т.е. реакция смещается в сторону продуктов если Кравн < 1, то в системе выше содержание реагентов, т.е. реакция смещается в сторону обратной реакции 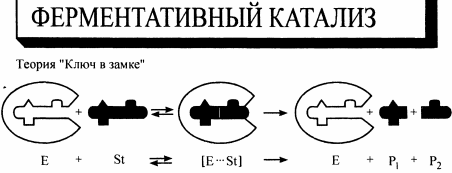 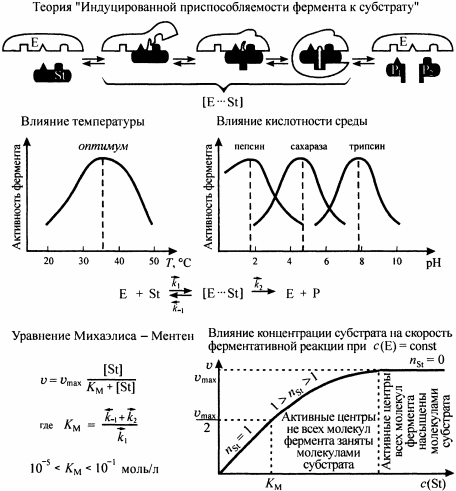 Вопросы для самоконтроля: 1.Дайте понятия истинной и средней скорости, укажите единицы измерения, приведите математическое выражение. а) истинная скорость химической реакции - скорость в данный момент времени (моль/л*с) 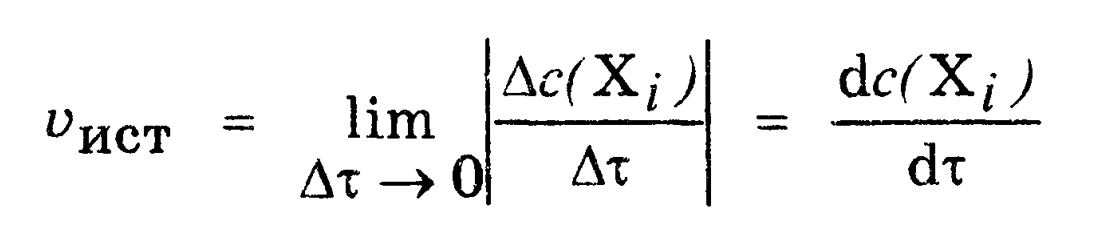 б) средняя скорость хим реакции по компоненту - усредненная скорость за некоторое время (моль/л*с) 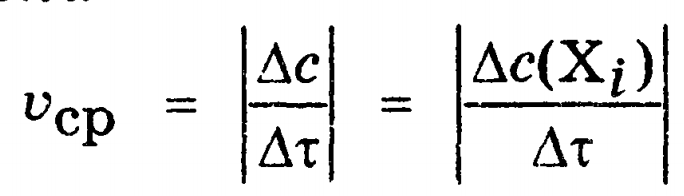 2.Перечислите факторы, от которых зависит скорость химических реакций. Укажите физический смысл величины "к" в ЗДМ. а) скорость химических реакций зависит от температуры, природы реагирующих веществ, концентрации веществ, катализатор б) константа скорости реакции является характеристикой реакции. Значение константы скорости реакции зависит от природы реагирующих веществ, температуры системы и наличия в ней катализатора. Значение к для данных условий реакции не зависит от концентрации реагентов, и поэтому константа скорости остается неизменной в течение реакции и является ее фундаментальным кинетическим параметром. Значение константы скорости реакции численно равно скорости реакции при концентрациях реагентов, равных моль/ л. 3.Приведите закон действия масс, его математическое выражение для мономолекулярных, бимолекулярных реакций. а) закон действующих масс: скорость гомог реакции при пост темп равна произведению конц реаг вещест возведенные в степени численно равные их стехиометрическим коэффициентам математическое выражение для мономолекулярной реакции: aA = bB + cC v = kca(A) математическое выражение для бимолекулярной реакции: aA + bB = dD + fF v = kca(A)cb(B) 4.Сформулируйте правило Вант-Гоффа. Что такое температурный коэффициент? а) правило Вант-Гоффа: с увеличением температуры на каждые 10 К скорость реакции увеличивается в 2-4 раза v2=v1 * yT2-T1/10 б) y - температурный коэффициент реакции показывающий во сколько увеличивается скорость реакции при увеличении темп на каждые 10 К 5.Приведите его значения для ферментативных реакций? для ферментативных у = 7-9 6.Напишите уравнение Аррениуса о зависимости скорости реакции от температуры. уравнение Аррениуса: k = A * e-Еа/RT  7.Что такое энергия активации Е? Дайте понятие энергетического барьера. а) энергия активации это минимальная энергия которую нужно сообщить молекуле, чтобы все частицы вступили в реакцию б) энергетический барьер - это энергия которая необходима молекуле, чтобы вступить в химическую реакцию 8.Напишите кинетические уравнения реакций 0, 1 и 2 порядков. Приведите формулы для расчета величин констант скоростей и периодов полупревращений. а) для реакций нулевого порядка кинетическое уравнение имеет следующий вид: v = k0 t1/2 = c0/2k скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения. б) pеакции первого порядка характеризуются кинетическим уравнением вида: v = kc1(A) период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной t1/2 = ln2/k1 Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества в) Для реакций второго порядка кинетическое уравнение имеет следующий вид: v = k2c(A)c(B) t1/2 = 1/cok 9.Дайте понятия катализа, видов катализа, теорий катализа а) катализ - процесс изменения скорости реакции под действием катализатора б) Катализ может быть положительный (увеличивает скорость реакции) и отрицательный (уменьшает скорость реакции - ингибирование) в) теория ключ в замке - структура активного центра фермента является шаблоном структуры молекулы субстрата теория индуцированной приспособляемости фермента и субстрата - субстрат взаимодействуя с аллостерическим центром фермента вызывает изменение конформации фермента и в то же время в молекуле субстрата происходят некоторые необходимые изменения 10.Приведите строение ферментов, дайте понятие "активных центров" биокатализаторов. Активный центр – это часть молекулы фермента, которая специфически взаимодействует с субстратом и принимает непосредственное участие в катализе 11.Укажите особенности ферментативного катализа. Изложите гипотезу Фишера. а) очень высокая каталитическая активность высокая специфичность действия высокая чувствительность к изменениям рН среды и температуры возможность инактивации фермента б) гипотеза фишера - активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении 13.От каких факторов зависит скорость ферментативных реакций? Скорость ферментативных реакций зависит от многих факторов: природы и концентрации фермента и вещества, температуры, давления, реакции среды и т. д 14.Напишите уравнения Михаэлиса-Ментен, проведите его анализ 15.За счет чего с термодинамической точки зрения ферменты ускоряют процесс? Ферменты с термодинамической точки зрения ускоряют химические реакции за счет снижения энергии активации. 16.Как проявляется термолабильность ферментов? При 100°С почти все ферменты утрачивают свою активность (исключение составляют, очевидно, только один фермент мышечной ткани-миокиназа, которая выдерживает нагревание до 100°С), так как происходит денатурация белка. При низких температурах (0°С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля (снижается кинетическая энергия - EA). На термолабильность ферментов определенное влияние оказывают концентрация субстрата, рН среды и другие факторы 17.Какова зависимость активности ферментов от рН среды? Как выглядит графическая кривая этой зависимости? а) для каждой ферментативной реакции существует оптимальное значение рн среды, причем отклонение рн в любую сторону от этого значения приводит к резкому снижению активности. Зависимость ферментативной реакции от рН определяется кислотно основными свойствами белковой молекулы, а также изменением ее конформации вследствие изменений в ионизации отдельных групп вблизи активного центра б) 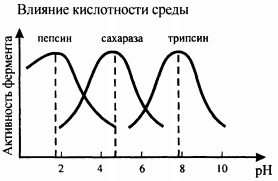 18.Укажите роль активации и ингибирования в ферментативных процессах? Активаторы ферментов – это вещества, увеличивающие скорость ферментативной реакции Ингибиторами называют вещества, вызывающие снижение активности фермента 19.Как используется метод конкурентного торможения в медицинской практике? Например, этиловый спирт используется с лечебной целью как конкурентный ингибитор для лечения отравлений этиленгликолем или метиловым спиртом. |
