Содержание Введение Свойства меди и её соединений 1 Электронное строение 2 Истрия открытия 3 Место рождение меди и нахождение в природе 4 Степени окисления 5
 Скачать 0.5 Mb. Скачать 0.5 Mb.
|
|
Размещено на http://www.allbest.ru/ Содержание Введение 1. Свойства меди и её соединений 1.1 Электронное строение 1.2 Истрия открытия 1.3 Место рождение меди и нахождение в природе 1.4 Степени окисления 1.5 Способы получения 1.6 Свойства простого вещества: физические и химические 1.7 Биологическая роль 1.8 Области применения Заключение Использованная литература Введение Медь – элемент 1В группы Периодической системы, плотность 8,9 г см-3 , один из первых металлов, ставших известными человеку. Считают, что медь начали использовать около 5000 до н.э. В природе медь изредка встречается в виде металла. Из медных самородков, возможно, с помощью каменных топоров, были изготовлены первые металлические орудия труда. У индейцев, живших на его берегах оз. Верхнее (Сев. Америка), где есть очень чистая самородная медь, способы ее холодной обработки были известны до времен Колумба. Около 3500 до н.э. на Ближнем Востоке медь научились извлекать из руд, ее получали восстановлением углем. Медные рудники были и в Древнем Египте. медь окисление получение применение Медь (лат. Cuprum) - химический элемент I группы периодической системы Менделеева; атомный номер - 29, атомная масса - 63,546. По геохимической классификации В.М. Гольдшмидта, медь относится к халькофильным элементам с высоким сродством к S, Se, Te.Один из семи металлов, известных с глубокой древности. Древняя Греция и Рим получали медь с острова Кипра (Cyprum), откуда и название ее Cuprum.В ряду напряжений медь стоит после водорода и при реакции с кислотами не вытесняет из них водород, поэтому медь широко используется в гальванических элементах В организме человека находится от 75 до 150 мг меди. Из них 45% входит в состав мышечной ткани, 20% - в состав клеток печени, еще 20% находится в костной ткани, остальное распределено по всему организму. Медь как художественный материал используется с медного века (украшения, скульптура, утварь, посуда.) 1. Свойства меди и её соединений 1.1 Электронное строение Электронное строение атома Меди 1s22s22p63s23p63d104s1. Атом меди легко отдает внешний электрон, образуя соединения Cu(I). Не все электроны на 3d-оболочке прочно удерживаются ядром, поэтому многие элементы способны оттягивать два электрона от атома меди, образуя устойчивый ион Cu2+. Соединения Cu(II) наиболее распространены и более стабильны, а относительно малый радиус иона и высокий заряд ядра позволяют меди проявлять акцепторные свойства с образованием комплексных ионов, например 2-, имеющего координационную связь. Ионы меди координируют молекулы воды в растворе, образуя стабильный комплексный ион 2+, который и вызывает голубую окраску разбавленных водных растворов соединений меди. 1s2 |2s2 2p6 |3s2 3p6 3d10| 4d1 на 1 слое 2 электрона на 2 слое 8 на 3 слое 18 на 4 слое 1 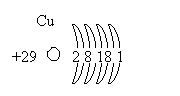  Кристаллическая решетка меди. 1.2 История открытия меди Медь стала известна человеку в каменном веке – некоторые самородки меди, относящиеся к этому времени, носят следы воздействия каменных орудий, в частности у них обрублены выступающие части. Очевидно, эти кусочки меди были использованы доисторическим человеком в качестве украшений, а затем и как орудия. Распространению медных изделий способствовало свойство меди подвергаться ковке в нагретом состоянии. Так обрабатывали медные самородки индейцы еще со времен Колумба. Где и когда был открыт метод выплавки меди из руд неизвестно. Скорее он был открыт случайно. Самородная медь всегда встречалась совместно с рудой. И вот во время нагрева самородка в раскаленных углях костра кусочки медной руды, прилипшие к самородку, тоже превратились в медь – восстановились углеродом: 2CuO+C=2 Cu+CO2 Возможно, первоначально медь выплавлялась в небольших ивовых корзинах, обмазанных толстым слоем глины. В такую своеобразную печь загружали руду вместе с углем и под ней разжигали большой костер. Руды меди часто встречаются совместно с рудами цинка, олова. Такие руды восстанавливаются легче и дают сплавы меди более твердые, чем сама медь. Эти сплавы называются бронзами, а время, в течение которого человек широко использовал бронзу, - бронзовым веком. Название “бронза” произошло от названия небольшого итальянского города Бриндизи, через который среди прочих товаров шла торговля изделиями из сплава меди с оловом. Этот сплав назвали медью из Бриндизи, а затем - бронзой. Изготовление изделий из меди и ее сплавов производилось еще при первых фараонах Египта (4 – 5 тыс. лет до н.э.). Известны древнейшие медные руды на острове Кипр. По-видимому, современное латинское название “купрум” произошло от латинского названия этого острова. Когда же и где была впервые выплавлена медь? Считалось, что люди 9 – 8 тыс. лет назад не умели, как следует, делать керамическую посуду, но в 1950 г. археологами было сделано интересное открытие. В районе реки Конья на юго-западе Малой Азии в 1950 г. производились раскопки. Наряду с каменными орудиями были найдены медные проколки, украшения, колечки. По определениям физиков, использующих радиоуглеродный метод; культурный слой с остатками жизнедеятельности человека возник в VII-VI тысячелетиях до н.э. Этому открытию трудно поверить, но в 1963 г. при раскопках в верховьях реки Тигр были найдены простейшие медные изделия, относящиеся к тому же периоду. Там же нашли и медную руду. 1.3 Место рождение Меди и нахождение в природе Соединения элементов подгруппы меди распределены в земной коре неравномерно, что объясняется различием в геологических условиях, сложившихся в различных местах земного шара. Богатейшие месторождения меди имеются в Конго (Катангский пояс). Материалы, собранные археологами о древнейших месторождениях датируются тысячелетиями до новой эры. Крупнейшие месторождения меди: К сожалению, в мире известно лишь одно действительно очень крупное, уникальное месторождение самородной меди — на южном берегу озера Верхнего (штат Мичиган, США), где залежи меди сосредоточены на полуострове Кивино (более правильная транскрипция — Кьюинау).Месторождение состоит из нескольких разобщенных рудных участков, которые можно даже считать отдельными месторождениями. За 100 лет эксплуатации (с 1854 г.) на этом полуострове было добыто 5 млн. тонн меди; но месторождения озера Верхнего известны были и в древности, в доколумбовой Америке: медь здесь добывали индейские племена — дакоты и гуроны. Рудовмещающими породами являются миндалекаменные базальтовые лавы, богатые пустотами ("газовыми пузырями");базальтовые покровы перемежаются с пластами конгломератов. Самородная медь заполняет миндалины в верхних частях покровов и замещает конгломераты. Залежи меди прослежены по простиранию рудоносной зоны на 10-12 м. Самородная медь редко самородное серебро сопровождаются цеолитами, кальцитом, кварцем, хлоритом,пренитом, гематитом, датолитом, путеллитом, минералом, впервые найденным именно на этом месторождении, — водными силикатами кальция, магния, железа и алюминия, образующимися только в близповерхностных условиях. Весь этот парагенезис свидетельствует о малой глубине формирования и низкотемпературном вулканогенно-гидротермальном происхождении месторождения в условиях резкого дефицита серы (сульфиды отсутствуют в этих рудах начисто. Основная масса меди добывается здесь из базальтов и конгломератов. Близко по условиям образования месторождение самородной меди на острове Ванкувер в Канаде, где самородная медь образовалась в результате переработки слоистых вулканических пород — остывших потоков лавы — гидротермальными растворами. Образование самородной меди, по-видимому, обусловлено ее восстановлением из сульфатных растворов органическим веществом, содержащимся в песчаниках. Интересно, что медь в сульфатных растворах может переноситься довольно далеко от первичных месторождений — до тех пор, пока они не попадут в восстановительную обстановку (например, в среду, богатую органикой), где происходит отложение самородной меди. Значительно реже медь образуется как магматический минерал, например, вкрапления меди обнаружены в полевых шпатах в массиве габбро близ Тосканы (Италия), а также в полевых шпатах, роговой обманке и пироксенах в магматических породах — сиенитахи диабазах в ЮАР и Намибии. Стоит упомянуть, что самородная медь обнаружена и на Луне: зернышки меди в срастании с никелем и трилитом удалось обнаружить в лунном ретолите. Еще раньше медь была найдена в метеоритах.Тем самым медь, подобно железу, никелю, титану, золоту и серебру входит в число элементов, встречающихся не только на Земле, но и на других космических телах. Прежде крупные самородки меди, массой до нескольких тонн встречались и в России, в частности, на Среднем Урале — на ныне исчерпанном Гумешевском руднике. Один из таких самородков (массой 860 кг) находится в музее Горного института в Санкт-Петербурге. Другие крупные самородки из Гумешек хранятся в Москве в музее им. В.И.Вернадского и в Екатеринбурге — в Уральском геологическом музее. Обычными спутниками самородной меди в зоне окисления являются ее оксиды (куприт, тенорит), карбонаты (малахит и азурит) ихризоколла, а также основной фосфат меди — либетенит Сu2(РO4)(ОН) и другие вторичные минералы меди, а также такие обычные в подобной обстановке минералы как гётит, гипс, ярозит. Самые красивые коллекционные образцы самородной меди (кристаллы дендриты) встречаются на территории России в зоне окисления на турьинских медных рудниках (Северный Урал), где их описал еще в 1837 г. Густав Розе. Соединения меди (I) часто встречаются в природных веществах, В минерале куприте содержится оксид Cu2O, в медном блеске (халькозине)-сульфид Cu2S.Среди других природных соединений меди отметим халькопирит (медный колчедан) CuFeS2, ковелин CuS, малахит СuСО2, Сu(ОН)2. 1.4 Степени окисления В соединениях Медь проявляет две степени окисления:+1 и +2.Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т.п) или комплексах [Cu(NO3)2]+.Её соединения бесцветны. Более устойчива степень окисления:+2,которая даёт соли синего и сине-зелёного цвета.В необычных условиях можно получить соединения со степенью окисления +3 и даже +5.Последняя встречается в солях купраборанового аниона Cu(B 11H 11)23-,полученных в 1994году. Соединения меди(I): Степени окисления +1 соответствует оксид CuO2 красно-оранжевого цвета. Соответствующий гидроксид не получен, так как немедленно дегидратируется с образованием осадка. Гидроксид носит основный характер .Многие соединения меди +1 имеют белую окраску или бесцветны. Это объясняется тем, что в ионе Cu+ все пять 3d-орбиталей заполнены парами электронов. Ионы меди(I) в водном растворе неустойчивы и легко диспропорцинируют: 2Cu+ (водн.)→Cu2+(водн.)+Cu(тв.) В тоже время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]-устойчив. Его можно получить, добавляя концентрированную серную кислоту к хлориду меди (I): CuCl(тв.) + Cl-(водн.)→[CuCl2]-(водн.) Свойства меди (I) походи на свойства соединений серебра(I). В частности CuCl, ClBr и CuI нерастворимы. Также существует стабильный сульфат меди (I). Соединения меди (II): Степень окисления +2- наиболее стабильная степень окисления меди. Ей соответствует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет: Cu(OH)2=CuO+H 2O Гидроксид меди носит преимущественно основный характер и только в концентрированной щёлочи частично растворяется с образованием синего гидроксокомплекса: Соли меди (II) образуются при растворении меди в кислотах-окислителях (азотной,конц.серной).Большинство солей в этой степень окисления имеют синюю или зелёную окраску. Медный купорос. Соли меди(II) обладают слабыми окислительными свойствами, что используется в анализе(напр., использование реактива Фелинга). Карбонат меди (II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди.Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4˖5H2O, используется как фунгицид. Оксид меди (II)используется для получения оксида иттрия бария меди(YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Соединения меди(III) и меди (IV). Степени окисления +3 и +4 являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или вроде комплексов. 1.5 Способы получения меди История получения меди: Интересна история получения меди. Уже 5-6 тысяч лет до н.э. медная руда добывалась египетскими рабами в Нубии, на Синайском полуострове. Древнейшая медеплавильная печь найдена на Синайском полуострове. По составу шлака установили, что в этой печи выплавлялась медь. Для улучшения литейных свойств меди греки добавляли в руду оловянный камень (двуокись олова) и получали оловянную бронзу.Искусство получения меди и ее сплавов затем перешло к римлянам. Оловянную руду римляне доставали из Англии, которая в то время называлась Касситеридскими островами. Интересно отметить, что минерал – двуокись олова и по настоящее время называется касситеритом. О методах получения меди в России дает представление небольшой, но обстоятельный труд М.В.Ломоносова “Основание металлургии” (1763 год), который сыграл исключительную роль в развитии металлургического производства. В этой же книги дано описание “сульфатизирующего обжига”. Он заключался в медленном окислении медной сульфидной руды до сульфата меди кислородом воздуха: CuS+2O2→CuSO4 с последующим выщелачиванием соли водой с целью получения медного купороса. Получение меди методом электролиза. Электролиз широко применяют для очистки (рафинирования) меди. Для очистки меди из черновой меди отливают аноды – толстые пластины. Их подвешивают в ванну, содержащую раствор медного купороса. В качестве катодов используют тонкие листы чистой меди, на которые во время электролиза осаждается чистая медь. На аноде происходит растворение меди. Ионы меди передвигаются к катоду, принимают от катода электроны и переходят в атомы: Cu+2+2ē→Cu. Чистая медь оседает на катоде. Примеси, входящие в состав черновой меди ведут себя по-разному. Более электроотрицательные элементы – цинк, железо, кадмий и другие растворяются на аноде. Но на катоде эти металлы не выделяются, так как электрохимическом ряду напряжений они находятся левее меди и имеют более отрицательные потенциалы. Металлотермический метод получения. 3CuO+2Al→Al2O3+3Cu 3Cu+2Fe→Fe2O3+3Cu+Q Пирометаллургический способ получения меди. Поскольку содержание меди не превышает 1.5-2%, их подвергают обогащению, т.е. отделяют соединения меди от пустой породы, применяя флотационный метод. Для этого руду размалывают до тончайшего порошка и смешивают его с водой, добавив в неё предварительно флоторагенты – сложные органические вещества. Они покрывают мельчайшие крупинки соединений меди и сообщают им несмачиваемость. В воду добавляют ещё вещества, создающие пену. Затем через взвесь пропускают сильный поток воздуха. Поскольку частички (крупинки соединений меди) водой не смачиваются, они прилипают к пузырькам воздуха и всплывают наверх. Всё это происходит во флотационных аппаратах. Пену, которая содержит крупинки соединений меди, собирают, отфильтровывают, отжимают от воды и высушивают. Так получают концентрат, из которого выделяется медь. В зависимости от состава руды существует несколько методов её переработки. Сульфидную руду сначала обжигают при свободном токе воздуха для удаления части серы: 2CuS+3O2. Этот обжиг проводят в механических печах, похожих на устройства для обжига серного колчедана. В последнее время начали применять обжиг в кипящем слое. Продукты обжига затем переплавляют совместно с флюсами в отражательной печи. При этом протекает множество химических процессов, например 2CuO+4CuS→3Cu2S+SO2. Пустая порода, часть сульфидов и окислов железа переходит в шлак, а на дне печи скапливается штейн – расплав сульфида меди Cu2S и сульфида железа FeS. Штейн сливают из печи и перерабатывают в конвекторе, который по устройству похож на конвектор для переработки стали. Частичное удаление серы происходит за счет продувки воздуха через расплавленный штейн: 2Cu2S+3O2→2Cu2O+2SO2. Сульфид меди и закись меди дают металлическую черновую медь: Cu 2S+2Cu2O→SO2+6Cu Она содержит около 95-98% меди. При последующей переплавке на поду отражательной печи содержание меди может быть повышено до 99,7%. Дальнейшая очистка меди проводится электролизом. Более просто перерабатывают окисные руды меди, состоящие из закиси меди, окиси меди и карбонатов меди (Cu2O, CuO, CuCO3∙Cu(OH)2). Эти руды обогащения прокаливают с коксом при высокой температуре: 2CuO+C→CO2+2Cu. Добыча и получение солей меди из природных месторождений. Около 15% всех руд меди перерабатывается гидрометаллургическим методом – на измельченную руду действуют растворителем, который переводит медь в раствор. На руды, содержащие оксид меди, действуют разбавленной серной кислотой: CuO+H2SO4→CuSO4+H2O По сравнению со многими другими оксидами, встречающимися в руде, оксид меди растворяется сравнительно хорошо. Выделение металлической меди из раствора проводят электролизом. Если медь находится в руде в виде сульфида, то ее в раствор можно перевести, обрабатывая ее руду раствором сульфата железа: CuSO4+2Fe2SO4→4FeSO4+2CuSO+S Гидрометаллургическомспособеполучения Этот способ используют бедные медные руды, которые подвергают выщелачиванию. Для выщелачивания руду желательно мелко раздробить. Процесс ведется в кучах, а также в деревянных и бетонных чанах. Выщелачивания ведется при помощи растворителей H2S04, Fe (SO4)3, NH4OH и др. Легче всего растворяются окисленные медные руды: CuO + H2SO4→CuSO4 + H2O СuСО3 • Сu(ОН)2 + 2 Н2SO4→2СuSO4 + 3 Н2О +СO2. Сернистые соединения меди выщелачиваются сернокислым железом: Cu2S + 2 Fe2 (SО4)3→2 СuSO4 + 4 FeSO4 + S. При выщелачиваниимедных руд достигается почти полное извлечение меди, что дает возможность перерабатывать даже к бедные окисленные руды. Полученные растворы солей меди при выщелачивании подвергают дальнейшей обработке с целью извлечения меди. Из бедных цттиоров медь добывают методом цементации. В раствор опускают обрезки железа (листы, проволоку). Железо замещает медь в сернокислых солях и медь выделяется в виде металлического мелкого порошка: CuSО4 + Fe→FeSО4 + Cu. Цементационная медь содержит до 70% Сu. Растворы, содержащие большое количество сернокислых солей меди, подвергают электролизу с нерастворимыми постоянными анодами. Катодприменяют обычно из чистой электролитной меди. Электролит содержит 40—60 г/л меди, 10—20 г/л H2SО4. 1.7 Свойства простого вещества Физические свойства: Металлы подгруппы меди, как и щелочные металлы, имеют по одному свободному электрону на один ион-атом металла. Казалось бы, эти металлы не должны особенно сильно отличатся от щелочных. Но они, в отличие от щелочных металлов, обладают довольно высокими температурами плавления. Большое различие в температурах плавления между металлами этих подгрупп объясняется тем, что между ион-атомами металлов подгруппы меди почти нет “зазоров” и они расположены более близко. Вследствие этого количество свободных электронов в единице объема, электронная плотность, у них больше. Следовательно, и прочность химической связи у них больше. Поэтому металлы подгруппы меди плавятся и кипят при более высоких температурах.Металлы подгруппы меди обладают, по сравнению с щелочными металлами, обладают большей твердостью. Объясняется это увеличением электронной плотностью и отсутствием “зазоров” между ион-атомами.Необходимо отметить, что твердость и прочность металлов зависят от правильности расположения ион-атомов в кристаллической решетке.Техническая медь — металл красного, в изломе розового цвета, при просвечивании в тонких слоях — зеленовато-голубой. Имеет гранецентрированную кубическую решетку с параметром а = 0,36074 нм, плотность 8,96 кг/м3 (20° С). Ионные радиусы меди (в нм) приведены ниже: По Белову и Бокио По Гольдшмидту По Полингу Сu+ 0,098 0.095 0.096 Cu2+ 0,80 0,070 ̄ Основные физические свойства меди: Температура плавления, °С 1083 Температура кипения, °С 2600 Теплота плавления, кДж/г-ат. 0,7427 Теплота испарения, кДж/г-ат. 17,38 Удельная теплоемкость, Дж/(г.град) (20°С) 0,022 Теплопроводность, Дж/(м.град.с) (20°С) 2,25-10-3 Электрическое сопротивление, Ом.м (20°С) 1,68-Ю-4 Удельная магнитная восприимчивость, 0,086.10-6 Медь — вязкий, мягкий и ковкий металл, уступающий только серебру высокой теплопроводностью и электропроводностью. Эти качества, а также пластичность и сопротивление коррозии обусловили широкое применение меди в промышленности. Цвет меди и её соединений Чистая медь обладает и другой интересной особенностью. Красный цветобусловлен следами растворенного в ней кислорода. Оказалось, что медь, многократно возогнанная в вакууме (при отсутствии кислорода), имеет желтоватый цвет. Медь в полированном состоянии обладает сильным блеском.При повышении валентности понижается окраска меди, например CuCl – белый, Cu2O – красный, CuCl + H2O – голубой, CuO – черный. Карбонаты характеризуются синим и зеленым цветом при условии содержания воды, чем обусловлен интересный практический признак для поисков. Химические Свойства : Образуя химические соединения, атом может отдавать один, два или три электрона, проявляя степень окисления соответственно +1, +2 и +3. Медь относится к малоактивным металлам. Стандартный электродный потенциал меди равен +0,34 В, что определяет ее место в ряду стандартных электродных потенциалов: оно находится правее водорода. При обычных условиях она не взаимодействует с водой, растворами щелочей, соляной и разбавленной серной кислотой. Eионизации 1 = 7.72 эВ Eионизации 2 = 20.29 эВ Eионизации 3 = 36.83 эВ Отношение к кислороду Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди: 2Cu+O2+H2O+CO2→Cu2(OH)2CO3 В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди: 4Cu+O2→2Cu2O Внешне медь при этом не меняется, так как оксид меди (I) как и сама медь, розового цвета. К тому же слой оксида настолько тонок, что пропускает свет, т.е. просвечивает. По-иному медь окисляется при нагревании, например при 600-800 0C. В первые секунды окисление идет до оксида меди (I), которая с поверхности переходит в оксид меди (II) черного цвета. Образуется двухслойное окисное покрытие. Qобразования (Cu2O) = 84935 кДж. 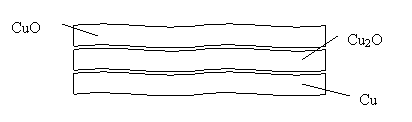 Рисунок . Строение оксидной пленки меди. Взаимодействие с водой Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например: Fe+CuCl2→Cu+FeCl2. Эта реакция окислительно-восстановительная, так как происходит переход электронов: Fe-2ē→Fe2+ Cu2++2ē→Cu0 Молекулярный водород вытесняет металлы подгруппы меди с большим трудом. Объясняется это тем, что связь между атомами водорода прочная и на ее разрыв затрачивается много энергии. Реакция же идет только с атомами водорода. CuSO4+H2→ Cu+H2SO4 Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната: 2Cu+O2+2H2O→2Cu(OH)2 2Cu+O2+H2O+CO2→Cu2(OH)2CO3 Взаимодействие с кислотами Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот.Поэтому соляная и разбавленная серная кислота на медь не действуют. Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей: 2Cu+4HCl+O2→2CuCl2+2H2O Отношение к галогенам и некоторым другим неметаллам Qобразования (CuCl) = 134300 кДж Qобразования (CuCl2) = 111700 кДж CuCl2+2Na→2NaCl+Cu Медь хорошо реагирует с галогенами, дает два вида галогенидов: CuX и CuX2.. При действии галогенов при комнатной температуре видимых изменений не происходит, но на поверхности вначале образуется слой адсорбированных молекул, а затем и тончайший слой галогенидов. При нагревании реакция с медью происходит очень бурно. Нагреем медную проволочку или фольги и опустим ее в горячем виде в банку с хлором – около меди появятся бурые пары, состоящие из хлорида меди (II) CuCl2 с примесью хлорида меди (I) CuCl. Реакция происходит самопроизвольно за счет выделяющейся теплоты. Одновалентные галогениды меди получают при взаимодействии металлической меди с раствором галогенида двухвалентной меди, Например: Cu+CuCl2→2CuCl. Монохлорид выпадает из раствора в виде белого осадка на поверхности меди. Оксид меди . При прокаливании меди на воздухе она покрывается черным налетом, состоящим из оксида меди: 2Cu+O2→2CuO Его также легко можно получить прокаливанием гидроксокарбоната меди (II) (CuOH)2CO3 или нитрата меди (II) Cu(NO3)2. При нагревании с различными органическими веществами CuO окисляет их, превращая углерод в диоксид углерода, а водород – в воду восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода. Под слоем меди расположен окисел розового цвета – закись меди Cu2O. Этот же окисел получается при совместном прокаливании эквивалентных количеств меди и окиси меди, взятых в виде порошков: CuO+Cu→Cu2O. Закись меди используют при устройстве выпрямителей переменного тока, называемых купроксными. Для их приготовления пластинки меди нагревают до 1020-1050 0C. При этом на поверхности образуется двухслойная окалина, состоящая из закиси меди и окиси меди. Окись меди удаляют, выдерживая пластинки некоторое время в азотной кислоте: CuO+2HNO3→Cu(NO3)2+H2O. Пластинку промывают, высушивают и прокаливают при невысокой температуре – и выпрямитель готов. Электроны могут проходить только от меди через закись меди. В обратном направлении электроны проходить не могут. Это объясняется тем, что закись меди обладает различной проводимостью. Гидроксиды меди Гидроксид меди малорастворимое и нестойкое соединение. Получают его при действии щелочи на раствор соли: CuCl2+2NaOH→Cu(OH)2+2NaCl. Это ионная реакция и протекает она потому, что образуется плохо диссоциированное соединение, выпадающее в осадок: Cu2++2OH-→Cu(OH)2↓. Медь, помимо гидроксида меди (II) голубого цвета, дает еще гидроксид меди (I) белого цвета: CuCl+NaOH→CuOH+NaCl Это нестойкое соединение, которое легко окисляется до гидроксида меди (II): 4CuOH+2H2O+O2→4Cu(OH)2. Оба гидроксида меди обладают амфотерными свойствами. Например, гидроксид меди (II) хорошо растворим не только в кислотах, но и в концентрированных растворах щелочей: Cu(OH)2+2HCl→CuCl2+2H2O Cu(OH)2+2KOH→K2[Cu(OH)4] . Таким образом, гидроксид меди (II) может диссоциировать и как основание: Cu(OH)2↔Cu2++OH- и как кислота. Этот тип диссоциации связан с присоединением меди гидроксильных групп воды: Cu(OH)2+2HOH→H2[Cu(OH)4] Сульфаты Наибольшее практическое значение имеет CuSO4∙5H2O, называемый медным купоросом. Его готовят растворением меди в концентрированной серной кислоте. Поскольку медь относится к малоактивным металлам и расположена в ряду напряжений после водорода, водород при этом не выделяется: Cu+2H2SO4→CuSO4+SO2+2H2O Медный купорос применяют при электролитическом получении меди, в сельском хозяйстве для борьбы с вредителями и болезнями растений, для получения других соединений меди. Карбонаты Карбонаты для металлов подгруппы меди не характерны и в практике почти не применяются. Некоторое значение для получения меди имеет лишь основной карбонат меди, который встречается в природе. Комплексообразование Характерное свойство двухзарядных ионов меди – их способность соединятся с молекулами с образованием комплексных ионов. • альдегидом: RCHO + 2Cu(OH)2 = RCOOH + Cu2O + 2H2O; • кислотой: Cu(OH)2 + 2H+ = Cu2+ + 2H2O; • аммиаком: Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2; Качественные реакции на ионы меди Ион меди можно открыть, прилив к раствору ее соли раствор аммиака. Появление интенсивного сине-голубого окрашивания связано с образованием комплексного иона меди [Cu(NH3)4]2+: CuSO4+4NH4OH→[Cu(NH3)4SO4+4H2O Медь интенсивно окрашивает пламя в зеленый цвет. 1.8 Биологическая Роль меди Медь является одним из важнейших эссенциальных (жизненно-необходимых)микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов и ферментов. При отсутствии или недостатке меди в растительных тканях уменьшается содержание хлорофилла, листья желтеют, растение перестает плодоносить и может погибнуть. Чаще всего медь вносят в почву в виде пятиводного сульфата – медного купороса CuSO4∙5H2O. В значительных количествах он ядовит, как и многие другие соединения меди, особенно для низших организмов. Польские ученые установили, что в тех водоемах, где присутствует медь, карпы отличаются крупными габаритами. В прудах и озерах, где нет меди, быстро развивается грибок, который поражает карпов. В малых же дозах медь совершенно необходима всему живому. Медь высшим животным нужна как стимулятор кроветворения и находится в некоторых органах и тканях в заметных количествах, например, в печени - до 2 мг%, в крови - 0,25 мг%. Стимуляция кроветворения медью используется при лечении поросят, больных анемией. Медь входит в состав простатических групп растительных оксидаз и цитохромоксидазы, полифенолоксидазы, аскорбинатоксидазы животных. Она способствует связыванию токсинов. Медь активизирует процессы свободного окисления в тканях, стимулирует некоторые гормоны гипофиза, влияет на процессы размножения. Она катализирует включение железа в структуру гема, регулирует созревание эритроцитов, нормализует обмен кальция и фосфора. Медь необходима для нормальной кератинизации пера и нормализации эмбрионального развития. Биологическая роль:является компонентом многих ферментов, обладающих окислительно-восстановительной активностью участвует в метаболизме железа повышает усвоение белков и углеводов принимает участие в обеспечении тканей кислородом участвует в формировании соединительной ткани, росте костей поддерживает структуру костей, хрящей, сухожилий поддерживает эластичность стенок кровеносных сосудов, альвеол, кожи обладает выраженным противовоспалительным свойством, в т.ч. при аутоиммунных заболеваниях (например, ревматоидного артрита) участвует в образовании гемоглобина и созревании эритроцитов Применение:Перечисленные выше характерные свойства меди обусловливают многочисленные области ее применения. Основными потребителями меди и ее соединений являются: 1) электротехника и электроника (провода, кабели, обмотки электродвигателей, токопроводящие шины, детали радиоэлектронных приборов, печатные схемы и др.); 2) машиностроение (теплообменники, опреснительные установки и др.); 3) транспорт (детали и узлы железнодорожных вагонов, автомобилей, самолетов, морских и речных судов, тракторов и др.); 4) магнитогидродинамические генераторы; 5) ракетная техника; 6) строительные материалы (кровельные листы, детали декоративных архитектурных украшений); 7) химическая промышленность (производство солей, красок, катализаторов, ядохимикатов и др.); 8) изделия и приборы бытового назначения; 9) сельское хозяйство (для защиты растений от болезней и вредителей, например медный купорос CuSO4 5Н2О). Для промышленно развитых стран потребление меди характеризуется следующими примерными цифрами,% от общего потребления Заключение Вот и подошла к концу моя работа. Подвести какие-либо итога довольно трудно. Медь использовалась, используется и, скорее всего, будет использоваться до тех пор, пока её ещё возможно будет добывать. Потому как запасы полезных ископаемых уменьшаются с каждым днём, даже с каждым часом. Мне кажется- Скоро. К сожалению. Написав курсовую работу поэтому элементу, я много узнала для себя интересного и познавательного. Ту информацию, которую я прочитала в книжках, в методических пособиях мне очень помогут в летней сессии. Медь - жизненно важный элемент. Главный металл электротехники. Один из самых важных, самых древних и самых популярных металлов. Популярных не только в среде инженеров – конструкторов, электриков и машиностроителей, но и у людей гуманитарных профессий – историков, скульпторов, литераторов. Список литературы 1. Подчайнова В.Н., Медь, (М., Свердловск: Металургиздат, 1991. – 249с.); 2. Смирнов В. И., Металлургия меди и никеля, (М., Свердловск , 1950. – 234с.); 3. Газарян Л. М., Пирометаллургия меди, (М., 1960. – 189с.); 4.Карякин Ю.В., Ангелов И.И. «Чистые химические вещества», Издательство «Химия», Москва, 1974 г. 5.Реми Г. «Курс неорганической химии» том 1. Издательство «Химия», Москва 1967 г. 6.Г.Смит. Драгоценные камни. М., «Мир», 1980 7.Здорик Т.Б., Фельдман Л.Г. Минералы и горные породы, т. 1. М, «ABF», 1998г. 8.Л.Ф.Попова. От лития до цезия. М., “Просвещение”, 1972. 9.В.Е.Лунев. Познакомьтесь с медью. М.,”Металлургия”, 1965. 10.Отв. за ред. Л.К.Иугалин. Химия минералов меди. Новосибирск, “Наука”, 1975г. 11.Справочный сайт о химии – http://www.wikipedia.ru /, http://www.xumuk.ru/ |
