Кейс-технологии на уроке. Кейс-технологии на уроках химии.. Современные образовательные технологии (кейс метод) на уроках химии
 Скачать 372.19 Kb. Скачать 372.19 Kb.
|
|
Тип кейса: обучающий Задание: Содержание кейса Та история простая… Джозеф Пристли, как- то раз окись ртути нагревая, обнаружил странный газ. Газ без цвета, без названья. Ярче в нем горит свеча. А не вреден для дыханья? (Не узнаешь у врача!) Новый газ из колбы вышел – никому он не знаком. Этим газом дышат мыши под стеклянным колпаком. Человек им тоже дышит. Джозеф Пристли быстро пишет: «Воздух делится на части». (Эта мысль весьма нова). Здесь у химика от счастья и от воздуха отчасти (от его важнейшей части) закружилась голова… Кошка греется на крыше. Солнца луч в окошко бьет. Джозеф Пристли с ним две мыши Открывают КИСЛОРОД. Задания: Проанализируйте стихотворение и ответьте на вопросы. 1. Какой газ обнаружил Д. Пристли, нагревая оксид ртути? 2. Опишите его физические свойства. 3. Почему способ получения кислорода методом Д. Пристли в данное время потерял актуальность? 4. Назовите способы получения кислорода в настоящее время. 5.Назовите составные части воздуха. 6. Заполните таблицу. Информационный материал Открытие кислорода. В конце XVIII в. английский ученый Д. Пристли занимался нагреванием разных веществ, собирая солнечные луч при помощи увеличительного стекла. Когда он накаливал таким образом оксид ртути (II) HgO - в приборе, и 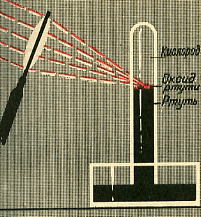 зображенном на рисунке, выделилось много газа. Сначала Д. Пристли подумал, что это воздух. Но когда он опустил в сосуд с собранным газом горящую свечу, то увидел нечто необычное. "Меня поразило,- писал Д. Пристли, - больше, чем я мог выразить, что свеча в этом газе горела замечательно блестящим пламенем". зображенном на рисунке, выделилось много газа. Сначала Д. Пристли подумал, что это воздух. Но когда он опустил в сосуд с собранным газом горящую свечу, то увидел нечто необычное. "Меня поразило,- писал Д. Пристли, - больше, чем я мог выразить, что свеча в этом газе горела замечательно блестящим пламенем".Д. Пристли поместил одну мышь в сосуд с обыкновенным воздухом, а другую в такой же сосуд с полученным им газом. Первая мышь быстро задохнулась, а вторая в это время еще чувствовала себя хорошо и оживленно двигалась. Д. Пристли и сам пробовал дышать полученным газом и нашел, что им дышится легко и приятно. Характеристика элемента. Химический знак элемента - О, относительная атомная масса равна 16. Кислород - самый распространенный химический элемент на поверхности земного шара. В свободном состоянии (в виде простого вещества) содержится в воздухе, в связанном - в воде Н2О, а также входит в состав горных пород и минералов. На кислород приходится почти половина массы земной коры, гидросферы и атмосферы. Характеристика простого вещества кислород. Кислород О2 - бесцветный газ, не имеет запаха и вкуса, малорастворим в воде. Немного тяжелее воздуха: (относительная плотность по воздуху вычисляется отношение молекулярной массы газа к молекулярной массе воздуха, которая равна 29. Для кислорода получаем :32:29 = 1,1...Значит, он тяжелее воздуха в 1,1... раз.). При давлении 101,3 кПа и температуре -1830 С кислород переходит в жидкое состояние. Жидкий кислород - подвижная жидкость голубого цвета. Получение кислорода в лаборатории. Дж. Пристли получал этот газ из соединения, название которого — меркурий (II) оксид. Ученый использовал стеклянную линзу, с помощью которой фокусировал на веществе солнечный свет. При нагревании меркурий(II) оксид (порошок желтого цвета) превращается в ртуть и кислород. Ртуть выделяется в газообразном состоянии и конденсируется на стенках пробирки в виде серебристых капель. Кислород собирается над водой во второй пробирке. Соответствующее химическое уравнение: 2HgO = 2Hg + O2↑ Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании. Для получения кислорода в лаборатории используют: • калий перманганат KMnO4 (бытовое название марганцовка; вещество является распространенным дезинфицирующим средством) • калий хлорат KClO3 (тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала XIX в. К.-Л. Бертолле) Небольшое количество катализатора — оксида MnO2 — добавляют к к хлорату калия для того, чтобы разложение соединения происходило с выделением кислорода. Кислород может находиться в атмосфере (21% по объему), в земной коре (47% по массе), в живых организмах (65% по массе), в гидросфере (89% по массе). В целом 99,99% кислорода «связано» в виде соединений, 0,01% - свободное простое вещество-газ кислород. Кажется, это очень небольшое количество, но на самом деле на 0.01% приходится 1,5*1015 тонн! Весь свободный кислород образуется на планете благодаря зеленым растениям. «Связывание» кислорода происходит в результате дыхания (живая природа) и горения (неживая природа). Таблица «Характеристика кислорода».
Сергеева Нина Александровна, Мелехинский филиал МКОУ «Защитенская СОШ» Щигровского района Тарасова Ольга Витальевна, ОБОУ СПО «КАТК» ,г.Курск. Лашина Валентина Дмитриевна, МКОУ «Сеймицкая СОШ» Солнцевского района Урок по химии по теме КОРРОЗИЯ МЕТАЛЛОВ 9 класс Тип кейса: обучающий Задание: Содержание кейса В начале XX века из Нью-Йоркского порта вышли в открытый океан красавица-яхта. Её владелец, американский миллионер, не пожалел денег, чтобы удивить свет. Корпус был сделан из очень дорогого в то время алюминия, листы которого скреплялись медными заклепками. Это было красиво-сверкающий серебристым блеском корабль, усеянный золотистыми головками заклепок! Однако через несколько дней обшивка корпуса начала расходиться, и яхта пошла быстро ко дну. Задания. 1. Что же случилось с яхтой? Предложите свой способ спасения яхты. 2.Исследуйте свою квартиру, дом и установите, где использованы антикоррозионные покрытия. Постройте классификацию антикоррозионных покрытий на основании областей их применения. 3. Найдите дополнительную информацию о коррозии и способах борьбы с ней. 4. Отчет о проделанной работе предоставить в произвольной форме. Информационный материал Коррозией металлов называется их разрушение вследствие химического или электрохимического взаимодействия с внешней средой. Химической коррозией называется процесс разрушения металлов без электрического тока, происходящий в среде сухих газов или в жидкостях, не проводящих электрический ток. Химической коррозии подвергаются поверхности корпусных конструкций при соприкосновении с перевозимыми нефтепродуктами, солью, углем и другими минералами. Наибольшие коррозионные разрушения наблюдаются на танках, вмещающих светлые сорта нефтепродуктов — бензины, керосины и т. п.,— от воздействия на металл корпуса сернистых соединений и различных кислотных остатков, входящих в их состав. Электрохимической коррозией является процесс разрушения металла при соприкосновении его с жидкостями, проводящими электрический ток (электролитами). Это разрушение происходит на границе между металлом и жидкостью и вызвано электрохимической реакцией, возникающей между ними, аналогично явлению, протекающему в гальваническом элементе. Таким электролитом по своему химическому составу является морская вода. Металлический же корпус судна, представляющий собой неоднородный по структуре материал, образует большое количество микрогальванических пар, являющихся анодами, с участков которых металл, корродируя, переходит в раствор. В судостроении наибольшие потери металлов от корродирования происходят вследствие электрохимической коррозии, влияние на которую оказывает состав морской воды (наличие в ней солей и содержание кислорода). Известно, что введение, например, в сталь легирующих элементов повышает ее антикоррозионную стойкость. Рассматривая коррозионные разрушения корпуса, можно обнаружить следующую закономерность: наибольшему разрушению подвергается наружная обшивка корпуса в районах грузовой ватерлинии и действия гребных винтов, верхняя палуба у бортов, концевые поперечные переборки, палубы трюмов в районе льял, сварные швы и головки заклепок. Методами борьбы с коррозией корпуса судна являются: выбор металла, обладающего наибольшей коррозионной стойкостью в определенных условиях эксплуатации судна; применение легированных сталей; нанесение на поверхность металла различных покрытий — гальванизация, металлизация и плакирование металлом (цинком, никелем, хромом и др.), лакокрасочные покрытия и установка электрохимической (катодной и протекторной) защиты, а также исключение контактов стальных конструкций с деталями из других сплавов, в первую очередь с цветными металлами. Наиболее эффективным способом борьбы с коррозией судового корпуса является электрохимический способ, заключающийся в установке в районе предполагаемого коррозионного разрушения проекторов — металлических накладок из магниево-алюминиевого сплава или цинка, электрический потенциал которого ниже потенциала защищаемого металла. Этот способ основан на разнице электрических потенциалов металла (катода), подвергающегося коррозии, и протектора (анода). Кроме коррозионного разрушения, на наружной обшивке в районе гребных винтов наблюдаются внешне схожие разрушения металла в виде скопления на поверхности углублений и язвочек. Такое разрушение называется эрозией металла. Эрозия металла происходит от механического воздействия на поверхность металла быстродвижущихся частиц жидкостей, песчинок твердых тел, взвесей, газовых пузырьков и т. п. Интенсивность эрозионного разрушения зависит от однородности структуры и твердости металла. Для увеличения эрозионной стойкости в металл корпуса вводят легирующие компоненты, повышающие его прочность и антикоррозионную стойкость, производят поверхностное упрочение, закалку и проводят другие мероприятия. Коррозия приводит к большим объемам корпусных ремонтных работ. Обрастание корпуса и коррозия требуют периодических работ для уменьшения шероховатости наружной обшивки. Химическая коррозия (окисление) характерна для незащищенных надводных стальных конструкций. Более опасна электрохимическая коррозия, сущность которой состоит в следующем: при размещении в электролите двух элементов с разными электрическими потенциалами между ними начинает протекать электрический ток от элемента с более низким потенциалом (анода) к элементу с более высоким потенциалом (катоду). Процесс сопровождается разрушением анода. Морская вода является электролитом, стальная наружная обшивка корпуса - анодом, а ее окалина, разнородные шлаковые и газовые включения, бронзовые гребные винты, втулки дейдвудных подшипников и др. катодом. Наиболее интенсивно распространяется электрохимическая коррозия по наружной обшивке в районе переменной ватерлинии, у кормового подзора, в местах установки донной арматуры, в районе сварных швов. Усиленно коррозируют якорные цепные ящики, льяла, двойное дно, ватервейс, настилы под деревянными покрытиями и у комингсов люков, прачечные, душевые и т. п. Для защиты наружной обшивки от коррозии и обрастания применяют противообрастающие покрытия, которые можно разделить на четыре группы: обычные, долгосрочные, самовосстанавливающиеся и само полирующиеся. Обычные покрытия типа ХВ-53 работоспособны в течение 12-14 мес, долгосрочные - 16-24 мес, самовосстанавливающиеся - 2,5-5 лет, само полирующиеся покрытия (СПК), основанные на медленно растворяющихся в воде органических акриловых сополимерах (выделяющих при этом токсичные вещества) и образующие пленку повышенной гладкости, до 30 мес. К само полирующимся относится покрытие "Хидрон", которое набухает, поглощая до 70-80 % воды от своей массы, и сглаживает поверхность. В последние годы разработано много устройств ультразвуковой защиты от обрастания, заставляющих обшивку корпуса слабо вибрировать, что не позволяет морским организмам и водорослям прикрепляться к ее поверхности. Для уменьшения коррозии цистерн в балластную воду и некоторые нефтепродукты добавляют специальные ингибиторы (замедлители), отдельные конструкции и узлы, трубопроводы выполняют из нержавеющей стали, поверхности определенных деталей оксидируют для образования прочной и плотной пленки окислов (обычно применяют фосфатирование). При протекторной защите к наружной обшивке корпуса на приварных шпильках крепят изготовленные из сплавов на алюминиевой основе протекторы, являющиеся по отношению к обшивке анодом. Радиус действия протекторов ограничен. Более эффективна катодная защита, при которой в определенных районах наружной обшивки на изолированном стеклопластиком участке крепят железокремниевые или платинотитановые экраны. Положительный полюс судового источника постоянного тока подводят к экрану (анод), отрицательный - к корпусу судна (катод). Защиту многих деталей, трубопроводов от коррозии обеспечивают цинкованием, хромированием и т. п. В последнее время получила распространение профилактическая и преддоковая очистка корпусов судов под водой. В первом случае удаляется только обрастание, а во втором - вместе с обрастанием снимается и старая краска. Сущность очистки с помощью механического очистного органа заключается в воздействии на очищаемую поверхность пучков стальных проволок, шарошек, пластинок, скребков, ударников, которые подвергают наслоения удару, срезанию, царапанию, рыхлению и частичному заглаживанию. Наиболее распространенными средствами механизации очистки на отечественных заводах являются агрегаты с механическим рабочим органом в виде щеточных и шарошечных барабанов. Создание эффективных и надежных дробеструйных и дробеметных агрегатов с замкнутым циклом регенерации дроби требует серьезной конструкторско-технологической проработки. Получил распространение гидродинамический способ, использующий подаваемую под давлением воду в качестве средства очистки и повышающий качество очистки. Эффективность очистки повышается за счет совместного использования динамического и кавитационного воздействия высоконапорной затопленной струи воды на обрабатываемую поверхность. При истечении высоконапорной затопленной (при подводной очистке) струи из насадки со скоростью 32 м/с и более при давлении 0,6 МПа и более образуется кавитационная зона, заполненная выделившимися из жидкости в процессе ее расширения газами и парами. Практическое использование ряда напряжений Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе: Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении. Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот - неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой. Металлы, стоящие в ряду правее водорода, с водными растворами кислот - неокислителей при обычных условиях не взаимодействуют. При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Доброногова Татьяна Александровна, МКОУ «Малолокнянская СОШ» Суджанского района Ельникова Наталья Васильевна, МКОУ «Борковская ООШ» Суджанского района Дьяконова Нина Геннадьевна, МКОУ «Бобровская ООШ» Поныровского района 1 вариант Урок по химии по теме ЖИРЫ (базовый уровень) 10 класс |
