Процессы и аппараты. Способы кристаллизации
 Скачать 54.55 Kb. Скачать 54.55 Kb.
|
|
ВВЕДЕНИЕ Под кристаллизацией понимают процесс образования кристаллов при переходе вещества из термодинамически менее устойчивого состояния в более устойчивое, сопровождающийся выделением энергии - энтальпии кристаллизации. Процесс, как правило, протекает в среде переохлажденного пара или жидкости и является фазовым переходом вещества из нестабильного некристаллического состояния в стабильное кристаллическое. Наиболее термодинамически устойчивой структурой является монокристалл, формирование которого обычно затруднено и требует специальных технологических усилий. Поэтому реальной практически достижимой структурой является поликристаллическая, находящаяся в менее термодинамически устойчивом состоянии, нежели монокристалл. При теоретическом рассмотрении процесса кристаллизации различают две его независимые стадии: зародышеобразование и рост кристаллов. Зародышеобразование по механизму возникновения первичного зародыша делят на гомогенное (самопроизвольное зарождение зародышей путем случайного, флуктуационного соединения многих молекул или групп молекул при тепловом движении их в растворе или расплаве) и гетерогенное (ограничение подвижности молекул и образование зародышей индуцируется внесением извне в раствор или расплав, например, коллоидных частиц, способных адсорбировать на себе кристаллизуемое вещество). СПОСОБЫ КРИСТАЛЛИЗАЦИИ Кристаллизация - это образование новой твердой фазы, выделяющейся из раствора, расплава или пара. Кристаллизация из раствора служит средством выделения из них целевых продуктов или загрязняющих примесей, то есть является методом разделения и очистки веществ. В технологии неорганических веществ преимущественно используется кристаллизация из растворов. Образование твердой фазы может происходить только в растворах, в которых концентрация кристаллизующегося вещества превышает концентрацию насыщения, то есть из пересыщенных растворов. Насыщенный раствор, находящийся в контакте с выделившейся кристаллической массой или оставшийся после ее удаления, называется маточным раствором. Пересыщение раствора характеризуется его абсолютным значением, то есть разностью х/- х0между концентрацией пересыщенного х/и насыщенного х0растворов, или относительным пересыщением х/- х0)/ х0. Способы кристаллизации различаются прежде всего приемами, с помощью которых достигается пересыщение раствора. 1) Политермическая или изогидрическая кристаллизация идет при неизменном содержании воды в системе. Она характерна для веществ, растворимость которых при повышенных температурах заметно превышает их растворимость при более низких температурах, и происходит путем охлаждения пересыщенных растворов. Пересыщение зависит от переохлаждения раствора, то есть от разности температур насыщенного и пересыщенного растворов. Если растворимость уменьшается при повышении температуры, кристаллизация будет идти при нагревании системы. 2) Изотермическая кристаллизация происходит путем удаления растворителя из системы (испарении воды) при постоянной температуре, она характерна для веществ, мало изменяющих свою растворимость при изменении температуры. Испарение воды может производиться интенсивным способом при кипении раствора или при медленном поверхностном испарении. 3) Высаливание- кристаллизация соли может быть достигнута введением в раствор веществ, уменьшающих ее растворимость. Таковыми являются вещества, содержащие одинаковый с данной солью ион, ил связывающие воду. Например, кристаллизация хлорида натрия из концентрированного раствора при добавлении к нему хлорида магния; кристаллизация сульфата натрия при добавлении к его раствору спирта или аммиака. Механизм высаливания может быть различным. При добавлении к раствору электролита другого электролита с одноименным ионом произведение концентраций ионов растворенного вещества может превысить его произведение растворимости, то есть произведение концентраций этих ионов в насыщенном растворе, при этом избыток вещества выделяется в твердую фазу. В других случаях высаливание происходит вследствие изменения структуры раствора - образование гидратных оболочек вокруг частиц высаливающего вещества за счет разрушения таких оболочек у растворенного вещества. Соли, образующие кристаллогидраты, особенно с большим числом молекул воды, высаливаются сильнее, чем соли, кристаллизующиеся в безводной форме. Некоторые добавки могут приводить к высаливанию вещества, то есть увеличению его растворимости. 4) Осаждение веществ из растворов с помощью реагентов- наиболее распространенный метод кристаллизации в химической промышленности. Если при этом образуется практически нерастворимый продукт реакции, он сразу осаждается из быстро пересыщающегося раствора. Если продукт реакции растворим, его кристаллизация начинается после достижения необходимого пересыщения и продолжается по мере подачи реагента (осадителя). Примером может служить осаждение нерастворимого карбоната кальция при конверсии нитрата кальция в нитрат аммония: Са(NO3)2+(NH4)2CO3=CaCO3+2NH4NO3. Для получения катализаторов широко применяют осаждение металлов в виде нерастворимых соединений (гидроксидов, карбонатов, оксалатов и других солей) с последующим их разложением до оксидов. 5) Вымораживание применяется преимущественно для выделения отдельных компонентов из естественных рассолов, например соленых озер, при этом кристаллизацию проводят охлаждением растворов до температуры ниже 0С. Способ вымораживания используется для концентрирования растворов путем частичного удаления из них растворителя в виде льда. В этом случае кристаллизуется не соль, а растворитель - вода. Концентрируя морскую воду вымораживанием льда, получают 8% раствор соли, который используется для получения хлорида натрия. ПОЛИТЕРМИЧЕСКАЯ КРИСТАЛЛИЗАЦИЯ Растворимость большинства веществ уменьшается с понижением температуры. Поэтому при охлаждении горячих растворов возникает пересыщение, обусловливающее выделение кристаллов. Этот метод также получил название изогидрической кристаллизации, поскольку при его осуществлении количество растворителя (например, воды) остается постоянным. 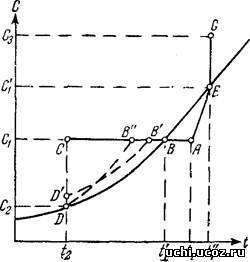 Рис. 1. К пояснению методов кристаллизации (см. текст). На диаграмме растворимости (рис. 1) охлаждение горячего ненасыщенного раствора, имеющего температуру t1 и концентрацию C1 (точка А), до конечной температуры t2 условно можно изобразить линией АС, которая пересекает кривую растворимости в точке В, характеризующей насыщенное состояние раствора при температуре t1'. Если кристаллизация раствора начинается только после его охлаждения до температуры t2, при которой и заканчивается полное снятие пересыщения, то процесс кристаллизации изобразится линией CD, а конечное состояние раствора—точкой D на кривой растворимости, соответствующей равновесной концентрации C2. В том случае, если раствор не способен к образованию сколько-нибудь заметного пересыщения, процесс его охлаждения и кристаллизации изобразится линией АВD. В зависимости от скорости охлаждения раствора и его способности образовывать пересыщение реальный процесс может протекать также по линиям AB'D'D или AB"D. ИЗОТЕРМИЧЕСКАЯ КРИСТАЛЛИЗАЦИЯ Перевод исходного раствора, характеризуемого точкой А (см. рис. 1), в пересыщенное состояние можно осуществить и за счет частичного удаления растворителя при выпаривании раствора. Такой метод получил название изотермической кристаллизации, так как выпаривание насыщенного раствора происходит при постоянной температуре его кипения. Изменение концентрации исходного ненасыщенного раствора при выпаривании изобразится линией AEG, которая показывает, что с повышением концентрации раствора соответственно возрастает и его температура кипения. Только после перехода раствора в насыщенное состояние при концентрации С1' (точка Е) температура уже больше не меняется и остается равной t1''. Понятно, что приведенное выше изображение процесса кристаллизации по линии AEG на диаграмме растворимости является условным, и точка G характеризует лишь общее пересыщение раствора, которое может быть получено при удалении из него определенной части растворителя. В большинстве случаев кристаллизация раствора при выпаривании протекает при постоянной концентрации, очень близкой к состоянию насыщения для данной температуры t1''.
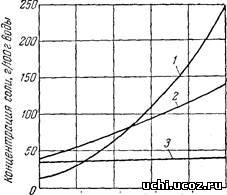
Выбор того или иного метода кристаллизации зависит, в первую очередь, от характера изменения растворимости вещества при различной температуре. Для солей, растворимость которых резко уменьшается с понижением температуры, целесообразной является изогидрическая кристаллизация. В этом случае даже при сравнительно небольшом охлаждении раствора из него будет выделяться значительное количество соли (см. кривую растворимости KNO3 на рис. 2). Именно изогидрической кристаллизацией получают большинство солей с резко выраженной прямой растворимостью (NaNO3, К2Сr2О7, NH4C1, CuS04-5H20 и др.). Рис. 2. Кривые растворимости в воде КNО3 (1), Ва(NО3)2 (2) и NaCl (3). В тех случаях, когда растворимость соли почти не меняется при изменении температуры, кристаллизация охлаждением становится неэффективной и применяется изотермическая кристаллизация Кривая растворимости, например NaCl (см. рис.2) показывает, что при охлаждении насыщенного раствора из него выпадает лишь очень небольшое количество соли, поэтому кристаллизация NaCI проводится всегда выпариванием. Изотермическая кристаллизация применяется также для солей с обратной растворимостью, например для Na2S04, растворимость которого, начиная с 32,4° С, уменьшается с повышением температуры. Для кристаллизации солей с резко выраженной обратной растворимостью иногда используют просто нагревание раствора до высоких температур. Так, например, получают безводный кристаллический сульфит натрия Nа2S0з и сульфат марганца MnS04. На практике в ряде случаев комбинируют рассмотренные выше методы создания пересыщения. Так, при вакуум-кристаллизации раствор охлаждается за счет адиабатического испарения части растворителя. Этот метод кристаллизации особенно эффективен для солей, растворимость которых сравнительно плавно уменьшается с понижением температуры, например для КС1 (см. рис. 2), (NH4)2S04, FeS04-7H20 и др. Частичное испарение растворителя характерно и для некоторых кристаллизаторов охладительного типа, например, для башенных кристаллизаторов, барабанных с воздушным охлаждением, качающихся и др. КРИСТАЛЛИЗАЦИЯ ВЫСАЛИВАНИЕМ При добавлении к раствору вещества, понижающего растворимость выделяемой соли, можно вызвать пересыщение раствора и кристаллизацию. Подобный метод кристаллизации получил название высаливания. Вещества, добавляемые в раствор, обычно имеют одинаковый ион с кристаллизуемой солью. Характерными примерами процессов высаливания являются: кристаллизация железного купороса из травильных растворов при добавлении в них концентрированной серной кислоты, высаливание NaCI из рассолов за счет введения в них хлористого магния или хлористого кальция; получение безводного сульфата натрия добавлением к его растворам NaCI; высаливание поваренной солью хлористого бария из гидросульфидных щелоков и др. Высаливающее вещество лучше вводить в раствор в виде насыщенного раствора, так как при добавлении твердого высаливателя на нем может осаждаться кристаллизующаяся соль, что вызовет замедление или даже прекращение растворения осадителя. В некоторых случаях для выделения соли к раствору добавляют вещества, понижающие растворимость кристаллизуемой соли. Так, для высаливания сульфата натрия из водного раствора можно использовать аммиак, метиловый или этиловый спирты и др. Аналогично кристаллизуют железный купорос из травильных растворов при добавлении ацетона. Введение органических растворителей в водные растворы неорганических солей увеличивает эффективность процесса кристаллизации, обеспечивая высокую степень извлечения соли из раствора и возможность получения продукта в чистом виде. Недостатком этого способа является сравнительно высокая стоимость органических растворителей, регенерация которых требует проведения дополнительных операций (например, ректификации и дистилляции) и связана с некоторой потерей реагента. В органической технологии для кристаллизации из органических растворителей в качестве высаливающей добавки часто используется вода, резко снижающая растворимость кристаллизуемых веществ. КРИСТАЛЛИЗАЦИЯ В РЕЗУЛЬТАТЕ ХИМИЧЕСКОЙ РЕАКЦИИ, В ТОМ ЧИСЛЕ В РЕЗУЛЬТАТЕ ХИМИЧЕСКОГО ОСАЖДЕНИЯ Пересыщение можно создать за счет проведения химических реакций. Образующееся в результате вещество выделяется в виде кристаллической фазы из раствора. Такой химический метод кристаллизации используется в аналитической практике, а также в ряде технологических схем. Так, например, при очистке природных и сточных вод чаще всего проводят кристаллизацию карбонатов, сульфатов и гидроокисей металлов, обладающих незначительной растворимостью. Использование при очистке кристаллизации труднорастворимых соединений обусловлено главным образом одной причиной - полнотой осаждения. Следует, однако, отметить, что в определенных условиях остаточные пересыщения при кристаллизации труднорастворимых соединений могут быть значительными. Наблюдаемая картина связана с особой способностью таких веществ образовывать устойчивые пересыщенные растворы. Так как пересыщенные растворы веществ с малой растворимостью образуются в результате химических реакций, в принципе можно добиться очень большого исходного пересыщения. Следовательно, одной из отличительных черт осаждения труднорастворимых соединений является то, что они кристаллизуются в широком интервале пересыщений, а это дает возможность проводить процесс фазообразования в самых разнообразных вариантах. Создавая различные исходные пересыщения, можно вести осаждение и очень быстро, и очень медленно, получая при этом осадки разнообразного гранулометрического состава. От скорости кристаллизации в свою очередь зависят конечные размеры и форма кристаллов. За счет проведения химической реакции в коксохимическом производстве получают кристаллический сульфат аммония при нейтрализации растворов серной кислоты аммиаком, содержащимся в коксовом газе. В сатураторах, используемых для этой цели, протекает следующая реакция: 2NH3 + H2S04 → (NH4)2SO4 В производстве кальцинированной соды промежуточный продукт (бикарбонат натрия NaHCO3) также получают вследствие химической реакции, протекающей при абсорбции аммиачно-соляным раствором двуокиси углерода. Эта реакция может быть выражена суммарным уравнением: NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl В образующемся растворе наименее растворимой солью является бикарбонат натрия, который выпадает в виде кристаллического осадка и служит для получения кальцинированной соды. Другими способами получения кристаллических продуктов в результате химических реакций являются: кристаллизация хлористого аммония при нейтрализации газообразным аммиаком водных растворов NH4C1, насыщенных хлористым водородом; осаждение мелкокристаллического сульфата бария при обработке растворов солей бария (например, BaCl2) серной кислотой или сернокислыми солями (например, Na2SO4); кристаллизация нитрата бария при сливании насыщенных растворов хлористого бария и азотнокислого аммония и др. Каждая из приведенных выше химических реакций лежит в основе технологического процесса лишь конкретного производства, поэтому химические методы кристаллизации и их аппаратурное оформление в настоящей работе не рассматриваются. ЗАГРЯЗНЕНИЕ ОСАДКА И ОЧИСТКА ОТ ПРИМЕСЕЙ В ПРОЦЕССЕ КРИСТАЛЛИЗАЦИИПомимо захватывания примесей с маточным раствором, другим способом загрязнения осадка является их соосаждение с основным веществом. Процессы соосаждения можно разделить на три типа: - соосаждаемые вещества образуют твердый раствор, то есть примеси входят в кристаллическую решетку основного вещества, осуществляется при наличии изоморфизма между веществами; - примеси, адсорбируются на поверхности осадка, когда его поверхность велика, обладая поверхностно активными свойствами; - примеси внедряются в кристаллическую решетку осадка, адсорбируясь на гранях в процессе их роста, и создают пустоты и разрыхления, процесс окклюзии. От загрязнений, содержащихся в межкристальном маточном растворе, а также адсорбированных на поверхности кристаллов можно освободиться промывкой осадка. Промывка осадка на фильтре позволяет сравнительно небольшим количеством промывного раствора вытеснить захваченный осадком фильтрат. Однако, как правило, осадки на фильтре распределены неравномерно, поэтому их промывка сопровождается образованием каналов в осадке, по которым промывная жидкость проходит сквозь осадок, и эффективность отмывки резко падает. Более надежна, но и более трудоемка фильтрационно - репульпационная промывка. После фильтрования и промывки осадки обычно содержат примерно 25-30 % влаги, которую удаляют посредством сушки осажденного вещества. Перекристаллизация соли, особенно повторенная несколько раз, служит эффективным способом ее очистки от загрязнений. Степень очистки перекристаллизацией зависит от равновесного коэффициента распределения Dр примеси между кристаллами и раствором, равного отношению примеси в кристаллах к концентрации ее в маточном растворе в конечных условиях кристаллизации: Dр= Сiкр./Сiматочн.р. Значение этого коэффициента для каждой пары веществ является константой и зависит от температуры, а в некоторых условиях и от рН раствора. Практический коэффициент распределения D зависит от условий кристаллизации и может отличаться от равновесного. Если D1, при перекристаллизации происходит обеднение кристаллов примесью, когда же D1, образующиеся кристаллы наоборот обогащаются примесью. Коэффициент распределения зависит от соотношения произведений растворимости соосаждающихся веществ. Чем больше разница в растворимостях, тем меньшее количество более растворимого компонента содержит осадок менее растворимого вещества. Если произведения растворимости различаются на три-четыре порядка, то в равновесных условиях можно получить практически чистую твердую фазу даже при наличии изоморфизма между двумя солями, находящимися в растворе. Можно уменьшить коэффициент распределения с целью устранения захвата изоморфных примесей при кристаллизации, превращая изоморфный ион примеси в неизоморфный путем его окисления или восстановления, или вводя комплексообразователи, дающие с примесью комплексы. Например, ионы Fe2+иCu2+являются изоморфными, и при кристаллизации сульфата медиFe2+предварительно окисляют доFe3+, тем самым превращая его в неизоморфный ион, уменьшают его захват осаждаемыми кристаллами. Захват примесей кристаллами обычно тем меньше, чем выше температура системы, и чем она лучше перемешивается, что препятствует накапливанию примесей в диффузионном слое у поверхности граней. Однако, когда D1, интенсификация перемешивания может привести к большему загрязнению. С ростом скорости кристаллизации чистота продукта также увеличивается, за исключением тех случаев, когда при больших пересыщениях на поверхности образующихся кристаллов появляется большое число дефектов, что способствует адсорбции примесей, или образуются агрегированные блоки и сростки, что увеличивает захват содержащего примеси маточного раствора. Очистка растворов осаждением примесей. Для получения чистых кристаллов растворы перед кристаллизацией подвергают очистке от загрязняющих их примесей осаждением последних в виде нерастворимых соединений. Например, из фосфорной кислоты, загрязненной соединениями фтора, перед переработкой ее в фосфаты фтор удаляют осаждением в виде кремнефторида натрия. Загрязняющие раствор ионы металлов часто осаждают в виде гидроксидов, повышая рН раствора добавлением щелочи. Раствор соли может быть очищен от иона какого-либо металла, присутствующего в этом растворе, если рН гидроксида этого металла меньше, чем рН осаждения гидроксида металла, образующего соль. В противном случае, при повышении рН сначала будет осаждаться гидроксид солеообразующего металла, а загрязняющие ионы останутся в растворе. Расчет Выполнить расчет по выделению хлорида калия из насыщенного при 100°C раствора при его охлаждения до 0°C, исходя из следующих данных. Растворимость KCl при 0°C Растворимость KCl при 100°C – 56,2г/100г H20 Объем воды для растворения соли - 500 мл. m(H2O)=500*8=500г. Р-р KCl – при 100°C? 56,2 -100 x=281г (KCl) x - 500 m (KCl) в 500 H2O при 0°C 23,1 - 100 x=140,5 г. KCl x - 500 m(KCl) выкристаллизуется m(KCl)= 281-140,5=140,52 Вывод Переход плава из жидкого состояния в твердое называется кристаллизацией. Она протекает вследствие перехода системы из термодинамически неустойчивого состояния в термодинамически устойчивое состояние, т.е. из состояния с большей энергией в состояние с меньшей энергией. Во время плавления происходит поглощение теплоты, которая расходуется на повышение энергии атомов, т.е. на «разрушение» кристаллической решетки металла. Эта теплота называется скрытой. В процессе кристаллизации происходит обратное выделение энергии в виде скрытой теплоты кристаллизации. Она компенсирует тепло, которое отводится в окружающую среду, и задерживает падение температуры. С увеличением скорости охлаждения степень переохлаждения возрастает, и процесс кристаллизации протекает при температурах, значительно более низких, чем равновесная температура кристаллизации. Чем чище плав, тем при большей степени переохлаждения возникают зародыши твердых кристаллов. СПИСОК ЛИТЕРАТУРЫ 1.Маллин Дж. У. Кристаллизация. пер. с англ., М., 1965; 2.Магусевич Л. Н. Кристаллизация из растворов в химической промышленности, М., 1968; 3.Бэмфорт А. В. Промышленная кристаллизация. пер. с англ., М., 1969; 4.Пономаренко В. Г. Ткаченко К. П., Курлянд Ю. А. Кристаллизация в псевдоожиженном слое. К., 1972; |