курсовая. Курсовая по элементам. Сравнение структуры и свойств водородных соединений s и рэлементов i и iv групп
 Скачать 259.8 Kb. Скачать 259.8 Kb.
|
|
Курсовая работа на тему: «Сравнение структуры и свойств водородных соединений s- и р-элементов I и IV групп» Содержание Введение 3 1. Свойства и строение атомов s- и p-элементов. 4 1.1. характеристика s-элементов. 4 1.2. Характеристика p-элементов 6 1.3. Сравнительная характеристика s- и p-элементов. 7 1) Степень окисления. 8 2) Химическая связь. 8 3) Металлические свойства. 8 4) Электроотрицательность. 8 2. Структура и свойства s-элементов I группы периодической таблицы 10 2.1. Водород. Химические свойства водорода. 12 3. Структура и свойства s- и p-элементов IV группы периодической таблицы 17 3.1. Общие характеристики элементов группы IVA 17 3.2. Углерод и его соединения 20 4. Сравнительная характеритика структуры и свойств водородных соединений s- и р-элементов I и IV групп. 25 6. Сравнение структуры и свойства водородных соединений s-элементов I и II групп. 30 7. Сравнительная характеристика соединений водорода и бора 33 Выводы 36 Список литературы 38 ВведениеПериодическая таблица химических элементов (таблица Менделеева) — классификация химических элементов, определяющая зависимость различных свойств элементов от заряда атомного ядра. Её первоначальный вариант был разработан Д.И. Менделеева в 1869-1871 годах, в которой определялась зависимость свойств элементов от их атомного веса. Все элементы в таблице сгруппированы в 4 основные группы: блок s, блок p, блок d и блок f. Они классифицируются в соответствии с орбиталью, на которой присутствуют их валентные электроны. Кроме того, эти элементы также могут быть классифицированы как металлы, неметаллы и металлоиды в соответствии с их физическими свойствами. Все элементы блока, кроме водорода, являются металлами. Большинство элементов р-блока — неметаллы. Остальные элементы в блоке p являются металлоидами. Основное различие между элементами блока s и p состоит в том, что валентные электроны элементов блока s находятся на орбитали s, а валентные электроны элементов блока p — на орбитали p. Цель работы – сформировать знания об особенностях структуры и свойств водородных соединений атомов s- и р-элементов I и IV групп, I и II групп. Для достижения посталвенной цели необходимо решить следующие задачи: 1) Изучить свойства и строение атомов s- и р-элементов; 2) Изучить и проанализировать структуру и свойства s-элементов I группы периодической таблицы; 3) Изучить и проанализировать структуру и свойства s- и р-элементов IV группы периодической таблицы; 4) Сравнить структуры и свойства водородных соединений s- и р-элементов I и IV групп; 5) Изучить и проанализировать структуру и свойства s-элементов II группы периодической таблицы; 6) Сравнить структуры и свойства водородных соединений s- и р-элементов I и II групп. 1. Свойства и строение атомов s- и p-элементов.1.1. характеристика s-элементов.В периодической таблице элементов в начале каждого периода, кроме первого, стоят металлы из семейства s-элементов. S-элементы и группы периодической системы Д. И. Менделеева были названы щелочными металлами — литий Li, натрий Na и элементы калиевой подгруппы — калий К, рубидий Rb, цезий Cs и франций Fr. Название «щелочные металлы» используется потому, что их гидроксиды являются самыми сильными известными щелочами. Щелочные металлы добывают в отсутствие воды - в основном электролизом расплавов их соединений.Эти металлы являются наиболее активными и электроположительными элементами, а это означает, что они легко отщепляют свой единственный валентный электрон и превращаются в положительно заряженные катионы. Поэтому в природе они находятся только в связанном состоянии. Внешний энергетический уровень этих элементов содержит один или два S-электрона, С увеличением заряда ядер у элементов увеличивается число энергетических уровней и атомные радиусы. Следовательно, уменьшается связь валентного электрона с ядром. В нисходящих группах увеличивается способность отдавать электроны, соответственно увеличиваются химическая активность и восстановительные свойства s-элементов. Эта закономерность ярко выражается для элементов 1 группы (s1) по сравнению со II группой (s2). К блоку s-элементов относятся 13 элементов, общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня. Для ионов s-элементов комплексообразование не характерно. Кристаллические комплексы s - элементов с лигандами H2O-кристаллогидраты, например: Na2В4O7·10H2O-бура, KАl(SO4)2·12H2O-квасцы. Молекулы воды в кристаллогидратах группируются вокруг катиона, но иногда полностью окружают и анион. Вследствие малого заряда иона и большого радиуса иона щелочные металлы наименее склонны к образованию комплексов, в том числе и аквакомплексов. В качестве комплексообразователей в комплексных соединениях невысокой устойчивости выступают ионы лития, бериллия, магния. Соединения s-элементов проявляют общие закономерности в свойствах, что объясняется сходством электронного строения их атомов. Все внешние электроны являются валентными и принимают участие в образовании химических связей. Поэтому максимальная степень окисления этих элементов в соединениях равна числу электронов во внешнем слое и соответственно равна номеру группы, в которой и находится данный элемент. Степень окисления металлов s-элементов всегда положительна. Другая особенность заключается в том, что после отделения электронов внешнего слоя остается ион, имеющий оболочку благородного газа. При увеличении порядкового номера элемента, атомного радиуса, уменьшается энергии ионизации (от 5,39 эВ y Li до 3,83 эВ y Fr), а восстановительная активность элементов возрастает.[1] Подавляющее большинство соединений s-элементов бесцветно (в отличие от соединений d-элементов), так как исключен обуславливающий окраску переход d-электронов с низких энергетических уровней на более высокие энергетические уровни. Соединения элементов групп IA - IIA - типичные соли, в водном растворе они практически полностью диссоциируют на ионы, не подверженны гидролизу по катиону (кроме солей Be2+ и Mg2+).[2] 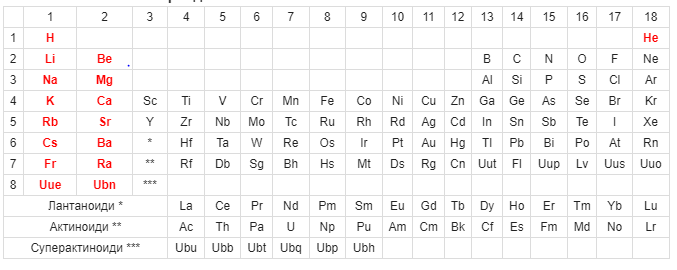 Рисунок 1 – Место s-элементов в периодической таблице элементов |
