курсовая. Курсовая по элементам. Сравнение структуры и свойств водородных соединений s и рэлементов i и iv групп
 Скачать 259.8 Kb. Скачать 259.8 Kb.
|
2.1. Водород. Химические свойства водорода.Водород - самый распространенный элемент во вселенной: он составляет до половины массы солнца и большинства звезд. Водород - наиболее легкий s-элемент. Его электронная конфигурация в основном состоянии 1S1. Атом водорода состоит из одного протона и одного электрона. Особенность водорода состоит в том, что его валентный электрон находится непосредственно в сфере действия атомного ядра. Молекулярный водород существует в двух спиновых формах. Модификации незначительно различаются по физическим свойствам, оптическим спектрам, а также по характеристикам рассеяния нейтронов. При комнатной температуре водород представляет собой равновесную смесь орто-H2 (75%) и пара-H2 (25%) форм. При очень низких температурах баланс между ортоводородом и параводородом почти полностью смещается в сторону параводорода, так как энергия парамолекулы несколько ниже энергии ортоводорода. При 80 К соотношение модификации составляет примерно 1:1. В молекуле водорода о-Н2 (температура плавления -259,10 °С, температура кипения -252,56 °С) спины ядер параллельны, а в парах водорода р-Н2 (температура плавления -259,32 °С, температура кипения - 252,89 °С) противоположны друг другу (антипараллельны). Равновесная смесь о-Н2 и р-Н2 при данной температуре называется равновесным водородом е-Н2. Две формы водорода можно разделить адсорбцией на активированном угле при температуре жидкого азота. В этом случае активированный уголь катализирует превращение водорода в водород. Сероводород, десорбированный из угля при комнатной температуре, превращается в водород или водород до образования равновесной смеси (75:25), но без катализатора это превращение протекает медленно, что позволяет изучать свойства отдельных аллотропных форм.[8] У водорода нет промежуточного электронного слоя, поэтому водород нельзя считать электронным аналогом щелочных металлов. Как и щелочные металлы водород является восстановителем, проявляет степень окисления +1, Спектры водорода сходны со спектрами щелочных металлов. Со щелочными металлами сближает водород его способность давать в растворах гидратированный положительно заряженный ион Н+. Подобно галогеном атому водорода не достает одного электрона. Этим и обусловлено существование гидрид-иона Н-. Кроме того, как и атомы галогенов атомы водорода характеризуются высоким значением энергии ионизации (1312 кдж/моль). Таким образом, водород занимает особое положение в Периодической системе элементов. На солнце и других планетах водород находится в атомарном состоянии, в межзвездной среде в виде частично ионизированных двухатомных молекул. Содержание водорода на Земле 3,0 %. Он входит в состав воды, глин, каменного и бурого угля, нефти, а также во все животные и растительные организации. Водород имеет три изотопа; протий 1Н, дейтерий 2Д и тритий 3Т, причем тритий - радиоактивный изотоп. Молекулы водорода отличаются большой прочностью и малой поляризуемостью, незначительными размерами и малой массой и обладают большой подвижностью. Поэтому у водорода очень низкие температуры плавления (-259,2 оС) и кипения (-252,8 оС). Из-за высокой энергии диссоциации (436 кдж/моль) распад молекул на атомы происходит при температурах выше 2000 оС. Водород бесцветный газ без запаха и вкуса. Он имеет малую плотность - 8,99·10-5 г/см При очень высоких давлениях водород переходит в металлическое состояние. Считается, что на дальних планетах солнечной системы - Юпитере и Сатурне водород находится в металлическом состоянии. Существует предположение, что в состав земного ядра также входит металлический водород, где он находится при сверхвысоком давлении, создаваемым земной мантией. Химические свойства. При комнатной температуре молекулярный водород реагирует лишь со фтором, при облучении светом - с хлором и бромом, при нагревании с О2,S, Se, N2, C, I2. Реакции водорода с кислородом и галогенами протекают по радикальному механизму. Взаимодействие с хлором - пример неразветвленной реакции при облучении светом (фотохимическая активация), при нагревании (термическая активация). 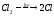 Сl+ H2 = HCl + H (развитие цепи) H+ Сl 2 = HCl + Сl Взрыв гремучего газа - водородокислородной смеси - пример разветвленного цепного процесса, когда инициированние цепи включает не одну, а несколько стадий: Н2 → 2Н Н2 + О2 = 2ОН Н+ О2 = ОН+О О+ Н2 = ОН+ Н ОН+ Н2 = Н2О + Н Взрывного процесса удается избежать, если работать с чистым водородом. Поскольку для водорода характерна - положительная (+1) и отрицательная (-1) степень окисления, водород может проявлять и восстановительные, и окислительные свойства. Более сильным восстановителем является атомарный водород. Он образуется из молекулярного в электронном разряде в условиях низкого давления. Высокой восстановительной активностью обладает водород в момент выделения при взаимодействии металла с кислотой. Такой водород восстанавливает CrCl3 в CrCl2: 2CrCl3 + 2HСl + 2Zn = 2CrCl2+ 2ZnCl2 +H2↑ Важное значение имеет взаимодействие водорода с оксидом азота (II): 2NO + 2H2 = N2 + H2O Используемое в очистительных системах при производстве азотной кислоты. При взаимодействии с неметаллами водород проявляет восстановительные свойства: Н2 (г) + Cl2 (г) = 2НCl (г), ΔH0298= - 184 кДж; 2Н2 (г) + О2 (г) = 2Н2О (г), ΔH0298= - 484 кДж. Связи Н-Сl, Н-О прочные (имеют высокую энергию), поэтому реакции взаимодействия водорода с хлором и кислородо протекают с выделением большого количества тепла. Поэтому водород проявляет восстановительные свойства по отношению ко многим оксидам, галогенидам, например: 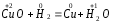 , , 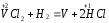 На этом основано применение водорода в качестве восстановителя для получения простых веществ из оксидов галогенидов. В качестве окислителя водород взаимодействует с активными металлами: 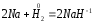 ; ; 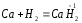 В данном случае водород ведет себя как галоген, образуя аналогичные галогенидам гидриды. Гидриды s-элементов I группы имеют ионную структуру типа NaCl. В химическом отношении ионные гидриды ведут себя как основные соединения. К ковалентным относятся гидриды менее электроотрицательных, чем сам водород неметаллических элементов, например, гидриды состава SiH4, ВН3, СН4. По химической природе гидриды неметаллов являются кислотными соединениями. Характерной особенностью гидролиза гидридов является выделение водорода, реакция протекает по окислительно-восстановительному механизму. Основной гидрид: 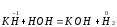 Кислотный гидрид: 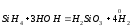 За счет выделения водорода гидролиз протекает полностью и необратимо (∆Н<0, ∆S>0). При этом основные гидриды образуют щелочь, а кислотные кислоту. Стандартный потенциал системы 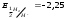 В. Следовательно, ион Н - сильный восстановитель. В. Следовательно, ион Н - сильный восстановитель.В лаборатории водород получают взаимодействием цинка с 20% -й серной кислотой в аппарате Киппа. Технический цинк часто содержит небольшие примеси мышьяка и сурьмы, которые восстанавливаются водородом в момент выделения до ядовитых газов: арсина SbH3 и стабина SbH. Таким водородом можно отравиться. С химически чистым цинком реакция протекает медленно из-за перенапряжения и хорошего тока водорода получить не удается. Скорость этой реакции увеличивается путем добавления кристалликов медного купороса, реакция ускоряется за счет образования гальванической пары Cu-Zn.[9] |
