|
|
курсовая. Курсовая по элементам. Сравнение структуры и свойств водородных соединений s и рэлементов i и iv групп
6. Сравнение структуры и свойства водородных соединений s-элементов I и II групп.
Особенности строения металлов и группы и закономерности изменения их свойств с ростом заряда ядра атома группы отражены на рисунке 5.
Элементы обоих групп обладают сходными свойствами. В свободном состоянии они – типичные металлы с высокой химической активностью, и являются сильными восстановителями.
Валентными являются S-электроны. Атомы этих элементов могут быть только донорами при образовании комплексных соединений и проявляют положительные степени окисления для I-A группы + 1, для II-A группы + 2.
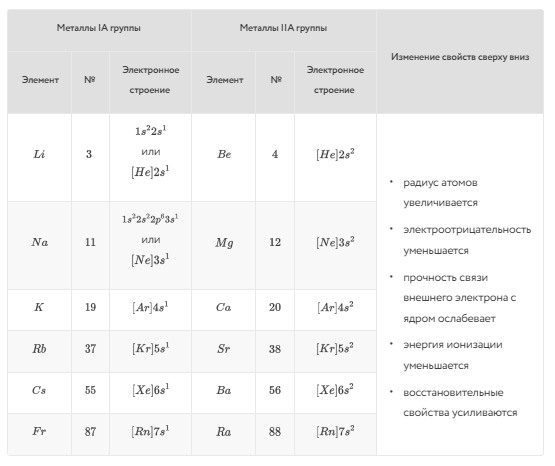
Рисунок 5 – Особенности строения металлов I и II групп
Таблица 4 – Сводная таблица сравнения элементов I и II групп [15]
Характеристика элементов IА- группы.
|
Общая характеристика элементов IIА-группы
|
I группа подразделяется на IА группу (s-элементы – щелочные металлы) и IB группу (d-элементы: медь, золото, серебро). Название «щелочные» обусловлено тем, что гидроксиды натрия и калия называют щелочами.
В соединениях щелочных металлов преобладает ионный характер связи, степень окисления их атомов всегда равна +1. Высший оксид – Me2O имеют основный характер. Высшие гидроксиды MeOH – типичные растворимые основания, щелочи. Водородные соединения – MeH – гидриды.
|
II – группа подразделяется на IIА- группу (s-элементы – Be, Mg и щелочноземельные металлы (кальций, стронций, барий, радий). Название щелочноземельные обусловлено тем, что гидроксиды этих металлов - щелочи, а оксиды имеют историческое название «земли». В соединения этих металлов преобладает ионный характер связи. В соединениях имеют степень окисления равную +2. Высший оксид – MeO – основный хараетр, высший гидроксид – Me(OH)2 – типичные основания. Их относят к щелочам, хотя растворимость много меньше, чем гидроксидов щелочных металлов. Водородные соединения – гидриды – MeH2. С ростом порядкового номера элемента металлические свойства закономерно возрастают.
|
Физические свойства. Щелочные металлы – твердые вещества с металлическим блеском на срезе, легкие (самый легкий – литий), легкоплавкие, довольно мягкие. Поверхность покрыта пленкой, но она не защищает металл от окисления. Окрашивают пламя: литий – кирпично – красную, натрий – желтую, калий – бледно-фиолетовую.
|
В обычных условиях щелочноземельные металлы – твердые вещества с металлическим блеском на свежем срезе, легкие и более твердые, чем щелочные металлы. Кальций – не режется ножом, стронций и барий – мягче. Окраска пламени: кирпично-красная – за счет ионов кальция, желтовато-зеленая – за счет ионов бария. Цвет металлов – серебристо – белый.
|
Химические свойства. Являются восстановителями (особенно в реакциях с галогенами).
При взаимодействии щелочных металлов с бромом происходит взрыв. В атмосфере хлора и фтора они воспламеняются.
Нагретые щелочные металлы легко сгорают на воздухе или в кислороде образуют пероксиды; только при сгорании лития – оксид.
Литий единственный металл, который реагирует с азотом с образованием нитрида, уже при комнатной температуре:
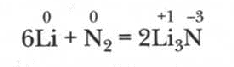
Натрий реагирует с азотом при 100 0С, остальные металлы с ним не реагируют.
Щелочные металлы взаимодействуют с фосфором при нагревании в атмосфере инертного газа (аргона):
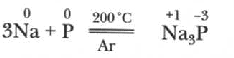
При нагревании щелочные металлы взаимодействуют с водородом с образованием твердых гидридов (NaH).
Активно взаимодействуют с водой, с образованием щелочи и водорода. Рубидий и цезий взаимодействуют с водой со взрывом.
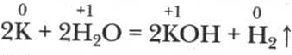
Активно реагируют с разбавленными растворами кислот с образованием соли и водорода.
Реагируют со многими органическими веществами:
C2H5OH+ Na →C2H5ONa + H2
CH3COOH + Na → CH3COONa + H2
|
Все элементы IIА группы являются активными восстановителями.
Химические свойства рассматриваем на примере кальция. Степень окисления - +2. На воздухе окисляется, поэтому его хранят в закрытых сосудах, обычно в керосине.
Реагирует с галогенами:
Ca+Cl2 →CaCl2
С серой при нагревании:
Сa+S → CaS
С азотом и углем при нагревании:
Ca+2C →CaC2
При сгорании на воздухе или в кислороде щелочноземельные металлы образуют оксиды:
2Ca+O2→2CaO
Легко взаимодействуют с водой с образованием гидроксида металла (щелочи) и водорода, кальций с горячей водой реагирует очень активно.
Сa+2H2O → Ca(OH)2 +H2
Щелочноземельные металлы активно взаимодействуют с разбавленными кислотами с образованием соли и водорода.
|
Получение. Получают натрий электролизом расплава поваренной соли. Реже – электролизом расплава щелочи
|
Получение. Кальций и стронций получают электролизом расплавов хлоридов.
|
Применение.
NaOH, NaCl (поваренная соль),NaNO3, KOH, KCl, KNO3, K2CO3 (поташ).В природе щелочные металлы в свободном виде не встречаются. Входят в состав различных соединений.
Литий – используется для получения трития – изотопа водорода, а также как теплоноситель в ядерных реакторах. Натрий – для синтеза некоторых органических соединений.
|
Соединения щелочноземельных металлов.
Оксид кальция (CaO)- негашеная известь – белое кристаллическое вещество, гигроскопичное.
Оксид кальция энергично реагирует с водой с образованием гидроксида кальция.
Гидроксид кальция (гашеная известь). Смесь гашеной извести, песка и воды называется строительным материалом – известковым раствором. Применяют в качестве штукатурки.
Гашеная известь (Ca(OH)2) – твердое вещество белого цвета, растворима в воде. Раствор гашеной извести в воде называется известковой водой. Она обладает щелочными свойствами. При пропускании через известковую воду оксида углерода – она мутнеет, а при дальнейшем пропускании муть исчезает:
Ca(OH)2 + CO2 → CaCO3 + H2O
СaCO3 + H2O + CO2 →Ca(HCO3)2
Соли кальция: карбонат кальция – широко распространен в виде горной породы – известняка. Известняк, мел и мрамор преимущественно содержат карбонат кальция; нитрат кальция – кальциевая селитра; сульфат кальция двухводный – белое кристаллическое вещество, хорошо известное как гипс.
Жесткость воды – совокупность свойств, обусловленных содержанием в воде катионов кальция (Ca2+) и катионов магния (Mg2+). Если концентрация этих катионов велика, то воду называют жесткой, если мала – мягкой. Именно они придают специфические свойства природным водам.
При стирке белья жесткая вода ухудшает качество тканей и требует повышенной затраты мыла и стирального порошка. В жесткой воде с трудом развариваются пищевые продукты, а сваренные в ней овощи невкусны. Очень плохо заваривается чай и теряется его вкус. В тоже время в санитарно-гигиеническом отношении эти катионы не представляют опасности.
| |
|
|
 Скачать 259.8 Kb.
Скачать 259.8 Kb.
