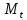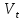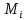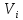ОФС_Титриметрия_(титриметрические_методы_анализа) (1). Статья титриметрия (титриметрические методы анализа)
 Скачать 54.45 Kb. Скачать 54.45 Kb.
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Титриметрия, титриметрический анализ – метод количественного химического анализа, основанный на точном измерении объёма стандартного (титрованного) раствора, израсходованного на реакцию с определяемым веществом. Стандартным или титрованным называется раствор реактива точно известной концентрации, предназначенный для титриметрического анализа. Требования к титрованным растворам установлены ОФС «Титрованные растворы». Титриметрию относят к объёмным методам количественного анализа, так как определяемое вещество находится в растворе, обозначаемом как испытуемый. Титрование – процесс прибавления титрованного раствора к испытуемому раствору определяемого вещества до достижения точки эквивалентности. Точкой эквивалентности или теоретической точкой конца титрования называется состояние системы, когда количество прибавляемого титрованного раствора эквивалентно количеству определяемого вещества. Момент, при котором заканчивается титрование, называется конечной точкой титрования, которую определяют, используя соответствующие индикаторы или физические параметры инструментальных методов. В тех случаях, когда точка эквивалентности полностью или почти полностью совпадает с конечной точкой титрования, по закону эквивалентов можно рассчитать количество определяемого вещества по количеству израсходованного на реакцию титрованного раствора. В соответствии с законом эквивалентов вещества реагируют друг с другом в количествах, пропорциональных их эквивалентам. Для количественного определения вещества при титриметрии необходимо установить объем титрованного раствора, в котором содержится столько эквивалентов, сколько их содержится в пробе определяемого вещества. По закону эквивалентов: 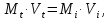
Искомая концентрация определяемого вещества: 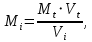 Очень часто конечная точка титрования не совпадает с точкой эквивалентности. Это может происходит из-за индикаторной ошибки, а также из-за того, что реакция является обратимой, из-за взаимодействия титрованного раствора с побочными продуктами реакции и т.д. В этих случаях, как правило, при титриметрическом методе анализа необходимо проведение контрольного опыта, введение поправочного коэффициента и других мер, которые указывают в фармакопейной статье на испытуемое лекарственное средство. Для титриметрического метода анализа рекомендуется использовать реакции, удовлетворяющие следующим основным требованиям: - точка эквивалентности в реакциях должна точно и быстро фиксироваться; - реакция между веществами титрованного и испытуемого раствора должна протекать в строгом стехиометрическом соотношении, соответствующем её химическому уравнению; - реакция должна быть практически необратимой; - реакция должна протекать с достаточной скоростью. Оборудование При выполнении титриметрического анализа ручным способом используют бюретки, пипетки и другую посуду, требования к которой указаны в ОФС «Мерная посуда». Объём бюретки для титрования выбирается таким образом, чтобы теоретический объём титрованного раствора, требуемый для титрования, составлял от 30 до 90 % объёма её номинальной вместимости. Если титрованного раствора требуется менее 5 мл, необходимо использовать соответствующую микробюретку. Для точного измерения объёмов растворов, кроме традиционных стеклянных пипеток, можно использовать современные дозирующие устройства, например, пипетки-дозаторы и электронные пипетки. Для проведения автоматизированного титриметрического анализа используют различные автоматические титраторы (автотитраторы), которые имеют электронную систему управления, позволяющие проводить любые виды титрования и автоматическую обработку полученных результатов . Физико-химические и другие характеристики индикаторов, способы приготовления растворов индикаторов, используемых, в том числе, в титриметрических методах анализа, указаны в ОФС «Реактивы. Индикаторы». В зависимости от используемого вида титриметрического анализа применяют различные инструментальные способы регистрации конечной точки титрования: потенциометрическое; фотометрическое; кондуктометрическое; амперометрическое; кулонометрическое, требования к проведению которых указаны в соответствующих общих фармакопейных статьях. Классификация титриметрических методов анализа В зависимости от способа титрования различают: прямое титрование, обратное титрование и косвенное (заместительное) титрование. При прямом титрованиираствор, содержащий определяемое вещество, титруется стандартным (титрованным) раствором до достижения точки эквивалентности. При прямом титровании точка эквивалентности достигается напрямую, при этом необходимо соблюдать осторожность и титрованный раствор из бюретки под конец титрования прибавлять по каплям, чтобы последняя прибавленная капля не превысила объём, соответствующий конечной точке титрования. Количество определяемого вещества рассчитывают, исходя из объёма и молярности титрованного раствора и титра определяемого вещества, указанного в фармакопейной статье. При обратном титровании (титровании по остатку, титрование с двумя титрантами) используют испытуемый и два стандартных (титрованных) раствора, один из которых является вспомогательным, а второй (основной) применяют непосредственно для титрования. При проведении испытания к точно измеренному объёму испытуемого раствора с определяемым веществом прибавляют заведомо избыточный, но точно отмеренный объём первого титрованного раствора. В результате химической реакции определяемое вещество, присутствующее в испытуемом растворе, полностью расходуется, вступая во взаимодействие с первым титрованным раствором. Затем вторым (основным) титрованным раствором титруют избыток первого вспомогательного титрованного раствора, не вступившего в реакцию с определяемым веществом. Количество определяемого вещества рассчитывают исходя из разности объёмов титрованных растворов с поправкой на контрольный опыт с учётом молярности растворов и титра определяемого вещества по вспомогательному титрованному раствору, указанного в фармакопейной статье. При косвенном или заместительном титровании (титровании по замещению, титрование заместителя) также используют испытуемый раствор и два титрованных раствора. При испытании к точно отмеренному объёму испытуемого раствора с определяемым веществом прибавляют избыток первого (вспомогательного) титрованного раствора. В результате протекающей реакции вещество испытуемого раствора полностью расходуется с образованием эквивалентного количества соответствующего продукта реакции, который затем титруют вторым (основным) титрованным раствором до наступления точки эквивалентности. Таким образом, определяемое вещество замещается на другое, которое впоследствии и подвергается анализу. Заместительное титрование применяют, если невозможно определить вещество в испытуемом растворе, например, отсутствует подходящий титрованный раствор или нельзя установить точку эквивалентности. Количество определяемого вещества рассчитывают также, как при прямом титровании. Во многих случаях в титриметрии, независимо от способа титрования, требуется проведение контрольного (холостого) опыта. Это необходимо для устранения влияния примесей, используемых реактивов, неточностей, связанных с применением мерной посуды, условий определения, обусловленных побочными реакциями и другими причинами. В контрольном опыте участвуют все реактивы (титрованные растворы, индикаторы и т.п.), кроме анализируемого вещества, или реактивы и анализируемое вещество без характерного реактива на анализируемое вещество. Контрольный опыт проводят параллельно с исследуемым и в аналогичных условиях. Количество титрованного раствора, израсходованное на контрольный опыт, затем вычитают из общего количества титрованного раствора, пошедшего на титрование испытуемого раствора. В зависимости от типа химической реакции, протекающей между веществами испытуемого и титрованного растворов, различают титрование: кислотно-основное, окислительно-восстановительное, комплексонометрическое и осадительное. Требования к отдельным видам титриметрического метода анализа изложены в общих фармакопейных статьях: ОФС «Кислотно-основное титрование в неводных средах», ОФС «Нитритометрия» и ОФС «Комплексонометрическое титрование». Кислотно-основное титрованиеосновано на использовании реакций кислотно-основного взаимодействия (реакций нейтрализации). Применяют для количественного определения неорганических и органических веществ, обладающих кислотно-основными свойствами. В зависимости от используемых титрованных растворов различают разновидности кислотно-основного титрования: - алкалиметрия – титрованными растворами являются растворы сильных оснований, например, натрия гидроксида, калия гидроксида и др.; - ацидиметрия – титрованными растворами являются растворы сильных кислот, например, хлористоводородной кислоты, серной кислоты и др. В основе метода лежит реакция нейтрализации: Н+ + ОН– → Н2О, которая идет с большой скоростью, строго стехиометрично, до конца и удовлетворяет основным требованиям, предъявляемым к реакциям для титриметрического метода анализа. Для фиксирования конечной точки титрования применяют кислотно-основные индикаторы (рН-индикаторы), представляющие собой органические соединения, способные изменять цвет в растворе в зависимости от рН раствора. Интервал перехода окраски индикатора должен быть вблизи точки эквивалентности. Наиболее часто для кислотно-основного титрования используют такие индикаторы, как: метиловый оранжевый, фенолфталеин, метиловый красный. Из инструментальных методов для фиксирования конечной точки титрования применяют потенциометрический (рН-метрия). При кислотно-основном титровании могут быть использованы способы прямого, обратного или заместительного титрования. В фармакопейном анализе используется кислотно-основное титрование, проводимое как в водной среде, так и в неводных средах. Окислительно-восстановительное титрованиеосновано на использовании окислительно-восстановительных реакций. При проведении окислительно-восстановительного титрования происходит изменение окислительно-восстановительного потенциала реакции и наблюдается резкое изменение потенциала вблизи точки эквивалентности. Окислительно-восстановительное титрование применяют для количественного определения веществ, обладающих окислительными или восстановительными свойствами. В зависимости от свойств определяемого вещества и используемых титрованных растворов различают методы окислительного титрования и методы восстановительного титрования. В фармакопейном анализе наибольшее применение имеют методы окислительного титрования, такие как: перманганатометрия, йодометрия, хроматометрия, броматометрия, цериметрия и др. Из методов восстановительного титрования используют, например, феррометрию, в которой титрованным раствором является раствор соли железа(II). Для фиксирования точки эквивалентности при окислительно-восстановительном титровании используют окислительно-восстановительные индикаторы (редокс-индикаторы), которые при достижении определенного потенциала, зависящего от присутствия в растворе окислителей или восстановителей, изменяют цвет. Различают индикаторы одноцветные, у которых одна из форм цветная, другая бесцветная (например, дифениламин в окисленной форме фиолетового цвета, в восстановленной − бесцветный, метиленовый синий также бесцветен в восстановленной форме и имеет синий цвет в окисленном состоянии), и двухцветные, у которых обе формы окрашены (например, ферроин в окисленной форме синего цвета, в восстановленной − красного). Специфические индикаторы взаимодействуют только с определенными соединениями: крахмал является специфическим индикатором на йод, тиоцианаты − на железо(III). В некоторых случаях при окислительно-восстановительном титровании в роли индикатора могут быть титрованные растворы, изменяющие цвет в точке эквивалентности: растворы калия перманганата, йода, церия(IV) сульфата, калия дихромата. Из инструментальных методов для регистрации конечной точки титрования в окислительно-восстановительном титровании используют фотометрические, потенциометрические, амперометрические, кулонометрические и другие методы. Если окислительно-восстановительная реакция соответствует требованиям, предъявляемым к титриметрическим методам анализа и имеется возможность зафиксировать точку эквивалентности, то используют метод прямого титрования. Если же реакция идет нестехиметрично, медленно, то применяют методы обратного или заместительного титрования. Кроме того, может потребоваться изменение окислительного состояния определяемого вещества перед титрованием путем прибавления окислителя или восстановителя, затем избыток этого реагента должен быть удален, например, осаждением. Перманганатометрия – метод окислительно-восстановительного титрования, в котором основным титрованным раствором является раствор калия перманганата. Фиксирование конечной точки титрования в бесцветных растворах может происходить без индикатора – по окрашиванию раствора в розовый цвет, в окрашенных растворах – с применением индикатора, например, ферроина. Прямое перманганатометрическое титрование восстановителей проводят, как правило, в сильнокислой среде, которую создают прибавляя избыток серной кислоты. MnO4– + 8H+ + 5e– → Mn2+ + 4H2O Нельзя использовать для создания кислой среды хлористоводородную или азотную кислоты, так как в их присутствии возможно протекание побочных реакций. В перманганатометрии можно применять способы обратного и заместительного титрования. Йодометрия – метод окислительно-восстановительного титрования, в котором основными титрованными растворами являются растворы йода и растворы натрия тиосульфата. Фиксирование конечной точки титрования осуществляют с применением специфического индикатора − крахмала, который образует с йодом соединение, окрашенное в синий цвет. Безиндикаторное титрование йодом применяется редко, так как в малых концентрациях раствор йода имеет очень бледную окраску. При проведении йодометрического титрования из-за особенностей физико-химических свойств йода (летучести) требуется выполнение некоторых специальных условий: титрование проводить при комнатной температуре, а если указано в фармакопейной статье, то и при более низкой температуре. При соответствующем указании в фармакопейной статье реакционную смесь при йодометрическом титровании необходимо выдерживать в темноте, закрывать реакционные колбы пробками и предпринимать другие меры по обеспечению условий проведения йодометрического титрования. Йодометрическое титрование, как правило, проводят в нейтральной или слабокислой среде. К титрованию выделившегося в ходе реакции йода приступают не сразу, а минут через 5 после начала реакции образования йода при прибавлении соответствующего реактива. Йодометрическое титрование имеет широкое применение в фармакопейном анализе лекарственных средств, при этом могут быть использованы способы прямого, обратного и, не очень часто, заместительного титрования. Прямое титрование стандартным раствором йода используют, например, для определения сильных восстановителей, прибавляя индикатор крахмал до начала титрования и титруют до появления окраски. I2 +2e– → 2I– При обратном йодометрическом титровании, используемым для веществ, которые труднее окисляются или подвергаются другим процессам под воздействием йода, избыток раствора йода после реакции с определяемым веществом титруют стандартным раствором натрия тиосульфата, используя в качестве индикатора крахмал, который рекомендуется прибавлять вблизи точки эквивалентности (в присутствии больших количеств йода крахмал может разрушаться, при этом результаты анализа могут быть завышены). I2 + 2S2O32– → 2I– + S4O62– Хроматометрия (дихроматометрия, бихроматометрия) – метод окислительно-восстановительного титрования, при котором в качестве основного титрованного раствора используют раствор калия дихромата, являющийся менее сильным окислителем по сравнению с раствором калия перманганата. Фиксирование конечной точки титрования осуществляют с применением внутренних редокс-индикаторов: дифениламина, дифениламино-сульфокислоты, N-фенилантраниловой кислоты, которые образуют окрашенные соединения с избытком титрованного раствора. Возможно использование внешних индикаторов, например, серебра нитрата, калия феррицианида, образующих окрашенные осадки с избытком титрованного раствора. Безиндикаторное титрование до появления в точке эквивалентности оранжевой окраски титрованного раствора хрома(VI) является наименее точным из-за недостаточной интенсивности окраски, а также присутствия ионов хрома(III), образующихся при восстановлении дихромат-иона и обладающих зеленой окраской, что затрудняет определение изменения цвета титруемого раствора в точке эквивалентности. Хроматометрическое титрование проводят в кислой среде, создаваемой, как правило, серной кислотой. Кислую среду можно создавать, прибавляя не только серную, но также фосфорную или хлористоводородную кислоту определенной концентрации. Прямое хроматометрическое титрование используют для определения восстановителей, например, соединений, содержащих железо(II), сульфиты. Cr2O72– +14H+ + 6e– → Cr3+ + 7H2O При обратном хроматометрическом титровании, используемым для определения таких окислителей, как нитраты, хлораты, перманганаты, к раствору испытуемого вещества прибавляют избыток титрованного раствора железа(II) (например, титрованного раствора железа(II) сульфата), который окисляется до железа(III) при взаимодействии с раствором испытуемого вещества. Избыток титрованного раствора железа(II) титруют стандартным раствором калия дихромата в присутствии, как правило, фосфорной кислоты. Обратное хроматометрическое титрование применяют также для определения восстановителей, которые медленно реагируют с титрованным раствором калия дихромата. Броматометрия – метод окислительно-восстановительного титрования, при котором в качестве основного титрованного раствора используют раствор калия бромата, являющийся является сильным окислителем в кислой среде. Фиксирование конечной точки титрования осуществляют с помощью индикаторов, в кислой среде окрашивающих титруемый раствор в красный цвет, исчезновение окраски титруемого раствора свидетельствует об окончании титрования. В броматометрии используют такие индикаторы, как: метиловый оранжевый, метиловый красный, нейтральный красный. При прямой броматометрии титрованным раствором калия бромата в кислой среде титруют испытуемый раствор, содержащий определяемое вещество с восстановительными свойствами. Титрованный раствор калия бромата бесцветен, также бесцветны образующиеся в процессе реакции бромид-ионы: BrO3– + 6e + 6H+ → Br– + 3H2O После достижения точки эквивалентности добавление избытка раствора калия бромата приводит к образованию брома: BrO3– + 5Br– + 6H+ → 3Br2 + 3H2O Образующийся бром окрашивает раствор в бледно-жёлтый цвет, но окраска раствора недостаточно интенсивна для визуальной фиксации конечной точки титрования. Поэтому броматометрическое титрование проводят в присутствии индикаторов, прибавляемых, как правило, в начале титрования. Индикаторы интенсивно окрашивают титруемый раствор, а после достижения точки эквивалентности необратимо взаимодействуют с образовавшимся бромом, образующимся после точки эквивалентности согласно вышеприведенной реакции. Вследствие этого титруемый раствор обесцвечивается, что является окончанием титрования. Титрование ведут медленно во избежание локального образования брома в растворе до достижения точки эквивалентности. При обратном броматометрическом титровании к раствору испытуемого вещества прибавляют избыток титрованного раствора калия бромата, затем непрореагировавшее количество титрованного раствора определяют йодометрическим методом. Определение проводят в кислой среде в присутствии достаточного количества калия бромата, необходимого для образования брома, который фактически взаимодействует с действующим веществом в качестве окислителя. Прибавлением калия йодида в реакционную смесь избыток брома переводят в йод, выделяющийся в количестве, эквивалентном избытку брома, затем йод титруют раствором натрия тиосульфата. Различают также бромид-броматный метод титрования, при проведении которого для окисления действующих веществ бромом (для бромирования) используют стандартный титрованный раствор бромид-бромата, содержащий калия бромат и калия бромид (фактически, раствор брома) в кислой среде. В зависимости от свойств определяемого вещества применяют обратное или заместительное титрование, определяют необходимые условия проведения испытания. При проведении броматометрического титрования необходимо соблюдать некоторые общие требования: титрование проводить в вытяжном шкафу с принудительной вентиляцией из-за особенностей физико-химических и токсических свойств продуктов реакции (брома), титрование проводить медленно в сильнокислой среде, для увеличения скорости реакции, в соответствии с указаниями в фармакопейной статье, растворы могут быть нагреты, для ускорения реакции могут быть использованы катализаторы, например, соли ртути(II), во многих случаях при броматометрии необходимо проводить контрольный опыт. Цериметрия – метод окислительно-восстановительного титрования, при котором в качестве основного титрованного раствора используют раствор церия сульфата(IV), являющийся в кислой среде является сильным окислителем, близким по эффективности к калия перманганату. Окислительно-восстановительный потенциал цериметрического титрования определяется не только свойствами определяемого вещества, но сильно зависит от природы и концентрации используемой кислоты, анионы которой образуют комплексные соединения с церием(IV), в форме которых церий(IV) присутствует в растворах. При прямом цериметрическом титровании веществ, обладающих восстановительными свойствами, растворы церия(IV) сульфата, имеющие в кислой среде жёлто-оранжевую окраску, изменяют её за счет образования бесцветных соединений церия(III). Ce4+ + e → Ce3+ Вместе с тем, интенсивность окраски растворов церия(IV) невелика и обычно недостаточна для визуальной фиксации конечной точки титрования безиндикаторным методом. Поэтому цериметрическое титрование, как правило, осуществляют в присутствии редокс-индикаторов, таких как ферроин, орто-фенантролин, дифениламин, 2,2'-дипиридил и др. Конечную точку титрования в цериметрии также можно определить инструментальными методами, например, потенциометрическим, амперометрическим и др. Способы обратного и заместительного титрования в цериметрии также используют. В случае обратного цериметрического титрования избыток титрованного раствора церия(IV) сульфата титруют вторым стандартным раствором, которым может быть, например, раствор железа(II) сульфата. Цериметрическое титрование можно проводить в присутствии хлоридов, что неприемлемо в перманганатометрии. Вместе с тем, метод непригоден для титрования нейтральных и щелочных растворов. Титрование по методу осаждения или осадительное титрованиеосновано на реакциях образования малорастворимых соединений, выделяющихся из раствора в виде осадка. Для осадительного титрования пригодны реакции образования осадков, которые должны отвечать следующим требованиям: - протекать количественно и быстро при обычных условиях, - не сопровождаться образованием пересыщенных растворов; - образующийся осадок должен иметь постоянный состав, не должен загрязняться в процессе осаждения, желательно быть практически нерастворимым; - результаты титрования не должны в заметной степени искажаться явлениями адсорбции (соосаждения); - должна существовать возможность фиксирования точки эквивалентности. Наибольшее значение приобрели методы осаждения, связанные с образованием малорастворимых соединений серебра, бария, ртути и др., которые дают возможность количественно определять осаждаемые ими анионы (хлориды, бромиды, иодиды, цианиды, тиоцианаты, сульфаты, хроматы), а также катионы, образующие малорастворимые соединения с указанными выше анионами. Применяя специальные приемы титрования, осадительным методом можно проводить количественное определение не только отдельных катионов или анионитов, но и их смесей. Практическое значение в фармакопейном анализе имеют аргентометрическое, меркурометрическое, бариметрическое титрование. Аргентометрия − метод осадительного титрования (титрования по методу осаждения), в котором основным стандартным раствором является титрованный раствор серебра нитрата. Метод используют для определения галогенидов, тиоцианатов, цианидов, фосфатов и других ионов. В зависимости от условий проведения различают несколько методов аргентометрии. - Метод Мора − аргенометрический метод анализа, используется для титрования хлоридов и бромидов титрованным раствором серебра нитрата в нейтральной среде в присутствии индикатора − раствора калия хромата. Йодиды не определяются методом Мора. При проведении прямого титрования испытуемого раствора титрованным раствором серебра нитрата в присутствии индикатора по достижении точки эквивалентности образуется осадок серебра хромата красно-бурого цвета: 2AgNO3 + K2CrO4 → Ag2CrO4 ↓+ 2KNO3 - Метод Фольгарда − метод аргенометрического или тиоцианатометрического титрования, в котором в качестве стандартных растворов используют титрованные растворы серебра нитрата и аммония тиоцианата или калия тиоцианата. Индикатором в этом методе являются ионы железа(III) (раствор железоаммонийных квасцов), образующие с тиоцианат-ионами соединения, окрашенные в красный цвет. Условия титрования по методу Фольгарда: титрование проводят в кислой среде, титруемый раствор необходимо энергично перемешивать, в анализируемом растворе должны отсутствовать соли ртути(I) и ртути(II), окислители тиоцианатов, анионы, образующие прочные комплексы с индикатором. Прямое титрование стандартным раствором аммония тиоцианата используют для определения соединений, содержащих ионы серебра(I) , в присутствии индикатора, содержащего ионы железа(III). При титровании вначале образуется малорастворимое соединение ионов серебра(I) и раствора аммония тиоцианата, в конечной точке титрования избыточная капля титрованного раствора реагирует с индикатором, образуется комплекс, окрашивающий раствор в красный цвет: Fe3+ + 3NCS– → [Fe (NCS)3] Обратное титрование по методу Фольгарда используют для определения галогенидов, как правило, йодидов и бромидов. К раствору испытуемого вещества-галогенида прибавляют точно отмеренный объем избытка титрованного раствора серебра нитрата, образуется осадок белого цвета. Непрореагировавший остаток (избыток) раствора серебра нитрата титруют стандартным раствором аммония тиоцианата в присутствии индикатора: Ag++NCS– → AgNCS В конце титрования при добавлении избытка раствора аммония тиоцианата, испытуемый раствор окрашивается в красный цвет. При определении йодидов рекомендуется прибавлять индикатор в конце титрования. Если необходимо, методом Фольгарда можно определить хлориды, в этом случае для более четкого фиксирования конечной точки титрования определение необходимо проводить в присутствии органических растворителей. - Метод Фаянса − метод прямого аргенометрического определения галогенидов титрованным раствором серебра нитрата в слабокислой среде с применением адсорбционных индикаторов. Применение адсорбционных индикаторов основано на использовании коллоидных свойств галогенидов серебра, образующихся при аргентометрическом титровании галогенидов. Вначале титрования в присутствии избытка галоген-ионов галогениды серебра адсорбируют ионы галогена, находящиеся в избытке в растворе, приобретая при этом отрицательный заряд. В конце титрования, когда все галоген-ионы уже связаны, галогениды серебра теряют свой заряд и наблюдается процесс коагуляции. При прибавлении даже незначительного избытка раствора серебра нитрата галогениды серебра адсорбируют ионы серебра и заряжаются положительно. Заряженные частицы обладают высокой адсорбционной способностью и притягивают к себе окрашенный анион адсорбированного индикатора, образуя с ним малорастворимое соединение. Адсорбционные индикаторы представляют собой органические соединения, являющиеся слабыми кислотами. Анионы этих индикаторов, адсорбируясь на поверхности положительно заряженных коллоидных частиц, выпадающих при аргентометрии в виде осадков, вызывают изменение цвета поверхности этих осадков. Таким образом, адсорбционные индикаторы показывают изменение цвета не в растворе, а на поверхности коллоидного осадка, несущего положительный заряд. В качестве адсорбционных индикаторов применяют: бромфеноловый синий, бромкрезеловый синий – в уксуснокислой среде; эозинат натрия – в уксуснокислой среде; флуоресцеин – в нейтральной и слабо щелочной среде. Хлориды и бромиды можно титровать с бромфеноловым синим в уксусно-кислой среде от зелено-желтого до синего окрашивания, при титровании йодидов с этим индикатором в точке эквивалентности окрашивание будет зеленым. Йодиды с эозинатом натрия титруют до розового окрашивания осадка, галогениды с флуоресцеином − до розово-красного окрашивания осадка. Меркуриметрия− титриметрический метод анализа, в котором основным стандартным раствором является титрованный раствор ртути(II) нитрата. Метод основан на образовании устойчивых слабодиссоциированных (малорастворимых) комплексных соединений ртути(II) при взаимодействии титрованного раствора ртути(II) нитрата c галогенидами, тиоцианатами, цианидами в кислой среде, достигаемой, как правило, прибавлением азотной кислоты. Меркуриметрию, как правило, рассматривают как метод осадительного титрования, но так как в результате реакции образуются комплексные соединения, то и как разновидность комплексонометрического титрования. Фиксирование точки эквивалентности проводят индикаторным и безиндикаторным методом. При прямом меркуриметрическом титровании раствор анализируемого вещества титруют стандартным раствором ртути(II) нитрата в азотнокислой среде. При взаимодействии с хлоридами, бромидами, цианидами и роданидами образуются слабо диссоциированные соединения, например: Hg2+ + Cl– ↔ [Hg Cl]+ [Hg Cl]+ + Cl– ↔ HgCl2 После достижения точки эквивалентности, когда ионы испытуемого вещества полностью прореагируют с титрованным раствором, появляются избыточные ионы ртути(II), которые обнаруживают при помощи соответствующего индикатора, образующего с избытком ионов ртути(II), характерные соединения: дифенилкарбазон или дифенилкарбазид, окрашенные в сине-фиолетовый цвет; раствор нитропруссида натрия − образует осадок белого цвета. В случае титрования йодидов точку эквивалентности (конечную точку титрования) устанавливают безиндикаторным способом − по образованию неисчезающей мути ртути(II) йодида от розового до красного цвета: Hg2+ + 4I– ↔ [HgI4]2– Hg2+ + [HgI4]2 ↔ 2HgI2 При меркуриметрическом титровании необходимо обратить внимание на создание оптимального значения рН среды для определяемого вещества. Сульфатометрия− титриметрический метод анализа, в котором основным стандартным раствором является титрованный раствор серной кислоты, предназначенный для определения бария(II) в соединениях бария. Метод прямой сульфатометрии основан на реакции осаждения бария(II) и образования малорастворимого осадка сульфата бария при взаимодействии с титрованным раствором серной кислоты. Ва2+ + SO42– → BaSO4↓ Окончание титрования фиксируют индикаторным методом.Применяют металлохромные индикаторы из группы азокрасителей — нитхромазо (нитроортаниловый С), ортаниловый А. Эти индикаторы в растворе окрашены в розовый цвет, а их комплексы с катионом бария(II) − в фиолетовый. При титровании растворов, содержащих соединения бария(II) титрованным раствором серной кислоты первоначальная фиолетовая окраска раствора, обусловленная присутствием комплексов бария с индикатором, вблизи точки эквивалентности переходит в розовую вследствие разрушения комплексов при их взаимодействии с титрантом − серной кислотой. Бариметрия− титриметрический метод анализа, в котором основным стандартным раствором является титрованный раствор бария хлорида, предназначенный для определения серной кислоты, сульфатов. Испытуемый раствор, содержащий сульфаты, титруют стандартным раствором бария хлорида с использованием индикаторов, указанных в сульфатометрии, при этом изменение окраски раствора происходит из розовой в фиолетовую. |