Строение атома. Химическая связь по дисциплине Химия Вариант 1, задание 1
 Скачать 106 Kb. Скачать 106 Kb.
|
|
Примеры решения заданий домашнего задания по теме «Строение атома. Химическая связь» по дисциплине «Химия» Вариант № 1, задание № 1 Составить электронную и электронно-графическую формулу элементов с порядковыми номерами 38 и 42 и их ионов. Охарактеризовать их положение в ПСЭ (номер периода, группы, тип элемента, формулы гидридов и высших оксидов). Ход решения: Рассмотрим элемент с порядковым номером 38. Это – стронций Sr. Полная электронная формула этого элемента 1s22s22p63s23p64s23d104p65s2. Электронно-графическая формула: 5  s ↑↓ s ↑↓4p    ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓3      d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓4  s ↑↓ s ↑↓3    p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓3  s ↑↓ s ↑↓ 2        p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓2  s ↑↓ s ↑↓1  s ↑↓ s ↑↓Стронций находится в пятом периоде, во II А группе (главной подгруппе), на последнем электронном уровне у него 2 электрона, последним заполняется s- подуровень – это s-элемент. Он относится к металлам. Образует один ион – Sr2+. Его электронная формула: 1s22s22p63s23p64s23d104p65s0, а электронно-графическая: 5  s s 4p    ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓3      d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓4  s ↑↓ s ↑↓3    p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓3  s ↑↓ s ↑↓ 2    p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓2  s ↑↓ s ↑↓1  s ↑↓ s ↑↓Sr образует гидрид состава SrН2 и оксид SrО. Элемент с порядковым номером 42 это – молибден Мо. Полная электронная формула этого элемента 1s22s22p63s23p64s23d104p65s14d5 – наблюдается «проскок» электрона с внешнего s- подуровня на 4d, что связано с большей устойчивостью полу-заполненного или полностью заполненного d-подуровня. Электронно-графическая формула атома молибдена: 4      d ↑ ↑ ↑ ↑ ↑ d ↑ ↑ ↑ ↑ ↑5  s ↑ s ↑4p    ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓3      d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓4  s ↑↓ s ↑↓3    p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓3  s ↑↓ s ↑↓ 2    p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓2  s ↑↓ s ↑↓1  s ↑↓ s ↑↓Молибден находится в пятом периоде, во VI В группе (побочной подгруппе), на последнем электронном уровне у него 6 электронов, последним заполняется d-подуровень – это d-элемент. Он относится к металлам. Образует несколько ионов, например, Mo2+. Его электронная формула: 1s22s22p63s23p64s23d104p65s04d4, так как при образовании катионов d-элементов в первую очередь уходят s-электроны. Электронно-графическая формула иона Mo2+: 4      d ↑ ↑ ↑ ↑ d ↑ ↑ ↑ ↑ 5  s s 4p    ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓3      d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓4  s ↑↓ s ↑↓3    p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓3  s ↑↓ s ↑↓ 2    p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓2  s ↑↓ s ↑↓1  s ↑↓ s ↑↓Мо, как и большинство переходных металлов, образует гидрид переменного состава и высший оксид МоО3, так как высшая степень окисления элемента, как правило, совпадает с номером группы, т.е. равна +6. Вариант № 1, задание № 2 Записать наборы квантовых чисел для 41 и 54 электрона элемента Та. Ход решения: Запишем электронную формулу элемента Та: 1s22s22p63s23p64s23d104p65s24d105p66s25d3. Найдем, на каких подуровнях находятся 41-й и 54-й электроны. 1s22s22p63s23p64s23d104p65s24d105p66s25d3 38ē| 54ē| Таким образом, 41-й электрон находится на 4d-подуровне, а 54-й – на 5р-подуровне. Определим полный набор квантовых чисел для этих электронов:      4d 4d ml = -2 -1 0 +1 +2 Т  ак как, заполнение электронами орбиталей идет по правилу Хунда, то 41-й электрон будет находиться на орбитали с магнитным квантовым числомml = 0 и спиновым квантовым числомsl = +1/2 : ак как, заполнение электронами орбиталей идет по правилу Хунда, то 41-й электрон будет находиться на орбитали с магнитным квантовым числомml = 0 и спиновым квантовым числомsl = +1/2 :     4d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 4d ↑↓ ↑↓ ↑↓ ↑↓ ↑↓Тогда полный набор квантовых чисел для 41-го электрона будет таким: n = 4 (четвертый энергетический уровень), l = 2 (d-подуровень),ml = 0 (третья орбиталь на подуровне), sl = +1/2 (первый электрон на орбитали). А  налогично, для 54 ē: налогично, для 54 ē:5    р ↑↓ ↑↓ ↑↓ р ↑↓ ↑↓ ↑↓ ml = -1 0 +1 n = 5 (пятый энергетический уровень), l = 1 (р-подуровень),ml = +1 (третья орбиталь на подуровне), sl = –1/2 (второй электрон на орбитали, и последний – на подуровне). Вариант № 1, задание № 3 По набору квантовых чисел последнего электрона определить элементы: а) n=4, l=1; ml = 0; sl = 1/2; б) n=5, l=2; ml = -1; sl =-1/2 Ход решения: а) n=4, l=1, следовательно, последний электрон находится на четвертом энергетическом уровне на р-подуровне. Составим электронно-графическую формулу данного подуровня и определим последний электрон: 4p    ↑ ↑ ↑ ↑ ml = -1 0 +1 sl = ½, значит, согласно правилу Хунда, это – второй электрон на р-подуровне. Электронная конфигурация последнего подуровня: …4p2. Следовательно, искомый элемент – элемент с порядковым номером 32 германий Ge. Его электронная конфигурация [Ar] 4s23d104p2. б) n=5, l=2, следовательно, последний электрон находится на пятом энергетическом уровне на d-подуровне. Составим электроно-графическую формулу данного подуровня и определим последний электрон:      4d ↑↓ ↑↓ ↑ ↑ ↑ 4d ↑↓ ↑↓ ↑ ↑ ↑ml = -2 -1 0 +1 +2 sl = -½, значит, согласно правилу Хунда, это – седьмой электрон на d-подуровне. Электронная конфигурация последнего подуровня: …5d7. Так как, по правилам Клечковского заполнение 5d-подуровня происходит в 6-м периоде, то искомый элемент – элемент с порядковым номером 77 иридий Ir. Его электронная конфигурация [Xe] 6s24f145d7. Вариант № 1, задание № 4 Укажите предыдущий и последующий энергетические уровни: а) 4f б) 3d Ход решения: Заполнение электронами орбиталей идет по мере увеличения суммы (n+l) (1-е правило Клечковского). При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n(2-еправило Клечковского). Таким образом, энергия орбиталей возрастает в ряду 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f5d<6p<7s<5f6d, и, следовательно, а) перед 4f заполняется 6s-подуровень, а после - 5d; б) перед 3d заполняется 4s-подуровень, а после - 4p. Вариант № 1, задание № 5 Для Ca2+ приведите изоэлектронные структуры (атом и ионы, не менее 3) Ход решения: Изоэлектронные структуры – это частицы с одинаковым числом электронов. Ион Ca2+ содержит 18 электронов: Ca0 – 2 ē → Ca2+ Его электронная формула: 1s22s22p63s23p64s0 Такую же электронную конфигурацию имеют атом Ar, ионы Cl‾, S2‾, K+, Sc3+. Вариант № 1, задание № 6 Составить электронную и электронно-графическую формулы атома с порядковым номером 14 в нормальном и возбужденном состоянии. Какие степени окисления для него характерны? Объяснить, почему? Ход решения: Элемент с порядковым номером 14 – кремний Si. Полная электронная формула этого элемента 1s22s22p63s23p2. Электронно-графическая формула: 3    p ↑ ↑ p ↑ ↑ 3  s ↑↓ s ↑↓ 2        p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓2  s ↑↓ s ↑↓1  s ↑↓ s ↑↓В возбужденном состоянии происходит распаривание валентных 3s-электронов с переходом одного электрона на 3p-подуровень: hν Si → Si* 1s22s22p63s13p3 3    p ↑ ↑ ↑ p ↑ ↑ ↑3  s ↑ s ↑ 2        p ↑↓ ↑↓ ↑↓ p ↑↓ ↑↓ ↑↓2  s ↑↓ s ↑↓1  s ↑↓ s ↑↓Кремний находится в 3 периоде, IVА группе, р-элемент, неметалл. Характерные степени окисления: -4 (№ группы – 8) – 4 неспаренных электрона возбужденного атома Si образуют 4 ковалентных связи в соединениях с менее электроотрицательными элементами; +2 (№ группы – 2) - 2 неспаренных валентных электрона в основном состоянии атома Si образуют 2 ковалентные связи с более электроотрицательными элементами; +4 (№ группы, максимальная степень окисления) - 4 неспаренных валентных электрона возбужденного атома Si образуют 4 ковалентные связи с более электроотрицательными элементами. Вариант № 1, задание № 7 Определить степень окисления центрального атома в соединениях: а) K2Cr2O7 б) HNO3 в) NH4OH Ход решения: Для определения степени окисления используем следующие правила: - водород в соединениях имеет степень окисления +1, за исключением гидридов активных металлов; - степень окисления кислорода в соединениях обычно - 2; - металлы IА группы периодической таблицы Д.И. Менделеева имеют постоянную положительную степень окисления, равную номеру группы, т.е. +1; - в молекулах алгебраическая сумма степеней окисления атомов равна нулю. Таким образом, для а) K2 +1Cr2 хO7-2: 2∙(+1) + 2х + 7∙(-2) = 0, откуда х = +6; б) H+1NхO3-2: +1 + х + 3∙(-2) = 0, откуда х = +5; в) NхH4+1O-2H+1: х + 4∙(+1) – 2 + 1 = 0, откуда х = -3. Вариант № 1, задание № 8 Указать тип кристаллической решетки в соединениях: а) сплав меди и никеля б) KMnO4 в) С6H6 Ход решения: а) Сплав меди и никеля образован двумя металлами, которые кристаллизуются в металлической кристаллической решетке. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью. б) KMnO4 – это ионный кристалл, в котором между катионами К+ и перманганат-анионами MnO4‾ имеется ионная связь. Обычно ионные кристаллы твердые, но хрупкие, отличаются высокими температурами плавления. В расплавленном состоянии электропроводны. При растворении в воде диссоциируют на катионы и анионы, растворы проводят электрический ток. в) С6H6. В узлах кристаллической решетки находятся молекулы органического вещества, т.е. кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток. Практически все твердые органические вещества образуют молекулярные кристаллы. Вариант № 1, задание № 9 Какой вид химической связи реализуется в соединениях: а) NaClO3 б) Br2 в) SO3 Ход решения: а) NaClO3 : между катионами Na+ и хлорат-анионами ClO3 - имеется ионная связь, а в анионе между атомами Cl и O – ковалентная полярная связь по обменному механизму (разность относительных электроотрицательностей атомов Cl и O не велика, число неспаренных электронов в атомах соответствует числу ковалентных связей); б) Br2: между между атомами Br образуется ковалентная неполярная связь по обменному механизму (два одинаковых атома обладают одинаковой электроотрицательностью, следовательно, нет смещения электронной плотности ни к одному из атомов); в) SO3: между атомами S и O образуется ковалентная полярная связь по обменному механизму. Вариант № 1, задание № 10 Для соединений SF6 и SnCl2 записать: а) структурные формулы, определить число σ- и π-связей в молекуле; б) электронные и электронно-графические формулы центрального атома в основном, и, если надо – в возбужденном состоянии; в) определить тип гибридизации, геометрию молекул и валентные углы; г) изобразить схему перекрывания орбиталей. Ход решения: В молекуле SF6 центральный атом – сера. Структурная формула:  В молекуле 6 σ-связей. Электронная формула атома S в основном состоянии: 1s22s22p63s23p4 Электронно-графическая формула валентных орбиталей: 3    p ↑↓ ↑ ↑ p ↑↓ ↑ ↑3  s ↑↓ s ↑↓ Число неспаренных электронов не совпадает с числом связей в молекуле, поэтому рассмотрим возбужденное состояние, в котором сера шестивалентна (3s13p33d2): 1s22s22p63s23p64s23d104p65s2. Электронно-графическая формула: 3      d ↑ ↑ d ↑ ↑3    p ↑ ↑ ↑ p ↑ ↑ ↑3  s ↑ s ↑ Тип гибридизации валентных орбиталей серы s1p3d2, углы связей – 900, геометрическая форма молекулы – октаэдр: 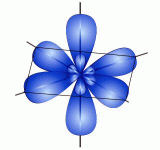 Дипольные моменты связей S – F не равны нулю, т.к. атомы имеют разные значения электроотрицательностей (ΔЭО≠) (μS-F≠0). Дипольный момент всей молекулы равен нулю, т.к. геометрически молекула (октаэдр) симметрична: μ =0. Структурная формула молекулы SnCl2: Cl–Sn–Cl В молекуле 2 σ-связи. Электронная формула атома Sn в основном состоянии: 1s22s22p63s23p64s23d104p65s25p2. Электронно-графическая формула валентных орбиталей: 5p    ↑ ↑ ↑ ↑ 5  s ↑↓ s ↑↓Число неспаренных электронов равно числу связей в молекуле, поэтому тип гибридизации валентных орбиталей олова sp2, геометрическая форма молекулы – плоский треугольник, валентные углы меньше 1200, так как у атома олова есть неподеленная электронная пара, также участвующая в гибридизации:  Дипольные моменты связей Sn – Cl не равны нулю, т.к. атомы имеют разные значения электроотрицательностей (ΔЭО≠) (μSn–Cl ≠0). В целом молекула также полярна, поскольку дипольный момент всей молекулы равен векторной сумме дипольных моментов отдельных связей. Составил: доцент О.И. Михайленко Зав.кафедрой "Общая и аналитическая химия" профессор С.С. Злотский |
