хим10,. Строение карбоксильной группы
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
|
Строение карбоксильной группы Строение карбоксильной группы Строение карбоксильной группы. Карбоксильная группа объединяет в себе две функциональные группы – карбонильную = CO [3] и гидроксильную –OH [4], оказывающие друг на друга взаимное влияние. Карбоксильная группа представляет собой сопряженную систему, в которой неразделенная пара электронов атома кислорода гидроксильной группы вступает в сопряжение с `0,-электронами карбонильной группы (р, R03,R03,п-сопряжение). Электронная плотность в сопряженной системе смещена в сторону атома кислорода карбонильной группы, неразделенные пары электронов которого не участвуют в процессе. Вследствие смещения электронной плотности, связь О-Н оказывается сильно поляризованной, что приводит к появлению у карбоксильной группы ОН-кислотного центра. В то же время, за счет группы ОН, в молекулах карбоновых кислот частично положительный заряд на атоме углерода карбонильной группы несколько уменьшается, по сравнению с альдегидами [5] и кетонами [6]. Кроме того, в результате –І-эффекта карбоксильной группы в молекуле карбоновой кислоты происходит смещение электронной плотности углеводородного остатка, что приводит к появлению С-Н-кислотного центра при ^5,-карбоновом атоме. Исходя из указанного строения карбоновых кислот, их основные реакции можно условно разделить на четыре группы: с участием связи О-Н (кислотные свойства), реакции нуклеофильного замещения с участием атома углерода карбонильной группы, замещения атомов водорода при ^5,-карбоновом атоме, окисления и восстановления. Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду, и, вызванной тем самым, дополнительной (по сравнению со спиртами) поляризацией связи О-Н. В водном растворе карбоновые кислоты диссоциируют на ионы: R-COOH = R-COOW22, + H+ Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается. Наиболее известным фактом о карбоксильных группах является то, что они входят в состав аминокислот (одновременно с аминогруппами [7]). 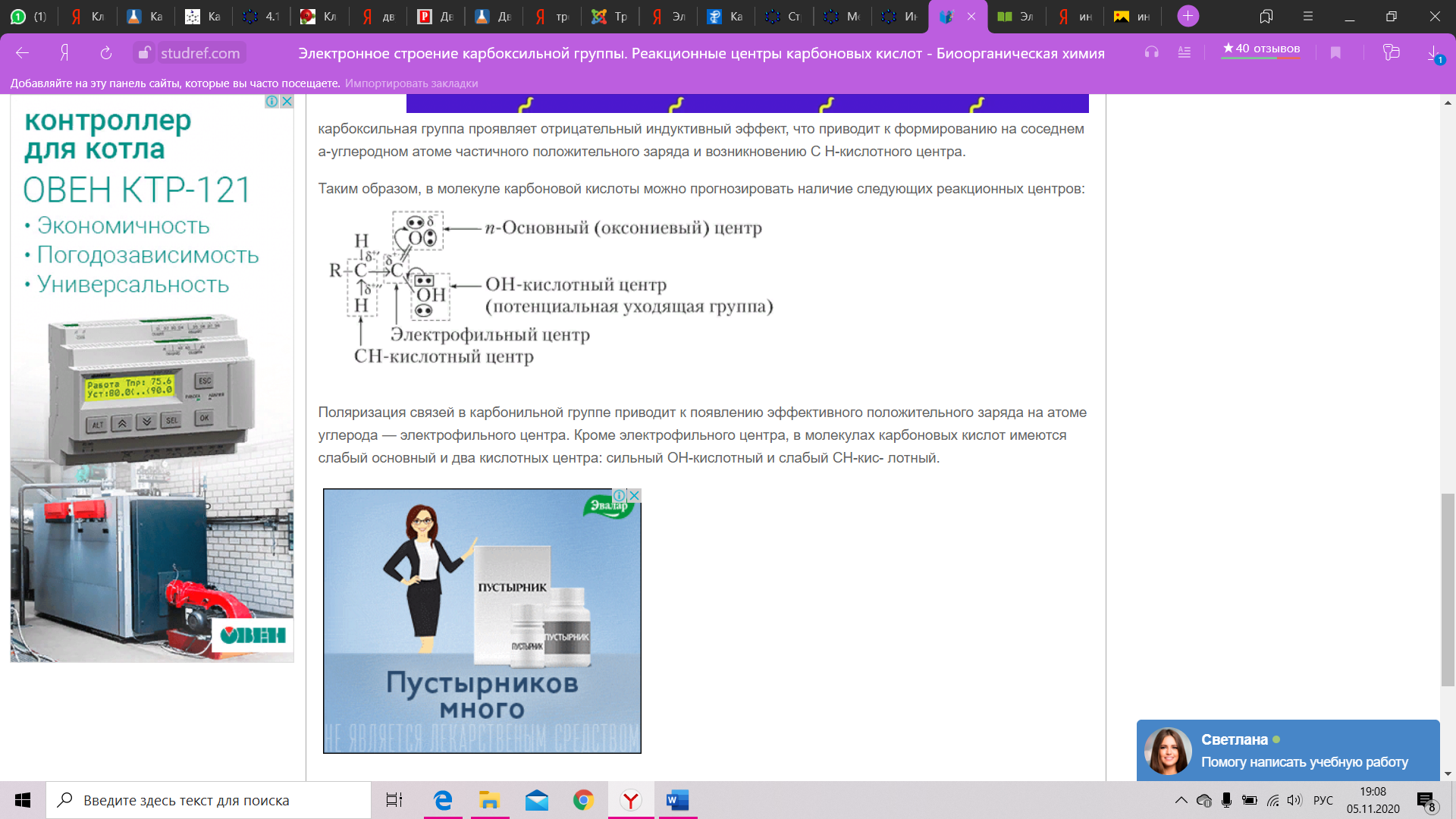 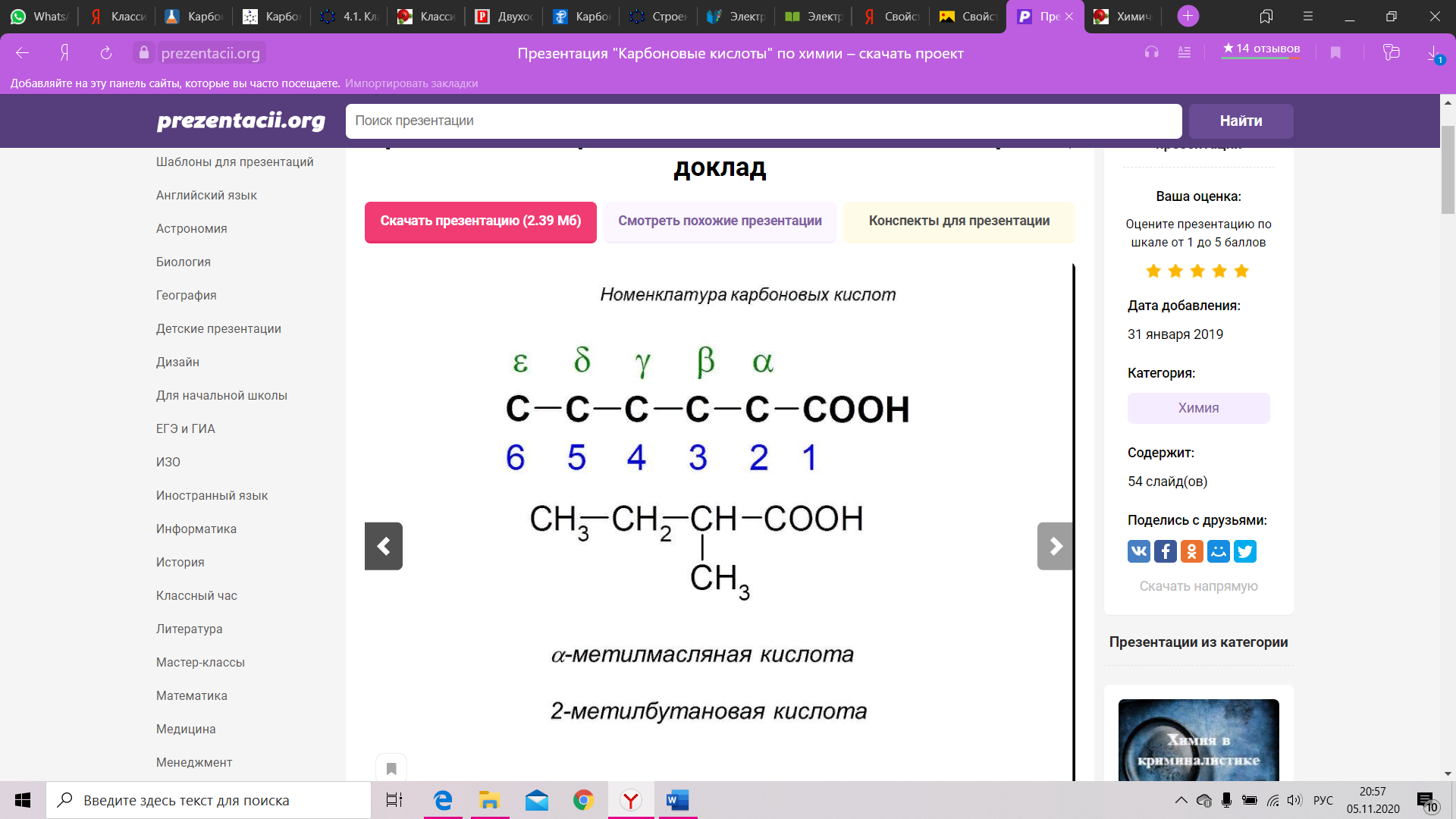 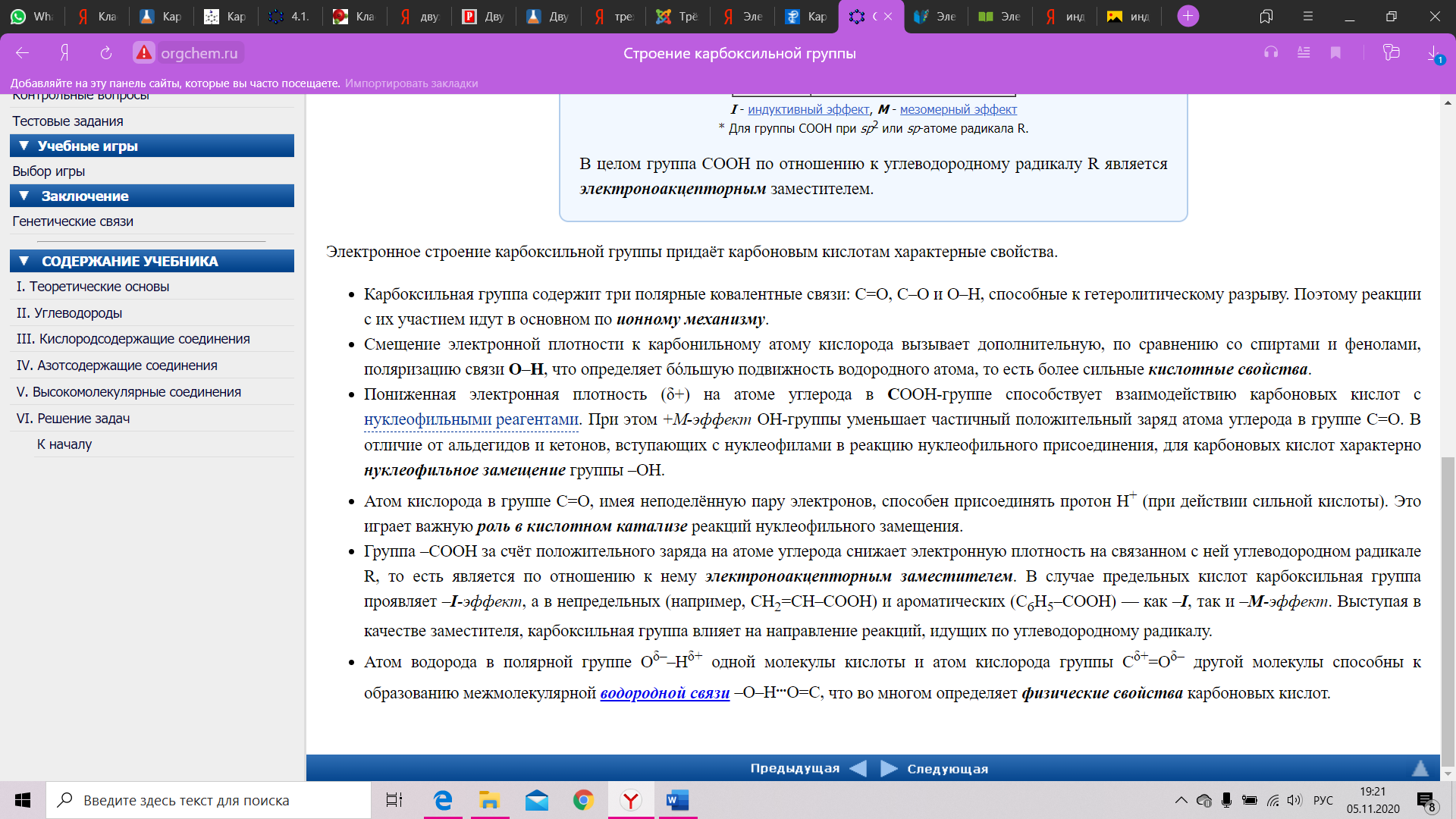 Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью >C=O. 1. Высокая полярность связи С=О вызывает на карбонильном атоме углерода значительный дефицит электронной плотности (Cδ+), и по этому атому углерода возможна нуклеофильная атака. При этом, взаимодействие с нуклеофилами приводит к разрыву π-связи и образованию более прочной σ-связи. 2. Высокая полярность связи С=О вызывает на атоме углерода, соседнем с карбонильной группой (α-углеродном атоме), повышенную полярность связи С-Н α-углеродного атома. Это характеризует данные соединения как СН-кислоты. Для альдегидов и кетонов наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения (AN). Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам: Самый активный из альдегидов – формальдегид Н2СО. ГАЛОФОРМНАЯ РЕАКЦИЯ (галоформное расщепление), расщепление соед., содержащих ацетильную группу, под действием щелочи и галогена (или гипогалогенита) на карбоновые к-ты, в молекулах которых на один атом С меньше, чем в исходном соед., и на галоформ (хлороформ, бромоформ или йодоформ), Р-цию проводят при 0-20 °С (реже при 50-70 °С) в воднодиоксановом растворе или в воде при строгом контроле рН. Выходы галоформа и карбоновой кислоты достигают 90%, но уменьшаются, если R в алкилметилкетоне содержит атомы Н, легко замещаемые на галоген, или если реакцию проводят в слишком разбавленных растворах. В последнем случае в кач-ве побочного продукта может образовываться тетрагало-генид углерода: (((Низшие альдегидылегко вступают в реакцию полимеризации за счет С=О связи. Так, формальдегидлегко образует линейный полимер – параформальдегид (параформ) или циклическиетри- и третрамеры.)))) КОНДЕНСАЦИЯ ФЕНОЛА С ФОРМАЛЬДЕГИДОМ 3. Полимеризация карбонильных соединений протекает с раскрытием двойной связи С=О и свойственна, в основном, альдегидам. При упаривании в вакууме водных растворов формальдегида образуется смесь циклических соединений (в основном, триоксиметилен) и линейных продуктов с незначительной длиной цепи n = 8–12 (параформ). Полимеризацией циклического продукта получают полиформальдегид (рис. 6) – полимер с высокой прочностью и хорошими электроизоляционными свойствами, используемый как конструкционный материал в машино- и приборостроении. ПРОДУКТЫ ПОЛИМЕРИЗАЦИИ ФОРМАЛЬДЕГИДА 4. Восстановление и окисление. Альдегиды и кетоны представляют собой как бы промежуточные соединения между спиртами и карбоновыми кислотами: восстановление приводит к спиртам, а окисление –- к карбоновым кислотам. При действии Н2 (в присутствии катализатора Pt или Ni) либо других восстанавливающих реагентов, например, LiAlH4, альдегиды восстанавливаются, образуя первичные спирты, а кетоны – вторичные спирты (рис. 7, схемы А и Б). Окисление альдегидов до карбоновых кислот проходит достаточно легко в присутствии О2 или при действии слабых окислителей, таких как аммиачный раствор гидроксида серебра (рис. 7В). Эта эффектная реакция сопровождается образованием серебряного зеркала на внутренней поверхности реакционного прибора (чаще, обычной пробирки), ее используют для качественного обнаружения альдегидной группы. В отличие от альдегидов, кетоны более устойчивы к окислению, при их нагревании в присутствии сильных окислителей, например, КМnО4, образуются смеси карбоновых кислот, имеющих укороченную (в сравнении с исходным кетоном) углеводородную цепь. |
