Свойства альдегидов и кетонов
 Скачать 34.75 Kb. Скачать 34.75 Kb.
|
|
Свойства альдегидов и кетонов Цель: исследовать получение и свойства альдегидов и кетонов. Образовательные результаты, заявленные во ФГОС: Студент должен уметь: применять безопасные приемы при работе с органическими реактивами и химическими приборами; проводить реакции с органическими веществами в лабораторных условиях; знать: получение и химические свойства альдегидов и кетонов. Альдегиды – органические соединения, содержащие альдегидную группу – СНО, связанную с углеводородным радикалом. Кетоны - органические соединения, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.Альдегиды являются более активными, чем кетоны (у кетонов карбонил как бы блокирован радикалами с обеих сторон). Альдегиды получают путем окисления спиртов. Из первичных спиртов получаются альдегиды, из вторичных кетоны. Окисление спиртов происходит при действии сильных окислителей (хромовая смесь) при небольшом нагревании. По реакции Кучерова (из алкинов и воды, катализатор - соли ртути в кислой среде). Из ацетилена образуются альдегиды, из любых других алкинов - кетоны. В химическом отношении альдегиды более активны, чем кетоны. Для них характерны следующие реакции: окисления, присоединения, замещения, полимеризации, конденсации. Для кетонов не характерны реакции полимеризации. При окислении альдегидов образуются карбоновые кислоты. Окисление кетонов происходит гораздо труднее и только сильными окислителями. Продуктами окисления являются карбоновые кислоты. При окислении кетона образуется спиртокетон, затем дикетон, который, разрываясь, образует кислоты. Реакции присоединения протекают за счет разрыва π-связи в карбониле. Эти реакции нуклеофильного присоединения, то есть сначала к положительно заряженному углероду карбонила присоединяется нуклеофильная часть реагента со свободной электронной парой (протекает медленно). Кислород карбонильных групп может замещаться на галогены и некоторые азотсодержащие соединения. Замещение галогенами происходит при действии на альдегиды и кетоны фосфорных соединений галогенов (PCl3 и PCl5). Реакции полимеризации характерны только для альдегидов. Но и то, только газообразные и летучие альдегиды (муравьиный, уксусный) подвергаются полимеризации. Это очень удобно при хранении этих альдегидов. Реакции конденсации подвергаются альдегиды в слабо основной среде (в присутствии ацетона калия, поташа, сульфата калия) подвергаются альдольной конденсации с образованием альдегидо-спиртов, сокращенно называемых альдолями. Порядок выполнения работы Приборы и реактивы: штатив с пробирками, тигельные щипцы, пробиркодержатель, асбестированная сетка, спиртовка, спички, раствор формальдегида, ацетон в растворе, этанол, пропанол-2, серная кислота (разб. 1:5), аммиачный раствор оксида серебра, растворы йода, гидроксида натрия (10%-ный), сульфата меди (II), уксусного альдегида. Опыт № 1 Получение уксусного альдегида и ацетона окислением спиртов оксидом меди (II): а) Окисление этанола Налейте в пробирку 2 – 3мл этанола. Медную спираль из проволоки прокалите в пламени спиртовки, держа ее тигельными щипцами, до появления черного налета оксида меди (II), затем опустите в пробирку со спиртом. Черная поверхность спирали становится золотистой. Снова прокалите медную спираль и опустите в спирт. Повторите это несколько раз до появления запаха уксусного альдегида (свежескошенной травы, свежей листвы). Напишите уравнение реакции в молекулярном и структурном виде, дайте название органическим веществам. б) Окисление пропанола-2 Повторите опыт с пропанолом-2. Напишите уравнение реакции в структурном виде, дайте название органическим веществам. Опишите наблюдаемые в опыте явления, сделайте вывод, дав им объяснение. Опыт № 2 Окисление формальдегида а) Реакция «серебряного зеркала» В чистую пробирку поместите 1 мл аммиачного раствора оксида серебра и 1 мл формальдегида. Встряхните и осторожно нагрейте смесь в пламени (результат будет лучше, если использовать водяную баню). На стенках пробирки появляется блестящий зеркальный налет чистого серебра, т.к. происходит окислительно-восстановительная реакция. Напишите уравнение реакции в структурном виде окисления метаналя до муравьиной кислоты, определите степень окисления атомов серебра и углерода до и после реакции. б) Окисление свежеосажденным гидроксидом меди (II). В пробирку с 1–2 мл щелочи прибавьте 2 капли раствора сульфата меди (II) до образования осадка голубого цвета, затем внесите 1мл формалина, энергично перемешайте встряхиванием и нагрейте в пламени спиртовки. Наблюдается изменение окраски из голубого через желтый и далее до кирпично-красного. При плохом перемешивании возможно частичное окрашивание в черный цвет. Напишите уравнение реакции и наблюдения с объяснением, используя схемы: 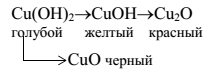 Опыт № 3. Образование йодоформа из ацетальдегида и ацетона Налейте в две пробирки по 1 мл разбавленных растворов ацетона и ацетальдегида, добавьте по 1 мл раствора йода и несколько капель раствора щелочи до исчезновения окраски. В обеих пробирках без нагревания сразу образуется желтый осадок йодоформа с характерным запахом. Вследствие ничтожной растворимости йодоформа в воде реакция очень чувствительна и позволяет, например, обнаружить содержание в воде 0,04% ацетона Реакции идут по схеме: 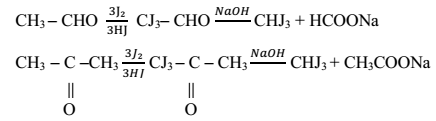 В соответствии со схемами напишите четыре уравнения реакций, дайте названия органическим веществам, объясните наблюдения Выполните задания: 1. Напишите структурные формулы карбонильных соединений, образующихся при окислении спиртов: амилового, изопропилового, бензилового, изоамилового, учитывая, что альдегиды образуются при окислении первичных спиртов, а кетоны – вторичных. 2. Напишите в структурном виде реакции взаимодействия с оксидом меди (II) следующих веществ: а) 3-метилбутанол-1; б) 2,2-диметилпропанол-1; в) пентанол-2; г) пентанол-3. Дайте название продуктам. 3. Напишите уравнение реакции окисления метанола до метаналя подкисленным раствором перманганата калия, пользуясь схемой: СН3ОН + КМnO4→НСНО + МnO2 + КОН + Н2O Определите степень окисления атомов элементов, расставьте коэффициенты методом электронного баланса, назовите окислитель и восстановитель. 4. Напишите уравнение реакции окисления пропанола до пропаналя дихроматом калия в кислой среде, расставьте коэффициенты методом электронного баланса. |
