блок_2[1]. 1. Методы синтеза предельных и ,непредельных альдегидов и кетонов из спиртов, галоидных алкилов, из карбоновых кислот и их производных, алкенов, алкинов (реакция Кучерова),
 Скачать 1.22 Mb. Скачать 1.22 Mb.
|
|
1.Методы синтеза предельных и ,-непредельных альдегидов и кетонов: из спиртов, галоидных алкилов, из карбоновых кислот и их производных, алкенов, алкинов (реакция Кучерова), оксосинтезом, с помощью магнийорганических соединений и альдольно-кротоновой конденсации.Исключительно важна в орг. синтезе альдольная конденсация с образованием гидроксиальдегидов. Последние легко отщепляют воду, превращаясь в Окисление спиртов Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот. Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (т.кип. альдегида, не образующего межмолекулярные водородные связи, ниже т.кип. спирта и кислоты). При окислении вторичных спиртов образуются кетоны. В промышлености альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn). Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления. Гидратация алкинов (реакция Кучерова) Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида: Кетоны получают при гидратации других гомологов ряда алкинов: Окисление алкенов (катализаторы - хлориды Pd и Cu) Этот способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы. Кумольный способ получения ацетона (наряду с фенолом). Получение с помощью магний- и цинкорганических соединений Как было показано., при взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме В случае производных муравьиной кислоты, например ее сложного эфира, реакция протекает следующим образом: Если на полученные соединения подействовать водой, то они реагируют с ней с образованием впервом случае кетонов, а во втором — альдегидов: При действии магнийорганических соединений на ортомуравьиный эфир происходит обмен радикала магнийорганического соединения на один из радикалов ОС2Н5 (этоксил), причем получается ацеталь альдегида (А. Е. Чичибабин, Бодру): Ацеталь в присутствии кислоты омыляется, образуя альдегид: 2.Полярность и поляризуемость карбонильной группы. Особенности строения и реакционной способности альдегидов и кетонов. Реакции нуклеофильного присоединения к оксосоединениям: бисульфита натрия, цианистого водорода, азотистых оснований, спиртов, металлорганических соединений. Свойства продуктов реакции. Реакции Реппе, Фаворского, Принса.Поляризуемостью молекулы (иона, связи) называют способность ее к поляризации. В то же время карбонильная группа имеет значительную поляризуемость. Причины полярности и поляризуемости кроются в особенностях строения карбонильной группы. Нуклеофильные и электрофильные реагенты (основания и кислоты Льюиса) характеризуются различной поляризуемостью и качественно могут быть подразделены на жесткие и мягкие. Жесткими реагентами называются основания и кислоты Льюиса, которые содержат донорныи центр или акцепторный центр с низкой поляризуемостью. Мягкими реагентами называются основания и кислоты Льюиса, которые содержат донорныи центр или акцепторный центр с высокой поляризуемостью. Строение карбонильной группы C=O. Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные p-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд. Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+. В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает. Реакции нуклеофильного присоединения. Альдегиды и кетоны, обладая электрофильным центром, способны вступать во взаимодействие с нуклеофильными реагентами. Для оксосоединений наиболее характерны реакции, протекающие по механизму нуклеофильного присоединенияобозначаемому АN (от англ. additionnucleophilic). 1. Реакция с циановодорооной (синильной) кислотой.Реакция имеет важное значение в органической химии. Во-первых, в результате реакции можно удлинить углеродную цепь; во-вторых, продукты реакции — гидроксинитрилы — служат исходными соединениями для синтеза гидроксикарбоновых кислот: 2. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали. Полуацеталями называются соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную группы. Ацетали — это соединения, содержащие при одном атоме углерода две алкоксильные группы: 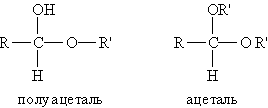 Реакцию получения ацеталей широко используют в органических синтезах для “защиты” активной альдегидной группы от нежелательных реакций: Особенно важное значение подобные реакции имеют в химии углеводов. 3. Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде, поскольку полученное сульфопроизводное очень легко гидролизуется: 4. Присоединение реактива Гриньяра. В органическом синтезе чрезвычайно часто используется реактив Гриньяра — одно из простейших металлоорганических соединений. При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра: где R — алкильный или арильный радикал, Х — галоген. а) Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньярагидролизуют водой: б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты: в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты: РЕППЕ РЕАКЦИИ. 1) Синтез карбоновых к-т и их производных взаимод. СО с разл. орг. соединениями (в т.ч. с ненасыщ. углеводородами) и соединениями с подвижным атомом Н, напр.: RC=CH + СО + НХ : RCH=CHC(O)X 2RCH=CH2 + 2СО + 2НХ : RCH2CH2C(O)X + CH3CHRC(O)X ROH + CO + HX : RC(O)X + H2O ROR' + CO + HX : RC(O)X + ROH X = HO,R:O,HS,R:S,R:COO,NHR: Реппе реакция относится к р-циям карбонилирования. Ее осущест-вляют в присут. карбонилов металлов (обычно карбонилы Со или Ni), к-рые служат катализаторами, а при их избытке-и источниками СО. В зависимости от соотношении кол-ва используемых в р-ции карбонилов металлов иреагентов различают два осн. способа ее проведения-"стехио-метрический" и "каталитический". В первом способе карбонилы металлов и др.реагенты берутся в стехиометрия, кол-вах; р-ция проходит при относительно низких давлениях и т-рах: 5-10 МПа, 50-60 °С (ацетилены) и 160-170 °С (оле-фины). Во втором способе карбонилы металлов берутся в небольших (каталитич.) кол-вах; р-цию осуществляют с использованием стехиометрич. кол-в СО при давлении ок. 20 МПа и т-рах 150-180°С (для ацетиленов) и 180-200°С (для олефинов). Карбонилирование ацетилена приводит к акриловой к-те. Монозамещенные ацетилены обычно образуют один продукт, дизамещенные-два возможных изомера: СН3С=СН + СО + Н2О : СН2=С(СН3)СООН 2РhС=ССН3 + 2СО + 2Н2O :PhCH=C(CH3)COOH + CH3CH=C(Ph)COOH 2RCH=CHR' + 2СО + 2Н2О : RCH2CHR'COOH + + R'CH2CHRCOOH При карбонилировании гем-дизамещенных этилена доля триалкилуксусной к-ты не превышает, как правило, 15%: RR'C=CH2 + СО + H2О : RR'CHCH2COOH + + CH3CRR'COOH ФАВОРСКОГО РЕАКЦИИ. 1) Перегруппировка a-га-логенкетонов в карбоновые к-ты, их эфиры или амиды при действии оснований - соотв. щелочей,алкоголятов или аминов (наз. также перегруппировкой Фаворского): Обычно галогенкетон смешивают с конц. р-ром основания (напр., в спирте) или с суспензией основания в р-рителе (этаноле, эфире, толуоле) при т-ре от -20 до +30 0C. Реакц. смесь выдерживают 10-30 мин (в случае низкореакционно-способных кетонов - 2-4 ч при нагр.). Выходы 30-70%. В классич. варианте перегруппировки радикал R содержит атом H у Перегруппировка циклич. кетонов протекает с сужением цикла, напр.: Реакция Принса (реакция Кривица-Принса) - реакция электрофильного присоединения альдегидов или кетонов к алкенам с последующим присоединением нуклеофила к образовавшемусякарбокатиону. Реакция впервые осуществлена Кривицем в 1899г. и детально изучена в 1917 г. Принсом на примере присоединения формальдегида к алкенам с дальнейшим взаимодействием с водой с образованием 1,3-диолов. В классическом варианте реакции в качестве карбонильного компонента используется формальдегид 1 и основным продуктом реакции являются 1,3-диолы 3 [1], именно в этом варианте она описана нииболее широко. Вместе с тем, в зависимости от условий проведения реакции образующиеся 1,3-диолы 3 могут подвергаться дальнейшим превращениям, наиболее частыми из них являются образование с избытком формальдегида циклических ацеталей - 1,3-диоксанов 5 и дегидратация с образованием аллиловых спиртов 4: 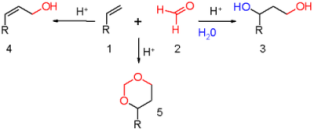 3.4. Окислительно-восстановительные реакции оксосоединений. Восстановление до спиртов и углеводородов Восстановительное аминирование кетонов. Качественные реакции на альдегиды и кетоны. Оксосоединения – это органические соединения, содержащие в молекуле оксогруппу ( -С = О). Реакция с реактивом Толленса («серебряного зеркала»).В данной реакции происходит окисление альдегида до карбоновой кислоты. Реакция относится к типу окислительно–восстановительных. Альдегид окисляется, серебро осстанавливается.R - CH = O + Ag+1(NH3)2OH = R - COOH + Ag0+ NH3 + H2O Реакция с реактивом Феллинга.В данной реакции происходит окисление альдегида до карбоновой кисло-ты. Реакция относится к типу окислительно – восстановительных. Альдегид окисляется, медь восстанавливается. 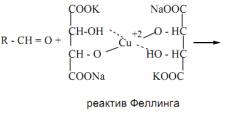 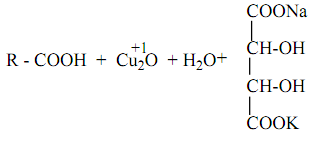 Окисление кетонов Окисление кетонов приводит к образованию смеси карбоновых кислот и кетонов. Если у кетона нет разветвлений в α-положении, образуется смесь карбоновых кислот. Если у кетона есть разветвления в α-положении, наряду с кислотами, образуются кетон При восстановлении альдегидов образуются первичные спирты, кетонов – вторичные. Реакция протекает в присутствии катализатора (Ni, Pd, Pt) Качественные реакции на альдегиды связаны с легкой окисляемостью альдегидной группы оксидами или гидроксидами металлов в щелочной среде при нагревании, при этом альдегиды превращаются в карбоновые кислоты с тем же числом атомов углерода, а ион металла восстанавливается или меняет степень окисления и, соответственно, окраску. Если окислитель — реагент Троммера (свежеприготовленный гидроксид меди II), то наблюдается появление желтого осадка СuОН, переходящего в красный Сu2О. Качественная реакция на альдегиды с фуксинсернистой кислотой протекает в кислой среде без нагревания. Реакция реализуется по механизму нуклеофильного присоединения АN и приводит к образованию основания Шиффа (малиново-фиолетового цвета) . 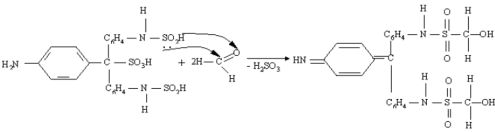 |
