блок_2[1]. 1. Методы синтеза предельных и ,непредельных альдегидов и кетонов из спиртов, галоидных алкилов, из карбоновых кислот и их производных, алкенов, алкинов (реакция Кучерова),
 Скачать 1.22 Mb. Скачать 1.22 Mb.
|
|
Получение аминов В аминах атом азота находится в низшей степени окисления, поэтому многие способы их получения основаны на процессах восстановления азотсодержащих соединений других классов (нитропроизводных углеводородов, амидов, нитрилов). Наиболее общим методом получения первичных аминов является восстановление нитросоединений: Важнейший ароматический амин - анилин - образуется при восстановлении нитробензола (восстановители - водород в присутствии металлических катализаторов, Fe + HCl, сульфиды): Эта реакция носит имя русского химика Н.Н. Зинина, осуществившего ее впервые в 1842 г.Восстановление амидов (восстановитель - алюмогидрид лития LiAH4): 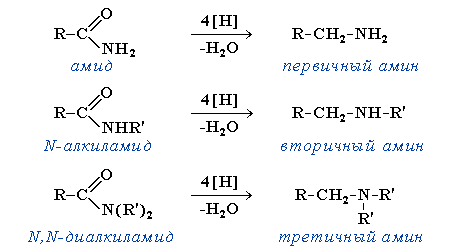 Восстановление нитрилов с образованием первичных аминов: R-CN + 4[H] R-CH2NH2 Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна найлон. Получение аминов путём введения алкильных групп в молекулы аммиака и аминов (реакции алкилирования).При нагревании галогеналканов с аммиаком образуется смесь первичных, вторичных и третичных аминов. Действием галогеналканов на первичные алифатические и ароматические амины получают вторичные и третичные амины, в том числе, смешанные. 23.Основные и нуклеофильные свойства алифатических аминов. Зависимость основности аминов от их строения (числа и природы заместителей при атоме азота).Алифатические амины Амины - производные аммиака, в которых атомы водорода замещены на углеводородные радикалы. Амины классифицируют по числу атомов водорода, замещенных на углеводородные радикалы. Различают первичные R-NH2, вторичные R2-NH и третичные R3-N амины. Известны и соединения с четвертичным атомом азота - соли аммония - R4N+X В этом случае азот несет положительный заряд.В зависимости от типа радикала различают алифатические и ароматические амины.Изомерия в ряду алифатических аминов связана с изомерией углеводородного радикала и количеством заместителей у атома азота. Способы получения алифатических аминов Аммонолиз галогеналканов. При нагревании галогеналканов со спиртовым раствором аммиака в запаянных трубках образуется смесь соединений. При взаимодействии аммиака с галогеналканами образуются первичные алкиламины. Моноалкиламины являются более сильными нуклеофилами, чем аммиак; они будут дальше реагировать с галогеналканом,Получение аминовВ аминах атом азота находится в низшей степени окисления, поэтому многие способы их получения основаны на процессах восстановления азотсодержащих соединений других классов (нитропроизводных углеводородов, амидов, нитрилов). Наиболее общим методом получения первичных аминов является восстановление нитросоединений: Важнейший ароматический амин - анилин - образуется при восстановлении нитробензола (восстановители - водород в присутствии металлических катализаторов, Fe + HCl, сульфиды): Эта реакция носит имя русского химика Н.Н. Зинина, осуществившего ее впервые в 1842 г. Восстановление амидов (восстановитель - алюмогидрид лития LiAH4): 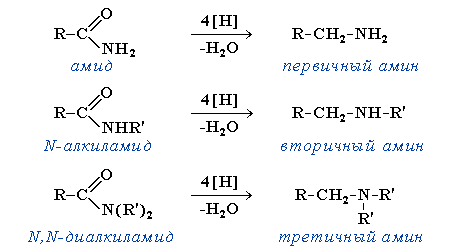 Восстановление нитрилов с образованием первичных аминов: R-CN + 4[H] R-CH2NH2 Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна найлон Получение аминов путём введения алкильных групп в молекулы аммиака и аминов (реакции алкилирования).При нагревании галогеналканов с аммиаком образуется смесь первичных, вторичных и третичных аминов. 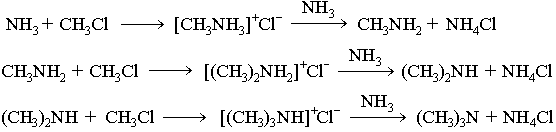 В основе этих превращений лежит реакция нуклеофильного замещения галогена в галогеналканах. Роль нуклеофила играют молекулы аммиака и аминов, имеющие неподеленную пару электронов на атоме азота. В промышленности алкилирование аммиака в большинстве случаев проводится не галогеналканами, а спиртами, в молекулах которых происходит нуклеофильное замещение ОН-группы на аминогруппу. Действием галогеналканов на первичные алифатические и ароматические амины получают вторичные и третичные амины, в том числе, смешанные. Строение. Номенклатура Амины — органические соединения, которые рассматривают как производные аммиака, в котором атомы водорода (один, два или три) замешены на углеводородные радикалы. Амины делятся на первичные, вторичные, третичные в зависимости от того, сколько атомов водорода замещено на радикал. Химические свойства 1. Благодаря наличию электронной па ры на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основа ниями, чем аммиак.ДИАМИНЫ, содержат в молекуле две аминогруппы. Наиб. значение имеют алифатич. , -диамины (С2-С12), моно- и бициклич. ароматич. и алициклич. первичные диамины, а также ряд вторичных и третичных диаминов. Особенно высокой основностью обладает нафталин. При повыш. т-рах диамины взаимод. с моно- и дикарбоновыми к-тами или их хлорангидридами, превращаясь в амидо-амины, диамиды или полиамиды. Последние образуются также при термич. дегидратациисолей диаминов с карбоновыми к-тами. Эта р-ция лежит в основе пром. способа произ-ва ряда полиамидов. 24.Реакции с участием аминогруппы: алкилирование и ацилирование аминов; получение и распад четвертичных аммони евых оснований (реакция Гофмана), Взаимодействие первичных, вто ричных и третичных аминов с азотистой кислотой. Свойства нитрозопроизводных. Образование изонитрилов и их свойства. Алифатические амины Амины - производные аммиака, в которых атомы водорода замещены на углеводородные радикалы. Амины классифицируют по числу атомов водорода, замещенных на углеводородные радикалы. Различают первичные R-NH2, вторичные R2-NH и третичные R3-N амины. Известны и соединения с четвертичным атомом азота - соли аммония - R4N+X В этом случае азот несет положительный заряд.Получение аминовВ аминах атом азота находится в низшей степени окисления, поэтому многие способы их получения основаны на процессах восстановления азотсодержащих соединений других классов (нитропроизводных углеводородов, амидов, нитрилов).Наиболее общим методом получения первичных аминов является восстановление нитросоединений: Важнейший ароматический амин - анилин - образуется при восстановлении нитробензола (восстановители - водород в присутствии металлических катализаторов, Fe + HCl, сульфиды): Эта реакция носит имя русского химика Н.Н. Зинина, осуществившего ее впервые в 1842 г.Восстановление нитрилов с образованием первичных аминов: R-CN + 4[H] R-CH2NH2 Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна найлон.
При нагревании галогеналканов с аммиаком образуется смесь первичных, вторичных и третичных аминов. 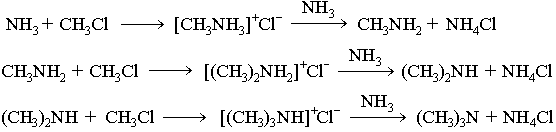 В основе этих превращений лежит реакция нуклеофильного замещения галогена в галогеналканах. Роль нуклеофила играют молекулы аммиака и аминов, имеющие неподеленную пару электронов на атоме азота.В промышленности алкилирование аммиака в большинстве случаев проводится не галогеналканами, а спиртами, в молекулах которых происходит нуклеофильное замещение ОН-группы на аминогруппу. Действием галогеналканов на первичные алифатические и ароматические амины получают вторичные и третичные амины, в том числе, смешанные. ДИАМИНЫ, содержат в молекуле две аминогруппы. Наиб. значение имеют алифатич. , -диамины (С2-С12), моно- и бициклич. ароматич. и алициклич. первичные диамины, а также ряд вторичных и третичных диаминов.В природе наиб. известны пента- и тетраметилендиамины Н2N(СН2)nNН2, содержащиеся в продуктах гнилостного распада белков. Большинство диаминов - бесцв. кристаллы; хорошо раств. в воде и спирте. Обладают всеми хим. св-вами, характерными для моноаминов. Сильные основания, образуют соли с к-тами. Диамины - двухкислотные основания.Особенно высокой основностью обладает 1,8-бис-(димстиламино)нафталин. При повыш. т-рах диамины взаимод. с моно- и дикарбоновыми к-тами или их хлорангидридами, превращаясь в амидо-амины, диамиды или полиамиды. Последние образуются также при термич. дегидратациисолей диаминов с карбоновыми к-тами. Эта р-ция лежит в основе пром. способа произ-ва ряда полиамидов. Алифатич. диамины в пром-сти получают: низшие - аммонолизом дигалогензамещенных углеводородов, напр.: СlСН2СН2Сl + 2NH3: H2NCH2CH2NH2; восстановит.аминированиемаминоспиртов либо акрилонитрила: Алифатич. диамины могут быть получены также восстановит.аминированием дикарбоновых к-т и лактамов или гидрированиемаминонитрилов. Препаративно алифатич. диамины синтезируют по р-циям Габриеля, Гофмана, Шмидта, гидроаминированием продуктов озонолиза циклоолефинов, аминированиемгликолей и др. Нек-рые высшие диамины синтезируют на основе бутадиена и гидроксиламина: Ароматич. диамины в пром-сти чаще всего получают каталитич. гидрированием соответствующих динитросоединений или нитроанилинов, реже - восстановлением (Fe с НСl или H2SO4, Na2S) этих же соединений. Препаративно ароматич. диамины синтезируют по р-ции Гофмана, аминированиемизомеровдихлорбензола или хлоранилина водным р-ром NH3 в присут. галогенидов Сu.Алициклич. диамины могут быть получены аналогично алифатич. диаминам. Шестичленные алициклич. диамины обычно синтезируют гидрированием ароматич. диаминов, динитросоединений или нитроанилинов, напр.: Они м. б. получены также перегруппировкой диамидов или диазидов циклогександикарбоновых к-т по Гофману и Курциусу соответственно.Третичные алифатич., ароматич. и алициклич. диамины синтезируют алкилированием соответствующих первичных диаминов алкилгалогенидами, спиртами, диметилсульфатом или восстановит аминированиемальдегидов диаминами.Важнейшие циклич. диамины (пиперазин и его аналоги) в пром-ти обычно получают циклоаминированием моно- и диалканоламинов, а также циклизацией N-(-гидроксиэтил)-этилендиамина, дезаминированиемдиэтилентриамина, пиролизом гидрохлоридов моноалканоламинов и др. ЭТИЛЕНДИАМИН (1,2-диаминоэтан) Н2NC2Н4NH2 бесцв. жидкость с аминным запахом, дымящая на воздухе.образует с водойазеотропную смесь ; смешивается с водой (с разогревом) и с большинством орг. р-рителей, не раств. в углеводородах. Этилендиамин обладает хим. св-вами диаминов. С к-тами образует два ряда солей, с металлами (Сu, Мn, Со и др.) - комплексные соли. Нитрат этилендиамина при нагр. отщепляет две молекулыводы с образованием взрывчатого в-ва - этилендинитрамина: Нагревание этилендиамина с одноосновными карбоновыми к-тами приводит к моно- и диамидам, способным циклизоваться в имидазолины и имидазолидины; аналогично протекают р-ции с HCN и альдегидами, напр.: 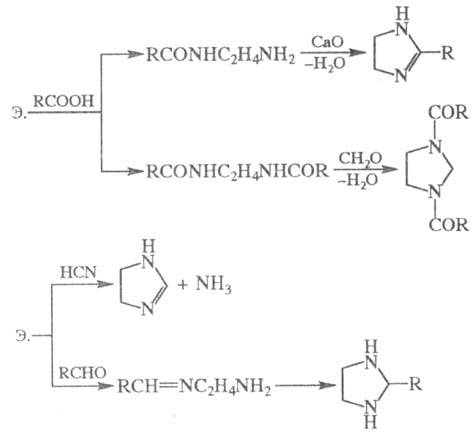 Самоконденсация этилендиамина при повышенных т-ре и давлении в присут. катализатора дает пиперазин, конденсация этилендиамина с 1,2-дикетонами - 2,3-дигидропиразины, с мочевиной -2-имидазолидинон (этиленмочевину). При взаимод. этилендиамина с С1СН2СООН или со смесью СН2О и НС1 образуется этилендиаминтетрауксусная кислота. Р-ция этилендиамина с 1 эквивалентом CS2 приводит к 2-меркаптоимидазолину, с 2 эквивалентами CS2 в присут. щелочи - к этилен-бис- (дитиокарбамату): С алкилгалогенидами этилендиамин дает моно- и дизамещенные продукты, с дигалогенидами образуются катионные полимерные продукты (водорастворимые или гелеобразные), напр.: 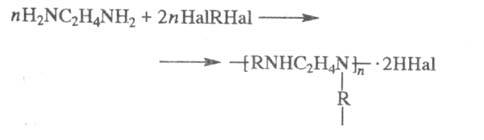 Этилендиамин цианэтилируется акрилонитрилом, оксиалкилируется эпоксидами с образованием проксаминов, напр.: ГЕКСАМЕТИЛЕНДИАМИН (1,6-гександиамин, 1,6-диаминогексан) H2N(CH2)6NH2, бесцв. кристаллы со слабым аммиачным запахом; Гексаметилендиамин обладает всеми хим. св-вами алифатич. аминов. С карбонильными соединениями образует основания Шиффа, с солями Ag, Au, Cu, Pt и др. металлов - окрашенные и труднорастворимые комплексные соед.; вступает в р-цию цианэтилирования; действием NiO2 окисляется до адиподинитрила. С карбоновыми и минер.к-тами образует соли, напр. дигидрохлорид и дигидробромид. ДИАЗОМЕТАН CH2N2 ДИАЗОМЕТАН CH2N2, газ желтого цвета снеприятным запахом. Легкоразлагается совзрывом; безопасны его разбавленные р-ры вэфире. Строение диазометана может быть описано рядом резонансныхструктур: Диазометан легко метилирует соед., содержащие активный атом Н, напр., с галогеноводородами образует метилгалогениды, с карбоновыми к-тами, сульфокислотами и фенолами - их метиловые зфиры: В присут. АlСl3 или BF3 реагирует с альдегидами с образованием метилкетонов; при взаимод. с кетонами происходит удлинение цепи или расширение цикла, напр., циклогексанон превращается в циклогептанон: Типичные реакции нуклеофильного присоединения по связи C=N и С≡N 1. Реакция Торпа. 2. Присоединение циановодорода. |
