блок_2[1]. 1. Методы синтеза предельных и ,непредельных альдегидов и кетонов из спиртов, галоидных алкилов, из карбоновых кислот и их производных, алкенов, алкинов (реакция Кучерова),
 Скачать 1.22 Mb. Скачать 1.22 Mb.
|
Механизм реакцииПрименениеПерегруппировку Бекмана используют в промышленности для получения капрона. Происходит это на стадии превращения циклогексаноноксима в ε-капролактам 33. Перегруппировка Курциуса. КУРЦИУСА РЕАКЦИЯ, получение первичных аминов термич. перегруппировкой ацилазидов в изоцианаты (перегруппировка Курциуса) с послед.их гидролизом: Протекает с укорочением углеродной цепи на один атом. Процесс осуществляют в инертных р-рителях при 20-150 °С. Азидыгалогенкарбоновых к-т, в к-рых атом галогена удален от карбоксильной группы, легко образуют галогензамещенные амины, азидыдикарбоновых к-т превращ. в диамины, напр.: N3CO(CH2)4CON3:H2N(CH2)4NH2 Азиды -аминокислот, -непредельных карбоновых к-т, -галоген- и -гидроксизамeщенных карбоновых к-т не вступают в Курциусареакцию, а образуют альдегиды или кетоны, напр.: RR'QOH)CON3:RR'C(OH)N=C=O:RR'C=O+HNCO В этом случае для осуществления Курциуса реакции гидрокси- или аминогруппу защищают путем их алкилирования или ацилирования. Механизм Курциуса реакции включает миграцию алкильного (арильного) радикала к атому N в промежуточно образующемся ацилнитрене, напр.: Если радикал хирален, он мигрирует к атому N с сохранением конфигурации. Одна из модификаций Курциуса реакции-синтез ацилазидов в р-ре СН2Сl2 с послед.действием на ацилазид небольшого избытка CF3COOH: Этот метод позволяет проводить р-цию в мягких условиях без выделения взрывоопасного ацилазида. Кроме ацилазидов в Курциуса реакцию вступают триметилсилилазид (CH3)3SiN3, трибутилстаннилазид (C4H9)3SnN3, тетрабутиламмонийазид [(C4H9)4N]+N3- и др.Курциуса реакция -удобный лаб. метод синтеза изоцианатов и первичных аминов, не содержащих примесей вторичных и третичныхаминов. Кроме того, Курциуса реакция - промежут. стадия синтезе урeтанов и N. N'-дизамещенных мочевин: 34. Перегруппировки амидов (Гофман) ГОФМАНА РЕАКЦИИ. 1) Превращение амидов карбоновых к-т в первичные амины с элиминированием СО2, происходящее под действием гипогалогенитов щелочных металлов (перегруппировка Гофмана, расщепление амидов по Гофману): К водному щелочному р-ру гипогалогенита прибавляют амид: послед. нагревание до 40-80°С завершает р-цию. Для увеличения выхода аминов из амидов высших жирных к-т р-цию проводят в спиртовом р-ре. Образующиеся при этом уретаны легко гидролизуются в амины. Первая стадия Гофмана реакции-синтез N-галогенамида, образующего под действием щелочей нестойкую соль I: Стадия, определяющая скорость Гофмана реакции,-отщепление галогена с образованием нитрена II, к-рый стабилизируется перегруппировкой в изоцианат: Последний при взаимод. с Н2О через карбаминовую к-ту превращ. в амин: Установлено, что мигрирующая группа сохраняет конфигурацию. Нестойкий анион амида III может взаимод. с соед., содержащими электроф. кратные связи, напр.: 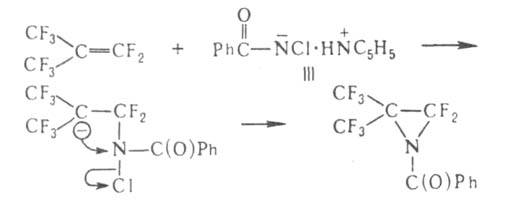 Амиды 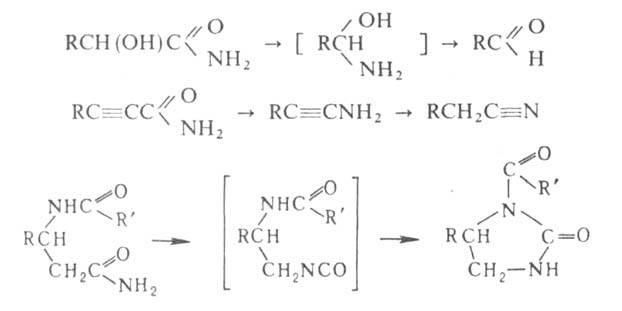 С помощью Гофмана реакции можно получить с хорошими выходами алифатич., жирно-ароматич., ароматич. и гетероциклич. амины,диамины и аминокислоты; в пром-сти Гофмана реакция используется для синтеза антраниловой к-ты. Р-ция открыта А. В. Гофманом в 1881. 2) Разложение четвертичных аммониевых оснований, имеющих в углеродной цепи атом Н в Обычно проводят путем упаривания водного или спиртового р-ра гидроксида тетраалкиламмония (часто в вакууме) с постепенным повышением т-ры до 100-150 °С. Использование смеси безводных ДМСО и ТГФ позволяет снизить т-ру р-ции до комнатной. Если атомN связан с разл. алкильными заместителями, то в осн. образуется олефин с наименьшим числом алкильных групп у двойной связи(правило Гофмана), напр.: Заместители при В случае двух сопряженных связей в Гофмана реакция, как правило, протекает по механизму бимолекулярного элиминирования и стереоспецифична, в нек-рых случаях-по внутримолекулярному циклич. механизму, напр.: 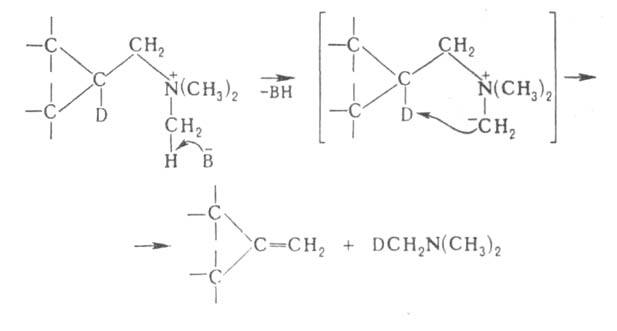 где В--основание. Основные побочные процессы при Гофмана реакции-образование спиртов, а также простых эфиров, эпоксидов, производных ТГФ ициклопропана. В р-цию, подобную Гофмана реакции, вступают соли сульфония и фосфония, напр.: 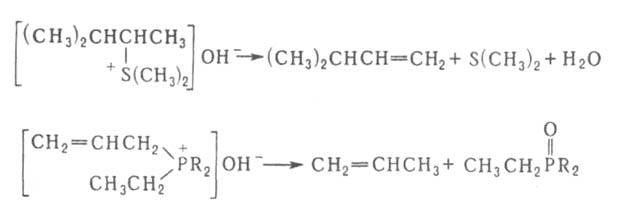 Гофмана реакцию применяют для синтеза непредельных соединений. Последовательное метилирование аминов и их расщепление (т. наз. исчерпывающее метилирование) используется для идентификации аминов. Р-ция открыта А. В. Гофманом в 1851. 35,36. Синтез и химические свойства амидов карбоновых кислот. Имиды карбоновых кислот — соединения, содержащие группу -CO-NR-CO-, диацилпроизводные аммиака (R = H) или аминов. Ациклические имиды — производные монокарбоновых кислот также называют диациламидами, большое значение в синтетической химии имеют циклические имиды дикарбоновых кислот. Реакционная способность и химические свойства Свойства и реакционная способность имидов сходны со свойствами амидов карбоновых кислот. Индуктивный эффект двух ацильных заместителей при атоме азота обуславливает большую кислотность атома водорода NH-группы, снижает нуклеофильность атомов азота и карбонильного кислорода, а также повышает электрофильность карбонильных атомов углерода ацильных групп по сравнению с амидами. Реакции NH-группы. Имиды образуют соли с щелочными металлами, стабильные в спиртовых растворах, и которые легко алкилируются по атому азота алкилгалогенидами. Алкилирование калиевой соли фталимида алкилгалогенидами с последующим гидролизом образовавшегося N-алкилфталимида является классическим методом синтеза первичных аминов по Габриелю: Имиды взаимодействуют с альдегидами и кетонами с образованием соответствующих аминокарбинолов: R'CONHCOR'' + R'''CHO R’CON(CHR'''OH)COR' и в присутствии аминов вступают с ними в реакцию Манниха в качестве «кислотных» компонент: R’CONHCOR'' + CH2O + (CH3)2NH R'CON(CH2N(CH3)2)COR' Имиды, подобно амидам, взаимодействуют с галогенами или гипогалогенитами с образованием N-галогенимидов, более стабильных, чем N-галогенамиды. Наиболее стабильны циклические N-галогенимиды, некоторые из которых (например, N-бромсукцинимид) используются в органическом синтезе в качестве источников галогена. N-галогенимиды под действием оснований претерпевают перегруппировку Гофмана с образованием изоцианатов. Так, реакция фталимида с гипохлоритом в щелочной среде ведёт к образованию антраниловой кислоты. Реакции по карбонильной группе. Органические имиды широко применяют в синтезе гетероциклических соединений, аминов, аминокислот, пептидов. 37. Реакция цианэтилирования. ЦИАНЭТИЛИРОВАНИЕ ( Цианэтилирование- частный случай Михаэля реакции. Цианэтилирование протекает через промежут. образование карбаниона; последний в избытке акрилонитрила способен к присоединению еще одной молекулы нитрила, напр.: 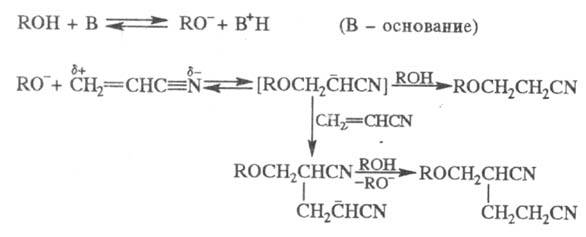 Р-ция с первичными спиртами - экзотермическая, вторичные спирты реагируют труднее первичных, третичные в обычных условиях в р-цию не вступают. Подобно одноатомным спиртам реагируют гликоли и многоатомные спирты, а также этиленциангидрин, оксимы,аминоспирты. Для последних при наличии в аминогруппе свободного атома водорода р-ция идет по атому азота. Фенолы цианэтилируются по гидроксильной группе и в ядро, напр.: Электроотрицат. группы препятствуют р-ции; так, выход продукта цианэтилирования n-хлорфенола менее 10%. Тиолы реагируют с ахрилонитрилом более энергично, чем спирты. Цианэтилирование алифатич. и ароматич. тиолов приводит к При цианэтилировании сероводорода образуется При цианэтилировании цианамида в присут. водной щелочи образуется продукт бисцианэтилирования, обладающий сильным инсектицидным действием: Циклич. амиды, особенно имиды, в присут. щелочей довольно легко цианэтилируются по иминогруппе: В присут. оснований силаны реагируют с акрилонитрилом по механизму Незамещ.фосфин цианэтилируется,подобно аммиаку, цианэтилирование первичных фосфинов и арсинов приводит к бис- Гладко идет цианэтилирование галогеноводородов с образованием HalCH2CH2CN, синильной к-ты - с образованием сукцинонитрила NCCH2CH2CN. Цианэтилирование применяют в пром-сти для получения сукцинонитрила, а также для модификации св-в нек-рых полимеров (крахмала,целлюлозы и др.). 38. Реакция Михаэля. МИХАЭЛЯ РЕАКЦИЯ, присоединение соед. с реакционно-способной метиленовой или метиновой группой (доноры электронов) к соед. с активир. двойной связью (акцепторы электронов) в присут. оснований: Основания - обычно алкоголяты, гидриды, гидроксиды и карбонаты щелочных и щел.-зем. металлов, амины. Р-ритс-ли-спирты, эфиры, 1,4-диоксан, ТГФ, бензол, ДМФА, ДМСО и др. Донорами могут служить малоновый и алкилмалоновый эфиры, b-дикетоны, нитро- и a,a-динитроалканы, бензилциа-ниды, сульфоны, акцепторами-a,b-ненасыщ. альдегиды и кетоны, эфиры, амиды и нитрилы a,b-ненасыщ. к-т, нитро-соединения и др., принадлежащие к алифатич., алициклич. и жирно-ароматич. ряду. Р-ция протекает по механизму сопряженного присоединения и начинается с атаки карбанионом (генерируется под действиемоснований) связи С=С по атому С с наим. электронной плотностью; возникающий при этом новый карбанион стабилизируется присоединением протона из среды: Если один из заместителей в генерир. карбанионе способен легко уходить в виде аниона, то стабилизация нового аниона может осуществляться с элиминированием этого заместителя (чаще всего галогена) с послед.образованием цикло-пропанового кольца, напр.: При избытке основания р-ция может происходить аномально: Имеются примеры внутримол. р-ции Михаэля с образованием циклич. продуктов: Модификация Михаэля реакции-в случае чувствительных к основаниям a,b-ненасыщ. альдегидов р-цию проводят в условияхмежфазного катализа. 39. Химические свойства акрилонитрила. Акрилонитрил (цианистый винил , НАК), CH2=CH-C≡N — Нитрил акриловой кислоты. |
