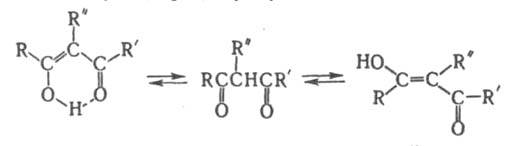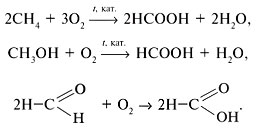|
|
блок_2[1]. 1. Методы синтеза предельных и ,непредельных альдегидов и кетонов из спиртов, галоидных алкилов, из карбоновых кислот и их производных, алкенов, алкинов (реакция Кучерова),
5. - непредельные альдегиды и кетоны. Влияние -сопряжения на химические свойства -непредельных соединений. 1,2- и 1,4- присоединение. Взаимодействие с галогенводородами, водой, цианистым водородом, бисульфитом натрия, магнийорганическими соединениями. Селективное окисление и восстановление.- непредельные альдегиды и кетоны представляют собой бесцветные жидкости с острым раздражающим запахом. Соединения с арильными группами в молекуле являются желтыми кристаллическими веществами. Соединения хар-ся полярной сопряженной системой в виду значительного индукционного эффекта (-I) карбонильной группы и большого мезомерного эффекта (-М) двойная связь сильно поляризована. 
Химические свойства: для - непредельных характерны все реакции карбонильной группы. В тоже время в молекуле имеется второй электрофильный центр - -углеродный атом, поэтому возможно образование двух продуктов реакции: 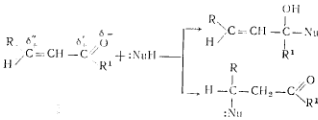 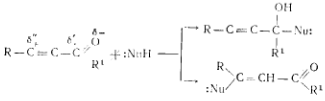
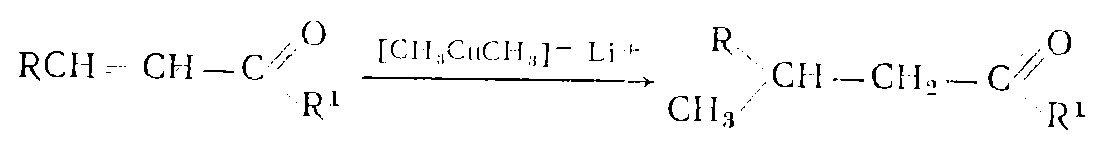 Ненасыщенные карбонильные соединения вступают также в реакции характерные для С-С связи например восстановления, поляризации. Они вступают в диеновый синтез как активные диенофилы, а иногда и в роли сопряженного диена Ненасыщенные карбонильные соединения вступают также в реакции характерные для С-С связи например восстановления, поляризации. Они вступают в диеновый синтез как активные диенофилы, а иногда и в роли сопряженного диена
6.Дикарбонилъные соединения: глиоксалъ, ацетилацетон (таутомерия, хелатные металлические производные ДИКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ, орг. соед., содержащие в молекуле две карбонильные группы С=О. К ним относятся диальдегиды, дикетоны, кетоальдегиды, альдегидо- и кетокислоты (и их производные) и т. п. Помимо св-в, характерных для карбонильных соед., дикарбонильные соединения проявляют специфич. св-ва, зависящие от взаимного расположения групп СО.
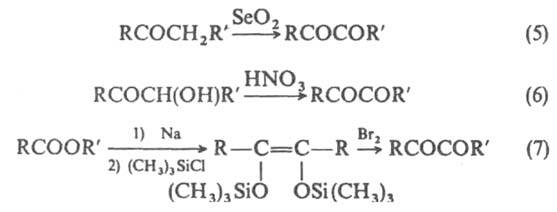
Дикарбонильные соединения (1,2-дикарбонильные соединения) RCOCOR'. Карбонильные группы обычно обнаруживают ярко выраженную электроф. реакц. способность. Для них характерна циклизация при действии бифункциональных нуклеофилов (напр., ур-ние 1) и соед. 3-валентного Р (2). Связь С—С между группами СО обычно сравнительно легко расщепляется, напр., при фотолизе (3) или действии нуклеофилов (4). Для -диальдегида (глиоксаля)и -кетоальдегидов характерна внутримол. Канниццаро реакция, для ароматич. -дикетонов (бензилов) - бензиловая перегруппировка.
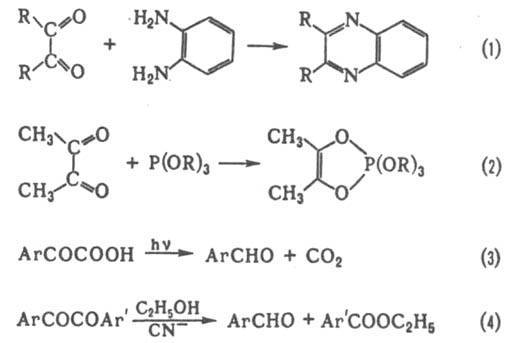
Осн. способы получения -дикарбонильных соединений - окисление монокарбонильных соед. (5) или их -замещенных производных, напр.ацилоинов (6), производных ендиолов (7), гликолей и др.; ароматич. -дикетоны получают также из ароматич. соед. и оксалилхлорида по р-цииФриделя - Крафтса.
Нек-рые дикарбонильные соединения, напр., метилглиоксаль СН3СОСНО, пировиноградная к-та СН3СОСООН, участвуют в обмене в-в в живыхорганизмах. Диацетил обусловливает запах сливочного масла; его производное - диметилглиоксим применяется как аналит. реагент. -Дикарбонильные соединения используют в орг. синтезе для получения гетероциклич. соед.
Дикарбонильные соединения (1,3-дикарбонильные соединения) RCOC(R:R':)COR'. Соед. с R: и(или) R': = Н - сравнительно сильные СН-кислоты. Для них характерна легкая енолизация с образованием цис-енолов (в хелатной форме с внутримол. водородной связью), реже -транс-енолов (см. Таутомерия):
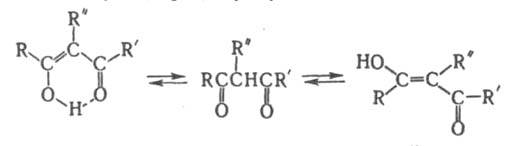
7) Получение предельных и - непредельных карбоновых кислот: окислением алканов, спиртов, оксосинтезом, гидролизом функциональных производных карбоновых кислот и тригалоидалканов. Способы получения. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В ка�честве окислителей применяются KМnО4 и K2Сr2О7.
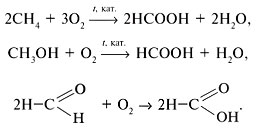
Из ацетилена по реакции Кучерова получают уксусный альдегид (ацетилен получают из доступного сырья – метана), окисление альдегидадает кислоту: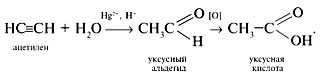
• Окисление бутана: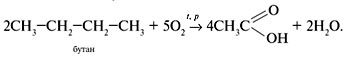
• Окисление этилового спирта: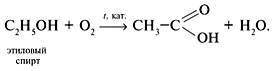
• Оксосинтез по схеме: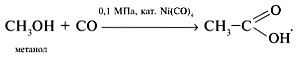
• Пиролиз ацетона с последующей гидратацией образовавшегося кетена: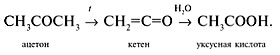
окисления муравьиной кислоты аммиачным раствором оксида серебра(I) при нагревании – реакцию «серебряного зеркала»: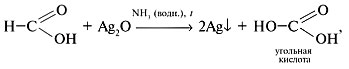
8)Строение и реакционная способность карбоксильной группы. Мезомерия и кислотные свойства карбоксила. Влияние заместителей на константу диссоциации. Свойства солей карбоновых кислот: сухая перегонка (реакция Пириа), электролиз (реакция Кольбе), реакции с алкил- и ацетилгалогенидами.
8. Строение карбоксильной группы
Карбоксильная группа сильно полярна, что обусловлено притягиванием атомом
кислорода карбонильной группы электронов атома углерода. В результате на атоме
углерода возникает частичный положительный заряд, который в свою очередь
вызывает смещение к атому кислорода электронной пары, связывающей атомы
кислорода и водорода в гидроксильной группе. Поэтому водород гидроксильной
группылегкоможетотщеплятьсяидиссоциироватьвводныхрастворах
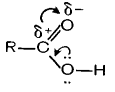 С другой стороны, смещение электронов гидроксигруппы к атому С другой стороны, смещение электронов гидроксигруппы к атому
Углерода уменьшает величину положительного заряда на этом атоме и уменьшает способность π−cвязи к разрыву. Поэтому, хотя
карбоновые кислоты, как и альдегиды, имеют двойную связь, в
реакции присоединения они вступают только в жестких условиях. На способность карбоновых кислот к диссоциации сильно влияет
характер заместителей. Самая сильная в ряду одноосновных алифатических
карбоновых кислот муравьиная кислота. Уксусная кислота слабее муравьиной, а
пропионоваяслабееуксуснойиззаналичияположительногоиндуктивногоэффектау
их углеводородных радикалов, которые смещают свою электронную плотность в сторону атома водорода гидроксильной группы. Как следствие снижается полярность связи О Н и затрудняется отщепление водорода. Наличие электроотрицательных
заместителей в радикале, наоборот, увеличивает силу карбоновых кислот. Так
монохлоруксусная (СH2Cl COOH) кислота сильнее уксусной, еще сильнее
дихлоруксусная(СHCl2 COOH),атрихлоруксусная(СCl3COOH)превосходит их по силе и приближается к сильным неорганическим кислотам.
Кислотные свойства
Кислотныесвойствакарбоновыхкислотобусловленыподвижныматомомводорода
в карбоксильной группе, который может диссоциировать или замещаться на ионы
металлов.
1. Диссоциация в водных растворах придает карбоновым кислотам кислый вкус,
приводит к изменению цвета индикаторов. Карбоновые кислоты это слабые кислоты
(степеньдиссоциациименее5%).Однако,хлорзамещенныекислотыэтосредниеили
Сильные кислоты.
2..Активные металлы вытесняют водород из карбоновыхкислот.
2Al + 6CH3COOH = Al(CH3COO)3 + 3H2
3.Взаимодействуют с oсновными оксидами и основаниями сообразованием солей СaO+2CH3COOH=Ca(CH3COOH)2 + H2O; КOH + CH3COOH= CH3COOК + H2O
4.Карбоновыекислотывытесняютболееслабые кислоты из растворов их солей. Сдругойстороныболеесильныекислотывытесняюторганическиекислотыизихсолей.3
СaCO3 + CH3COOH = Ca(CH3COO)2 + H2O + CO2
CH3COONa + HCl= CH3COOH + NaCl
Свойства солей карбоновыхкислот
1. Пиролиз солей одноосновных карбоновых кислот в присутствии щелочей
сопровождается декарбоксилированием (отщеплением карбоксильной группы) и
образованием углеводородов укороченных на один атом углерода. Двуосновные
кислотыпринагреваниилегкодекарбоксилируютсяивотсутствиищелочей.
CH3COONa+NaOH=CH4+Na2CO3
CH3CH2COOH+NaOH=CH3CH3+Na2CO3
НOOC CH2 COOH=CH3 COOH+CO2
2. Пиролизкальциевыхсолейкарбоновыхкислотвотсутствиещелочиприводитк
образованиюкетонов.
(CH3COO)2Ca = CH3 CO CH3+CaCO3
3. Электролиз неводных растворов солей карбоновых кислот ведет к
декарбоксилированиюисдваиванию радикаласобразованиемуглеводорода:
электролиз
2СH3COONa=CH3 CH3+2CO2+2Na
Реакция Пириа.
Восстановительное сульфирование ароматических нитросоединений в о- или п-аминосульфокислоты действием бисульфитов с последующим кислтным гидролизом. Также реагируют нитропроизводные конденсированных полициклических соединений. Полагают, что восстановление происходит через стадии образования нитрозо- и оксиаминопроизводных.
9) Реакции карбоновых кислот: получение функциональных производных (солей, галоидангидридов, ангидридов, сложных эфиров, ортоэфиров, амидов, нитрилов, гидразидов, азидов, гидроксамовых кислот). Галогенирование по Геллю-Фольгарту-Зелинскому. Г ЕЛЛЯ -ФОЛЬГАРДА -ЗЕЛИНСКОГО РЕАКЦИЯ (р-ция Хелля-Фольхарда-Зелинского), получение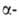 галоген-замещенных карбоновых к-т и их производных галогенированием к-т бромом (реже хлором) в присут. Р или его галогенидов: галоген-замещенных карбоновых к-т и их производных галогенированием к-т бромом (реже хлором) в присут. Р или его галогенидов:
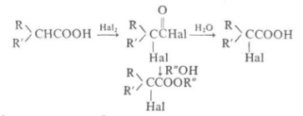 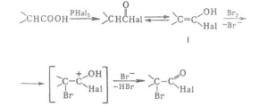
Обычно смесь карбоновой к-ты, Вr2 и красного Р или РНа13 нагревают при 80-100 °С без р-рителя. При использовании Р в стехиометрич. кол-вах образуются бромангидриды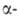 бромкарбоновых к-т, к-рые (часто без предварит. очистки) обрабатывают водой или спиртами для получения бромкарбоновых к-т, к-рые (часто без предварит. очистки) обрабатывают водой или спиртами для получения 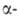 бромкарбоновых к-т или их эфиров. РВr5, образующийся в результате взаимод. Р с Вr2, превращает к-ту в бромангидрид, к-рыйгалогенируется легче, чем своб. к-та [вероятно, промежуточно образуется бромкарбоновых к-т или их эфиров. РВr5, образующийся в результате взаимод. Р с Вr2, превращает к-ту в бромангидрид, к-рыйгалогенируется легче, чем своб. к-та [вероятно, промежуточно образуется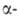 галогененол (ф-ла) галогененол (ф-ла)
10) Применение галоидангидридов и ангидридов кислот для синтеза других функциональных производных карбоновых кислот. Сравнение галоидангидридов, ангидридов, сложных эфиров, карбоновых кислот как ацилирующих агентов. Ангидриды кислот легче всего могут быть получены действием галоидангидридов на безводные соли тех же кислот;
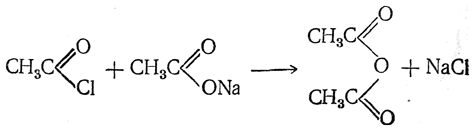
При взаимодействии солей жирных кислот со многими неорганическими хлорангидридами и ангидридами (SO2Cl2, SOCl2, COCl2, N2O4 и т. п.) также легко получаются ангидриды кислот. Например:
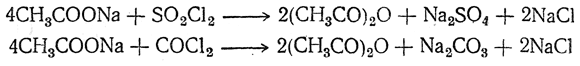
Ангидриды низших жирных кислот представляют собой жидкости, кипящие выше, чем соответствующие хлорангидриды, и обладающие острым запахом.
С безводным хлористым водородом при нагревании ангидриды могут реагировать, образуя хлорангидрид и кислоту:
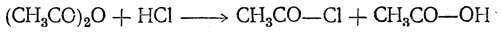
Большая часть реакций ангидридов совершенно тождественна реакциям хлор ангидридов, но при этом вместо хлористого водорода образуется органическая кислота:
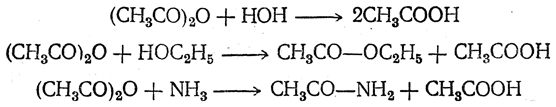
Первая реакция оправдывает присвоенное этим веществам название ангидридов. Из сказанного видно, что ангидриды кислот, как и галоидангидриды, являются ацилирующими средствами. Реакции ацилирования протекают сангидридами значительно менее энергично, чем с хлорангидридами, что дает возможность выбирать ацилирующее средство в зависимости от желательных условий реакции. Уксусный ангидрид (СН3СО)2О кипит при 140° С; относительная плотность d204 = 1,073. С водой он не смешивается и лишь немного в ней растворяется. Растворенный ангидрид на холоду медленно реагирует с водой, превращаясь в уксусную кислоту. Уксусный ангидрид находит значительное применение как средство ацетилирования в лабораторных синтезах и в технике (например, в производствеацетата целлюлозы). Он легко получается действием кетена на безводную уксусную кислоту:
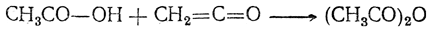 Ангидрид муравьиной кислоты неизвестен. Ангидрид муравьиной кислоты неизвестен.
11) Кетены как внутренние ангидриды. Строение, способы получения, свойства.
Кетены — соединения общей формулы R2C=C=O, в которых карбонильная группа соединена двойной связью с алкилиденовой группой[1]. Содержит кумулированную систему двойных связей «углерод-углерод» и «углерод-кислород».
Получение кетенов
(1). Дегалогенирование a-галогенацилгалогенидов. a-Галогенацил-галогениды при действии цинка в диэтиловом эфире превращаются в кетены;
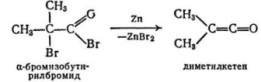
(2). Дегидрогалогенированиеацилгалогенидов. В присутствии третичных аминов ацилгалогениды подвергаются дегидрогалогенированию:
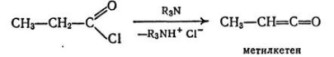
В промышленности кетен получают пиролизом уксусной кислоты в присутствии триэтилфосфата или пиролизом ацетона над глинозёмом.Лабораторный способ получения кетенов заключается в обработке хлорангидридов карбоновых кислот элиминирующим реагентом: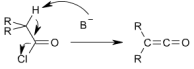
Реакции кетенов
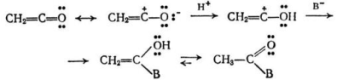
Кетенами, как и ангидридами карбоновых кислот, можно проводить ацилирование. В этом отношении они превосходят во много раз ангидриды и галогенангидриды карбоновых кислот. Эти реакции протекают по следующему механизму:
 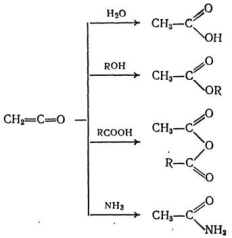
12. Реакция этерификации(Реакция Фишера- Шпайера, 1895г.)- это реакция карбоновой кислоты со спиртом, катализируемая сильными кислотами (H2SO4,n-толуолсульфокислота и др. ) Реакция этерификации обратима. механизм.Стадия1- образование гидроксониевого иона:
ие-протонирование) Катализатор берут в минимальном количестве(
1%). Для увеличения выхода эфира в ходе реакции отгоняют эфир (или воду) или используют большой избыток спирта. Реакция этерификации имеет следующий механизм.
Стадия1- образование гидроксониевого иона:
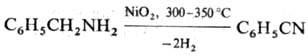
Стадия2- нуклеофильное присоединение молекулы спирта к карбонильному атому углерода:
Стадия3- изомеризация (депротонирован)
Стадия4- элеминирование молекулы воды
Стадия5- депротонирование продукта реакции
13. Нитрилы и амиды, их получение и взаимные превращения. Алкоголиз и аммонолиз нитрилов. Гидролиз и восстановление нитрилов и амидов, взаимодействие с магнийорганическими соединениями. Перегруппировки амидов (Гофман), азидов кислот (Курциус). Понятие о секстетных нуклеофильных перегруппировках.
1) Дегидратация амидов RCONH2, аммониевых солей карбоновых к-т RCOONH4 или альдоксимов RCH=NOH (при нагр. с Р2О5, РСl5, РОСl3 или SOCl2. В пром-сти р-цию обычно проводят в присут. катализаторов дегидратации (Н3РО4 и ее соли) в атмосфере NH3 , напр.:
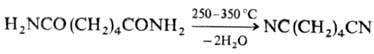
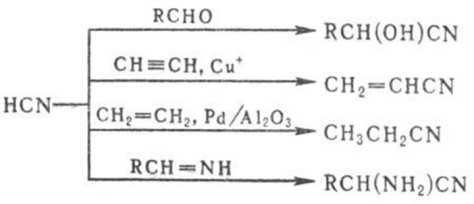
2) Присоединение HCN по кратным связям (используют для получения промышленно важных нитрилов), напр.:
3) Совместное окисление углеводородов и NH3 кислородом воздуха при 400-500 °С в присут. молибдатов и фосфо-молибдатов Bi, молибдатов и вольфраматов Те и Се и др. катализаторов:
4) Теломеризация олефинов с галогеноцианидами или р-ция последних с магнийорг. соед.:
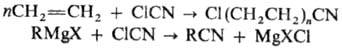
Получение из амидов кислот. Действием щелочных гипохлоритов (гипобромитов) или галоидов в щелочной среде на амиды кислот образуются первичные амины, содержащие на один атом углерода меньше, чем исходный амид (реакция Гофмана):
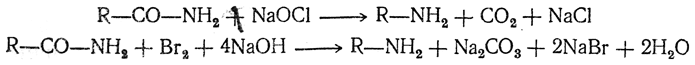
Получение из азидов кислот. При нагревании азидов кислот выделяется молекула азота и остаток молекулы азида, промежуточно образуя изоцианат (перегруппировка Курциуса), дает окончательно первичный амин:
14. ,- Непредельные кислоты: акриловая и метакриловая. Акрилонитрил. Их свойства: присоединение воды, галогеноводородов, аммиак. Реакция Михаэля и реакция цианэтилирования. Полимерные материалы на основе производных акриловой и метакриловой кислот (органическое стекло, нитрон, каучуки). Акриловая кислота(пропеновая к-та,этиленкарбоновая к-та): CH2=CH-COOH
мол. м. 72,06; бесцв. жидкость с резким запахом; т. пл. 12-13,5°С, т. кип. 140,9-141,6°С, , давление пара 4,13 гПа при 20°С;, теплота парообразования 45,6 кДж/моль; К 5,6*10-5 (25°С). Раств. в воде, спирте, СНС13, бензоле. При хранении полимеризуется, ингибитор-гидрохинон. Соли и эфиры акриловой кислоты наз. акрилатами.
Метакриловая к-та(2 метилпропеновая к-та, a-метилакриловая к-та)СН2=С(СН3)СООН мол. м. 86,09; бесцв. жидкость с резким запахом; т. пл. 16°С. т. кип. 162-163°С, раств. в воде и орг. р-рителях (в спиртах, эфирах, кетонах находится в мономерном состоянии, в углеводородах - в виде димера). При хранении полимеризуется, ингибитор - метиловый эфир гидрохинона. Соли и эфиры метакриловой кислоты наз. метакрилатами.
АКРИЛОНИТРИЛ (нитрил акриловой к-ты, 2-пропеннитрил, винилцианид) CH2=CHCN
15.Жиры и входящие в их состав .кислоты. Растительные и животные жиры. Гидрогенизация и окисление жиров, щелочной и кислотный гидролиз. Мыла. Жиры-полные эфиры высших карбоновых к-т и глицерина. Их наз.триглицеридами(триацилглицеридами).Карбоновые к-ты,входящие в состав жиров,содержат от 8 до 24 атомов углерода в цепи. Начиная с С6 , число атомов углерода в цепи бывает чётным, а цепи- неразветвлёнными насыщ.и ненасыщ., содерж. одну или более двойных связей.tпл жира зависит от степени ненасыщенности остатков жирных к-т в молекуле триглицерида. Жиры с незначительным содержанием двойных связей в алифатических фрагментах их молекул являются твёрдыми при комнатной t. Твёрдые жиры устойчивы в хранениии. Поэтому жидкие растительные масла часто подвергают отверждению. Этот процесс заключается в гидрировании фрагментов ненасыщ.карбоновых к-т в молекулах триглицеридов. Как правило, проводят лишь частичное гидрирование, сохраняя часть двойных связей в углеводородных фрагментах незатронутыми. Это позволяет избежать чрезмерного повышения tпл гидрогенизированного жира. Гидрирование растительных масел имеет ещё одно нежелательное св-во. Незатронутые при гидрировании двойные связи, имеющие цис-конфигурацию в природном растительном масле, приобретают транс-конфигурацию в гидрогенизированном продукте.
16.Двухосновные кислоты: щавелевая, малоновая, янтарная. Отношение их к нагреванию и получение производных. Сложные эфиры щавелевой и малоновой кислот, ангидрид янтарной кислоты, использование их в органическом синтезе (реакция Михаэля).Щавелевая к-та(этандиовая к-та)HOOCCOOH.Получают быстрым нагреванием формиата натрия. Бесцветные кристаллы, tпл=189,5С, tвозг=125С. Растворима в воде, этаноле, диэтиловом эфире. Применяют как восстановитель для аналитических целей и как средство для удаления ржавчины. ПДК 1мг/м3.
Малоновая к-та(1,3-пропандиовая к-та)CH2(COOH)2.Получают гидролизом циануксусной к-ты. Бесцветные кристаллы, tпл=135,6С;растворима в воде, этаноле и диэтиловом эфире. Применяют для получения карбоновых к-т, аминокарбоновых к-т ,α,β-ненасыщенных к-т, лекарственных веществ(барбитураты), витаминов В1 и В6.
Янтарная к-та(1,4-бутандиовая к-та) HOOC(CH2)2COOH.Получают гидрированием малеинового ангидрида с последующей гидратацией. Бесцветные кристаллы, tпл=185С. Применяют в органическом синтезе, в производстве полимерных материалов, инсектицидов и красителей.
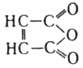
17.Двухосновные непредельные кислоты: фумаровая, малеиновая, их стереохимия, получение производных, реакции по двойной связи. Малеиновый ангидрид в диеновом синтезе Малеиновая и фумаровая к-ты, цис- и транс-этилен-1,2-дикарбоновые к-ты, ф-лы I и II соотв., мол. м. 116,07; бесцв. кристаллы. На свету, при нагр. выше 200 °С или при действии хим. агентов малеиновая к-та изомеризуется в фумаровую к-ту; DH изомеризации 22,84 кДж/моль.
МАЛЕИНОВЫЙ АНГИДРИД (ангидрид циc-этилен-1,2-дикарбоновой к-ты; 2,5-фурандион), мол. м. 98,06; бесцв. кристаллы с ромбич. решеткой (а = 0,7180 нм, b = 1,1231 нм, с = 0,539 нм, пространств. группа P212121); т. пл. 52,85 °С, т. кип. 202 °С; d20201,48, d7070 1,3; nD25 1,4429 (-модификация), 1,4781 (), 1,6384 (); 1,61 мПа.с (60 °С), 1,07 мПа.с (90 °С), 0,6 мПа.с (150°С); давлениепара 0,13 кПа (44 °С), 1,3 кПа (78 °С), 8,0 кПа (122 °С), 100 кПа (202 °С); Ср (для твердого) 1,21 кДж/(моль.°С),
|
|
|
 Скачать 1.22 Mb.
Скачать 1.22 Mb.