блок_2[1]. 1. Методы синтеза предельных и ,непредельных альдегидов и кетонов из спиртов, галоидных алкилов, из карбоновых кислот и их производных, алкенов, алкинов (реакция Кучерова),
 Скачать 1.22 Mb. Скачать 1.22 Mb.
|
|
3. Реакция Уги. 25.Диамины. Метода синтеза этилендиамина и гексаметилендиамина. Синтетические полиамидные волокна.ДИАМИНЫ, содержат в молекуле две аминогруппы. Наиб. значение имеют алифатич. , -диамины (С2-С12), моно- и бициклич. ароматич. и алициклич. первичные диамины, а также ряд вторичных и третичных диаминов.В природе наиб. известны пента- и тетраметилендиамины Н2N(СН2)nNН2, где п = 5 и 4, содержащиеся в продуктах гнилостного распада белков - соотв. кадаверин и путресцин; легко раств. в воде и этаноле, плохо - в диэтиловом эфире). Образуются при ферментативном декарбоксилировании соотв. лизина и орнитина. Кадаверин найден в спорынье, мухоморе, сыре, пивных дрожжах. Путресцин - исходное соед. для синтеза физиологически активных полиаминов.Большинство диаминов - бесцв. кристаллы; хорошо раств. в воде и спирте. Обладают всеми хим. св-вами, характерными для моноаминов .Сильные основания, образуют соли с к-тами. Диамины - двухкислотные основания. Особенно высокой основностью обладает 1,8-бис-(димстиламино)нафталин (т. наз. протонная губка). При повыш. т-рах диамины взаимод. с моно- и дикарбоновыми к-тами или их хлорангидридами, превращаясь в амидо-амины, диамиды или полиамиды. Последние образуются также при термич. дегидратациисолей диаминов с карбоновыми к-тами. Эта р-ция лежит в основе пром. способа произ-ва ряда полиамидов. С фосгеном образуют диизоцианаты или полимочевины. 1,1-Диамины H2NCRR'NH2 (гeм-диамины, аминали, N, N-ацетали) нестабильны, легко гидролизуются с образованием NH3 и карбонильного соединения. N, N, N', N'-Тетразамещенные 1,1-диаминов более стабильны; их используют в орг. синтезе. Диамины с группами NH2 у соседних атомовуглерода с карбоновыми к-тами, CS2, дикетонами или диальдегидами, ,-непредельными к-тами, мочевиной и 1,2-гликолями образуют гетероциклы, напр., имидазолины (ф-ла I), 2-меркаптобензимидазолы (II), хиноксалины, производные диазепинов, этиленмочевины (2-имидазолидиноны) и разл. производные пиперазина. 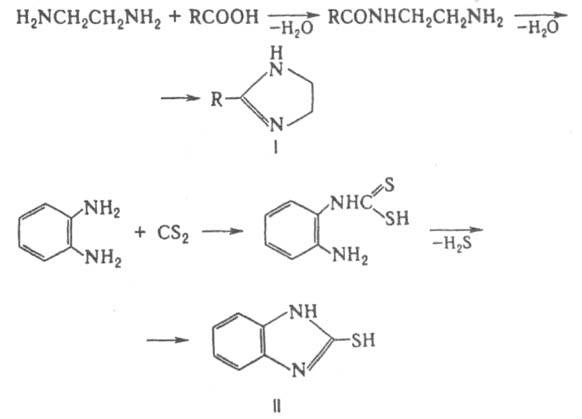 Алифатич. диамины в пром-сти получают: низшие - аммонолизом дигалогензамещенных углеводородов, напр.: СlСН2СН2Сl + 2NH3: H2NCH2CH2NH2; восстановит.аминированиемаминоспиртов либо акрилонитрила: Алифатич. диамины могут быть получены также восстановит.аминированием дикарбоновых к-т и лактамов или гидрированиемаминонитрилов. Препаративно алифатич. диамины синтезируют по р-циям Габриеля, Гофмана, Шмидта, гидроаминированием продуктов озонолиза циклоолефинов, аминированиемгликолей и др. Нек-рые высшие диамины синтезируют на основе бутадиена и гидроксиламина: Ароматич. диамины в пром-сти чаще всего получают каталитич. гидрированием соответствующих динитросоединений или нитроанилинов, реже - восстановлением (Fe с НСl или H2SO4, Na2S) этих же соединений. Препаративно ароматич. диамины синтезируют по р-ции Гофмана, аминированиемизомеровдихлорбензола или хлоранилина водным р-ром NH3 в присут. галогенидов Сu.Алициклич. диамины могут быть получены аналогично алифатич. диаминам. Шестичленные алициклич. диамины обычно синтезируют гидрированием ароматич. диаминов, динитросоединений или нитроанилинов, напр.: Они м. б. получены также перегруппировкой диамидов или диазидов циклогександикарбоновых к-т по Гофману и Курциусу соответственно.Третичные алифатич., ароматич. и алициклич. диамины синтезируют алкилированием соответствующих первичных диаминов алкилгалогенидами, спиртами, диметилсульфатом или восстановит аминированиемальдегидов диаминами.Важнейшие циклич. диамины (пиперазин и его аналоги) в пром-ти обычно получают циклоаминированием моно- и диалканоламинов, а также циклизацией N-(-гидроксиэтил)-этилендиамина, дезаминированиемдиэтилентриамина, пиролизом гидрохлоридов моноалканоламинов и др.Применяют диамины в произ-ве полиамидов, полиимидов, полимочевин, полиуретанов, ПАВ, ВВ, текстильно-вспомогат. в-в, красителей, ингибиторов коррозии и термич. полимеризациидиеновых углеводородов, ионообменных смол, присадок, антиоксидантов и др. См., напр., Бензидин, Гексаметилендиамин, Диаминоантрахиноны, Диаминодиоксиантрахиноны, 4,4'-Диаминодифенилметан, 4,4'-Диаминодифениловый эфир, "Диамины", Додекаметилендиамин, Ксилилендиамины, Пиперазин, Толуилендиамины, Фенилендиамины, Этилендиамин.ЭТИЛЕНДИАМИН (1,2-диаминоэтан) Н2NC2Н4NH2; бесцв. жидкость с аминным запахом, дымящая на воздухе; образует с водойазеотропную смесь; смешивается с водой (с разогревом) и с большинством орг. р-рителей, не раств. в углеводородах. Этилендиамин обладает хим. св-вами диаминов. С к-тами образует два ряда солей, с металлами (Сu, Мn, Со и др.) - комплексные соли. Нитрат этилендиамина при нагр. отщепляет две молекулыводы с образованием взрывчатого в-ва - этилендинитрамина: Нагревание этилендиамина с одноосновными карбоновыми к-тами приводит к моно- и диамидам, способным циклизоваться в имидазолины и имидазолидины; аналогично протекают р-ции с HCN и альдегидами, напр.:  Самоконденсация этилендиамина при повышенных т-ре и давлении в присут. катализатора дает пиперазин, конденсация этилендиамина с 1,2-дикетонами - 2,3-дигидропиразины, с мочевиной -2-имидазолидинон (этиленмочевину). При взаимод. этилендиамина с С1СН2СООН или со смесью СН2О и НС1 образуется этилендиаминтетрауксусная кислота. Р-ция этилендиамина с 1 эквивалентом CS2 приводит к 2-меркаптоимидазолину, с 2 эквивалентами CS2 в присут. щелочи - к этилен-бис- (дитиокарбамату): С алкилгалогенидами этилендиамин дает моно- и дизамещенные продукты, с дигалогенидами образуются катионные полимерные продукты (водорастворимые или гелеобразные), напр.:  Этилендиамин цианэтилируется акрилонитрилом, оксиалкилируется эпоксидами с образованием проксаминов, напр.: Получают этилендиамин взаимод. дихлорэтана с NH3 (жидким или водным) при 100 °С либо каталитич. гидрированием смеси моноэтаноламина с NH3 при 150-230 °С. Этилендиамин образуется также непосредственно из этилена и NH3 либо из СН2О, NH3 и HCN в присут. катализатора. Этилендиамин - компонент пластификаторовфеноло-формальдегидных смол, полиуретановых волокон, используется для стабилизации смазочных масел и каучуковых латексов, в произ-ве полиуретанов и термопластичных адгезивов, для получения этилендиаминтетрауксусной к-ты, фунгицидов (напр., цинеба, полимарцина), присадок к моторным маслам, лек.ср-в и др. ГЕКСАМЕТИЛЕНДИАМИН (1,6-гександиамин, 1,6-диаминогексан) H2N(CH2)6NH2, мол. м. 116,21; бесцв. кристаллы со слабым аммиачным запахом. Легко раств. в воде, спиртах, углеводородах и жидком аммиаке. Гексаметилендиамин и его р-ры поглощают из воздуха СО2 .Гексаметилендиамин обладает всеми хим. св-вами алифатич. аминов. С карбонильными соединениями образует основания Шиффа, с солями Ag, Au, Cu, Pt и др. металлов - окрашенные и труднорастворимые комплексные соед.; вступает в р-цию цианэтилирования; действием NiO2 окисляется до адиподинитрила. С карбоновыми и минер.к-тами образует соли, напр. дигидрохлорид и дигидробромид. В пром-сти гексаметилендиамин получают гидрированиемадиподинитрила на никелевых или кобальтовых катализаторах при 80-200 °С. Процесс проводят по непрерывной схеме, обычно в среде метанола в присут. аммиака, взятого в большом избытке для предотвращения образования побочных продуктов-гл. обр. гексаметиленимина и бис-(6-аминогексил)амина [H2N(CH2)6]2NH. Реакция экзотермична (313,8 кДж/моль). Гексаметилендиамин получают также восстановлением дицианобутенов .Гексаметилендиамин-сырье в произ-ве гексаметилендиизоцианата, ингибитор коррозии А1 и его сплавов, катализатор полимеризациилактамов. А Г- и СГ-соли используют для получения соотв. полигексаметиленадипинамида и полигексаметиленсебацинамида. Гексаметилендиамин впервые получен В. А. Солониной взаимод. диамида пробковой (субериновой) к-ты с Вг2 и NaOH (р-ция Гофмана). ПОЛИАМИДНЫЕ ВОЛОКНАсинтетич. волокна, формуемые из полиамидов. Ок. 98% от общего произ-ва П. в. составляют волокна из алифатич. полиамидов, причем осн. масса из них производится из поли-e-капроамида (выпускается под торговыми названиями капрон, найлон-6, амилан, дедерон, стилон, лилион, релон, перлон, видлон, хемлон, энкалон и др.) и полигексаметиленадипинамида (найлон-6,6, анид, леона, глацем и др.). Произ-во др. видов алифатических П. в. очень незначительно, что объясняется в осн. экономич. проблемами, связанными с получением мономеров, техн. трудностями синтеза полимеров, переработки их в волокна и отсутствием у большинства этих волокон конкурентоспособных потребительских св-в. Получение. Технол. процесс получения П. в. включает след.осн. стадии: синтез полимера, формование и вытяжка, текстильная обработка волокна. Разделение это несколько условно, т. к. совр. технология, как правило, предполагает совмещение отдельных стадий вплоть до полностью непрерывного процесса. Полимер синтезируют обычно на том же предприятии, на к-ром производят волокно. В получаемом поли-e-капро-амиде содержится до 10% низкомол. соед. (в осн. мономер и его низшие олигомеры). Присутствие их в полимере затрудняет послед. формование волокна и отрицательно сказывается наего св-вах. Поэтому для удаления низкомол. соед. полимер подвергают т. наз. демономеризации-ва-куумированию расплава или водной обработке полимерного гранулята, к-рый затем сушат в токе нагретого азота, предварительно очищенного от кислорода (содержание O2 не должно превышать 0,0003%). Для получения волокнообразующих полиамидов применяют высокоавтоматизированные непрерывные технол. процессы. 26.Диазометан, его строение, способы получения. Применение в качестве метилирующего агента, реакции с альдегидами и кетонами, хлорангидридами. Понятие о карбенах. ДИАЗОМЕТАН CH2N2, газ желтого цвета снеприятным запахом. Легкоразлагается совзрывом; безопасны его разбавленные р-ры вэфире. Строение диазометана может быть описано рядом резонансныхструктур: Диазометан легко метилирует соед., содержащие активный атом Н, напр., с галогеноводородами образует метилгалогениды, с карбоновыми к-тами, сульфокислотами и фенолами - их метиловые зфиры: В присут. АlСl3 или BF3 реагирует с альдегидами с образованием метилкетонов; при взаимод. с кетонами происходит удлинение цепи или расширение цикла, напр., циклогексанон превращается в циклогептанон: При фотолизе, пиролизе или в присут. порошка Сu разлагается, генерируя карбен: CH2N2:: CH2 + N2. Диазометан получают обработкой этанольным р-ром КОН эфирного р-ра N-нитрозометилуретана CH3N(NO)COOC2H5 + + 2КОН: CH2N2 + С2Н5ОН + К2СО3 + Н2О, N-нитрозометилмочевины CH3N(NO)CONH2 + КОН: CH2N2 + KCNO + 2Н2О, N-нитрозо-N-метил-n-толуолсульфамида CH3C6H4SO2N(NO)CH3 + КОН: CH2N2 +CH3C6H4SO3K + H2O.Диазометан - метилирующий агент в лаб. практике; используется для получения карбоновых к-т и др. орг. соединений.Диазометан сильно раздражает слизистые оболочки глаз и дыхат. путей, действует на центр.нервную систему.Впервые диазометан получен X. Пехманом при действии щелочи на N-нитрозометилуретан.КАРБEНЫ (от лат. carbo - уголь). 1. Нестабильные соед. двухвалентного углерода общей ф-лы :CRR', где R, R' Н, Hal, орг. остаток и др. Характеризуются наличием у центр (карбенового) атома С двух несвязывающих мол. орбиталей (МО) с двумя своб электронами. Известны синглетные карбены, в к-рых одна из этих МО занята двумя электронами, а вторая свободна, и триплетные карбены с двумя одноэлектронными МО Называют карбены по соответствующему валентно-насыщенному соед. с заменой окончаний "ан", "ен", "ин" и т.д. на соотв. "илиден", "енилиден", "инилиден", напр., этилиден, циклопентадиенилиден, флуоренилиден Используют также заместительную номенклатуру, напр. дихлоркарбен, дифенилкарбен Для частицы :СН2 сохранено назв метилен. Известны аналоги К соед. двухвалентных элементов IVб гр. (силилены, гермилены, станнилены и плюмбилены), соед. одновалентных азота (нитрены), фосфора, бора и т. п., а также атомарные О, S, Se, Be.Общий метод генерирования карбенов - сольволиз (в присут. оснований) или термолиз галоформов и их аналогов, напр.: Сольволитич. методы обычно более эффективны в условиях межфазного катализа. Др. общий метод - термич. или фотолитич. разложение диазосоединений, причем использование катализаторов (соли Сu, Rh, Pd) позволяет проводить эти р-ции в мягких условиях и с высокой селективностью послед.превращений.Карбены могут быть также получены разложением металлоорг. соед., напр.: Для них характерны разл. перегруппировки, напр. Вольфа перегруппировка, а также образование димеров и полимеров. Реакц. способность мн. карбенов и их аналогов удается регулировать путем их комплексообразования с орг. лигандами и соед. переходных металлов. Карбеновые комплексы переходных металлов (W, Mo, Re и др.) играют существ.роль в метатезисеолефинов и полимеризациициклоолефинов.Р-ции фторсодержащих карбенов лежат в основе получения мн. фтормономеров (тетрафторэтилен, гексафторпропилен), а также фторароматич. соед. важных полупродуктов в получении лек.препаратов, пестицидов, красителей. 27.Методы синтеза альдегиде- и кетонокислот. Сложно-эфир ная конденсация, механизм образования ацетоуксусного эфира. АЛЬДЕГИДО- И КЕТОКИСЛОТЫ (оксокарбоновые к-ты, оксокислоты), соединения, содержащие карбоксильную и карбонильную (альдегидную или кетонную) группы. В соответствии с взаимным расположением этих групп в молекуле различают (пеницилловая) в кристаллич. состоянии и в водном р-ре находится в форме гидроксилактона. Обладает св-вами антибиотиков. Простейший представитель АЦЕТОУКСУСНЫЙ ЭФИР (этиловый эфирацетоуксусной к-ты, этилацетоацетат). Существует в двух таутомерных формах - кетонной (а)и енольной (б): Под действием разб. р-ров к-т или щелочей ацетоуксусный эфир подвергается расщеплению с образованием ацетона (т. н. кетонное расщепление), под действием конц. р-ров щелочей - с образованием уксусной к-ты (кислотное расщепление): 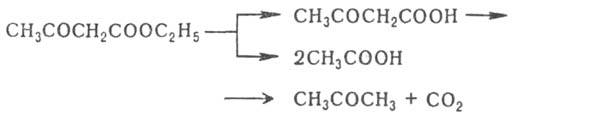 Как кетон ацетоуксусный эфир восстанавливается Н2 in situ до этил 28.Свойства ацетоуксусной кислоты и ее эфира (взаимодей ствие с альдегидами, нитрозировакие, конденсация по.Михаэлю. Таутомерия ацетоуксусного эфира, выделение таутомерных форм, оп ределение констант кето-енольного равновесия. Реакции кетонной и енольной формИз многочисленных реакцийацетоуксусного эфира укажем следующие, наиболее характерные:1. Восстановлениеводородом. При восстановленииацетоуксусного эфираводородом получается β-оксикислота: 2. Действие синильной кислоты. При взаимодействии с синильной кислотой получается циангидрин строения СН3—С(ОН)(CN)—СН2—СООС2Н5.4. Действие г и д р о к с и л а м и н а.Оксим, который должен был бы образоваться в результате реакции с гидроксиламином, превращается с отщеплением молекулыспирта в метилизоксазолон: 5. Действие фенилгидразин а. При действии фенилгидразина, как и при реакции с гидроксиламином, получается гетероциклическое соединение — фенилметилпиразолон: 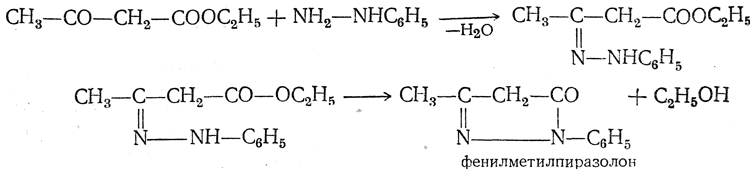 Все приведенные реакции хорошо объясняются кетонным строением ацетоуксусного эфира. Далее рассматриваются реакции, приводящие к веществам с этиленовой связью, родственным оксикротоновому эфиру.9. Реакция с хлорным железом. Обыкновенный ацетоуксусный эфир дает с хлорным железом интенсивное фиолетовое окрашивание. Эта реакция чрезвычайно характерна для енольных соединений и совершенно отсутствует у кетонов.10. Образование С-п роизводных. Чрезвычайно важной реакцией является способность ацетоуксусного эфира при действии натрия, а также при осторожном действии водными или спиртовыми щелочами (алкоголятами) замещать атомводорода на натрий и образовывать соединение, известное под названием натрийацетоуксусного эфира. Это соединение представляет собой натриевое производное енольной формы ацетоуксусного эфира: То, что натрийацетоуксусный эфир имеет такое строение, ане представляет собой смесь таутомеров явствует из результатов исследований натриевых, литиевых и магниевых енолятов дифенилпропиомезитилена — соединения, вполне аналогичного ацетоуксусному эфиру. Этот енолят имеет следующее строение (пунктиром выделена часть молекулы, имеющаяся и в натрийацетоуксусном эфире): Отсутствие таутомерии здесь доказывается существованием цис-и транс-форм енолятов, выделенных в индивидуальном виде и не способных к взаимному превращению в растворах. Стереоизомерные еноляты способны к образованию и С-производных и О-производных, причем при образовании О-производных не изменяется пространственная конфигурация молекулы. Следовательно, рассматриваемое соединение может иметь строение только енола и его двойственная реакционная способность не вызвана таутомерией. Способность енолятов дифенилпропиомезитилена образовывать не только О-производные, но иС-производные может быть объяснена как результат эффекта сопряжения ипереноса реакционного центра от атомакислорода (связанного с металлом) к углероду метинной группы: Однозамещенные гомологи ацетоуксусного эфира могут заменять еще один атомводорода на натрий, и с ними могут быть произведены дальнейшие синтезы: Двухзамещенные гомологи ацетоуксусного эфира не способны реагировать с натрием, и вместе с тем они не дают никаких реакций, отвечающих енольному строению. Реакция Михаэля: 29.Синтезы с помощью натрийацетоуксусного афира. Кетонное и кислотное расщепление его алкильных и ацильных производных. При действии на ацетоуксусный эфир металлич. Na или алкоголятов Na в спиртовом р-ре получается натрийацетоуксусный эфир CH3C(ONa)—СНСООС2Н5, широко используемый в р-циях с алкилгалогенидами, приводящих к образованию алкил- и диалкилацетоуксусных эфиров-соответственно CH3COCH(R)COOC2H5 и CH3COC(RR')COOC2H5. Кетонное и кислотное расщепление последних происходит так же, как и ацетоуксусного эфира. Напр., при кетонном расщеплении метилацетоуксусного эфира получается метилэтилкетон, при кислотном - уксусная и пропионовая к-ты. В зависимости от характера реагента, природы р-рителя и условий из натрийацетоуксусного эфира могут получаться как С-, так и О-производные ацетоуксусного эфира. Образование С-п роизводных. Чрезвычайно важной реакцией является способность ацетоуксусного эфира при действии натрия, а также при осторожном действии водными или спиртовыми щелочами (алкоголятами) замещать атомводорода на натрий и образовывать соединение, известное под названием натрийацетоуксусного эфира. Это соединение представляет собой натриевое производное енольной формы ацетоуксусного эфира: То, что натрийацетоуксусный эфир имеет такое строение, ане представляет собой смесь таутомеров явствует из результатов исследований натриевых, литиевых и магниевых енолятов дифенилпропиомезитилена — соединения, вполне аналогичного ацетоуксусному эфиру. Этот енолят имеет следующее строение (пунктиром выделена часть молекулы, имеющаяся и в натрийацетоуксусном эфире): Отсутствие таутомерии здесь доказывается существованием цис-и транс-форм енолятов, выделенных в индивидуальном виде и не способных к взаимному превращению в растворах. Стереоизомерные еноляты способны к образованию и С-производных и О-производных, причем при образовании О-производных не изменяется пространственная конфигурация молекулы. Следовательно, рассматриваемое соединение может иметь строение только енола и его двойственная реакционная способность не вызвана таутомерией. Способность енолятов дифенилпропиомезитилена образовывать не только О-производные, но иС-производные может быть объяснена как результат эффекта сопряжения ипереноса реакционного центра от атомакислорода (связанного с металлом) к углероду метинной группы: Аналогично может быть объяснена двойственная реакционная способность натрийацетоуксусного эфира: При действии на натрийацетоуксусный эфир всевозможных галоидных соединений радикал, вступающий вместо натрия в молекулуацетоуксусного эфира, в получаемых соединениях оказывается связанным с атомомуглерода. Так, например, из галоидных алкилов и натрийацетоуксусного эфира получаются гомологи ацетоуксусного эфира: Однозамещенные гомологи ацетоуксусного эфира могут заменять еще один атомводорода на натрий, и с ними могут быть произведены дальнейшие синтезы: Двухзамещенные гомологи ацетоуксусного эфира не способны реагировать с натрием, и вместе с тем они не дают никаких реакций, отвечающих енольному строению.11. Образование О-п р о и з в о д н ы х. В более редких случаях натрийацетоуксусный эфир может реагировать, образуя производные оксикротонового эфира, т. е. радикал, входящий вместо натрия, связывается с кислородом (образуются так называемые О-производные). Преимущественно в этом направлении реагирует с натрийацетоуксусным эфиром хлоругольный эфир: Однако наряду с О-соединением получается также и С-соединение: 13. Действие иода. Действие иода на натрийацетоуксусный эфир приводит к образованию диацетилянтарного эфира который может далее подвергаться кетонному или кислотному расщеплению. При кетонном расщеплении получается ацетонилацетон при кислотном —смесь уксусной иянтарной кислот 30.Альфа-окиси, методы их синтеза и свойства: реакции с электрофильными и нуклеофильными реагентами. Окись этилена как сырье для промышленного синтеза. ОКСИКИСЛОТЫ (гидроксикарбоновые к-ты, гидроксикис-лоты), содержат в молекулекарбоксильную и гидроксиль-ную группы. В зависимости от взаимного расположения групп ОН и СООН различают С солями нек-рых металлов, напр. Fe(III), Cu(II), 31.Понятие о секстетных нуклеофильных перегруппировках.СЕКСТЕТНЫЕ ПЕРЕГРУППИРОВКИ (от лат. sextus-шестой), изомеризации, протекающие с 1,2-миграцией атома Н, групп алкил, арил, ацил и др. к положительно заряженному или нейтральному атому С, N или О с шестью электронами, т.е. секстетом, на внеш. электронной оболочке. Секстетные перегруппировки могут происходить с участием соответствующих активных интермедиатов, содержащих 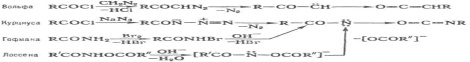 Кислотнокатализируемые перегруппировки Бекмана и Шмидта представляют собой разные способы превращения карбонильных соед. в амиды: Подобно р-ции Шмидта протекает перегруппировка Байера-Виллигера, в к-рой участвуют ионы—О+.Стереохим. исследованиями показано, что при секстетных перегруппировках конфигурация мигрирующего заместителя сохраняется, тогда как в начальном и конечном пунктах миграции преобладает инверсия.Пинаколиновая и ретропинаколиновая перегруппировки — общее название реакций взаимных превращений 1,2-диолов и соответствующим им карбонильных соединений, которые сопровождаются 1,2-миграцией заместителей. Пинаколиновая перегруппировка открыта российским химиком Бутлеровым А. М. в 1873 г. В 1907 г. Тиффено М. предложил термин ретропинаколиновая перегруппировка. Обе реакции относятся к реакции перегруппировки Вагнера — Меервейна. ПЕРЕГРУППИРОВКИ МОЛЕКУЛЯРНЫЕ, хим. р-ции, в результате к-рых происходит изменение взаимного расположения атомов в молекуле, места кратных связей и их кратности; могут осуществляться с сохранением атомного состава молекулы (изомеризация) или с его изменением.Все перегруппировки молекулярные делятся на два осн. типа: 1) межмолекулярные, когда мигрирующая группа атомов или атом (сокращенно -группа) полностью отделяется от молекулы и может присоединяться к к.-л. атому др. такой же молекулы; 2) внутримолекулярные, когда мигрирующая группа переходит от одного атома к другому в одной и той же молекуле. Перегруппировки молекулярные, в результате к-рых образуются молекулы, идентичные исходным, наз. вырожденными. 32. Перегруппировка Бекмана. Перегруппировка Бекмана — это химическая реакция превращения оксимов в амиды под действием кислотных дегидратирующих агентов, таких как H2SO4,олеум и др. Открыта в 1886 году немецким химиком Э. О. Бекманом |
