презентация. СРО 25. Строение сердца плода. Изменения сердца у новорожденного. Кровообращение плода. Кровообращение новорожденного
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
|
РЕФЕРАТ На тему: «Строение сердца плода. Изменения сердца у новорожденного. Кровообращение плода. Кровообращение новорожденного» Выполнила: Степанова Ульяна Группа: 101ак Строение сердца плода: Сердце плода и новорожденного ребенка, в отличие от детей старших возрастных групп и взрослых, имеет свои морфологические и функциональные особенности. У внутриутробного плода оба желудочка нагнетают кровь в магистральные сосуды в значительной степени параллельно и одновременно, на правый желудочек приходится около 2/3 от общего сердечного выброса. У внутриутробного плода в сокращении участвует только 30% всех миоцитов, тогда как у взрослых в систоле принимает участие до 60% объема миокардиальной ткани. Повышение функциональных возможностей сердечной мышцы тесно связано со скоростью созревания ферментных систем. Рост активности митохондриального фермента цитохром-С-оксидазы в сердце плода наблюдается с увеличением его гестационного возраста и в период новорожденности. Особенно быстрый подъем активности этого фермента происходит между 4-м и 19-м месяцами жизни. Фетальный миокард содержит относительно меньшее число сократительных миофибрилл, чем эластических элементов, а миокардиальные структуры расположены хаотично. В ответ на стрессовое воздействие сердце плода реагирует одновременным увеличением сердечного выброса и ЧСС, но возрастание ударного объема желудочков несколько запаздывает.  Сердце плода в качестве основного источника энергии использует глюкозу. Энергетическая метаболизация миокардом жирных кислот, свойственная детям и взрослым, практически отсутствует. Поэтому гипогликемия является значительным фактором снижения функционального состояния сердечной мышцы. Для сердца новорожденного ребенка характерно определенное ограничение резервных функциональных возможностей, которое обусловлено несколькими причинами. • В миокарде присутствуют относительно взрослых меньшее количество миофибрилл, которые располагаются нерегулярно. По мере роста ребенка происходит структурное развитие сократительного миокарда за счет повышения числа, плотности и упорядочения архитектоники саркомеров и митохондрий в них. • Кроме того, имеются молекулярные особенности строения миозина и актина. В миокарде новорожденных и детей первых месяцев жизни преобладают бета-изомеры миозина, которые имеют относительно низкую АТФ-азную активность. По мере роста организма ребенка они заменяются на альфа-изомеры с высокой АТФ-азной активностью. С возрастом повышение функциональных возможностей миокарда обеспечивается изменением соотношения между изомерами актина и его альфа-формы. Этот процесс сначала происходит в мышцах коронарных сосудов, затем — в миокарде желудочков и в последнюю очередь — в миокарде предсердий. • У новорожденных детей наблюдается пониженная функция ферментов ионной помпы, относительно малая плотность расположения этих ферментов на мембране кардиомиоцита и небольшая эффективность сопряжения транспорта АТФ. • Другой особенностью внутриклеточного строения миокардиоцита является сниженное количество саркоплазматического ретикулюма, в котором происходят регуляция концентрации цитоплазматического кальция и его утилизация, и значительная зависимость внутриклеточной концентрации кальция от внеклеточной. Изменения сердца новорожденного: Имеется много типов уродств сердца, которые не связаны с дефектами его перегородки. Сердце может оказаться расположенным за пределами грудной клетки. Происходит это на очень ранних стадиях развития. Это состояние, называемое ectopia cordis, уже рассматривалось в связи с образованием перикардиальной полости. Вместо того чтобы располагаться таким образом, что верхушка оказывается направленной влево, как это бывает в норме, сердце может иметь обратное положение, при котором его верхушка направлена вправо. Эта аномалия называется декстрокардией. Она редко встречается сама по себе, являясь обычно одним из факторов зеркального расположения всех внутренних органов, называемого situs viscerum inversus. Нередко встречаются аномалии клапанов сердца. Полулунные клапаны аорты или легочной артерии могут иметь две или четыре створки вместо обычных трех. Точно такие же отклонения от нормального строения могут иметь створки атриовентрикулярных клапанов. Возникают также отклонения от нормального укрепления этих створок сухожильными тяжами и сосочковыми мышцами. Все этапы формирования сердца приводят к тому, что оно превращается в орган, полностью разделенный на правую и левую половины. Однако в связи с условиями своего существования плод, находящийся в матке, не может полностью достичь дефинитивного типа кровообращения. Окончательный план кровообращения обусловливается наличием легочного дыхания. У взрослого человека правая половина сердца получает кровь из различных участков тела и перекачивает ее в легкие, где она освобождается от углекислоты и приобретает свежий запас кислорода. Левая половина сердца получает кровь, уже прошедшую через легкие, и вновь перекачивает ее через разветвляющиеся сосуды во все ткани организма. У плода функцию дыхания выполняет плацента путем обмена с материнской кровью, циркулирующей в матке. Легкие, хотя они в последние два месяца внутриутробной жизни уже полностью сформированы и готовы к несению своей функции, не могут приступить к деятельности до рождения плода. Радикальные изменения в характере насыщения крови кислородом, которые неизбежно должны произойти сразу же после рождения, привели к широко распространенному мнению, что в направлении движения крови по сердечно-сосудистой системе должны возникать скачкообразные преобразования. Однако при более внимательном изучении процессов развития кровеносной системы под функциональным углом зрения становилось все более ясным, что сердце и большие сосуды развиваются таким образом, что нагрузка различных частей сердца остается сбалансированной на всех этапах внутриутробной жизни. Кроме того, те же механизмы, которые поддерживают сердечный баланс в течение внутриутробной жизни, оказываются полностью приспособленными к новому уравновешиванию нагрузки на иной постнатальной основе, без какой-либо внезапной перегрузки до того неактивных частей сосудистой системы. Для того чтобы понять те изменения в кровеносной системе, которые происходят при рождении, необходимо ясно представить себе, каким образом осуществляется подготовка к ним во время внутриутробной жизни. Выше уже подчеркивалось то обстоятельство, что предсердия никогда полностью не отделены друг от друга. Следует повторить, что появляются последовательно три морфологически различных межпредсердных отверстия; первое — под septum primum, второе — в septum primum и, наконец, третье — в septum secundum. Это приводит к тому, что левое предсердие в течение всего антенатального периода непосредственно получает некоторую часть крови из нижней полой вены и правого предсердия. Приток этой крови компенсирует относительно небольшое количество крови, поступающей в левое предсердие раннего эмбриона из легочного круга кровообращения, и поддерживает примерный баланс объемов крови в правой и левой половинах сердца. Кровообращение плода: Кислород и питательные вещества доставляются плоду из крови матери при помощи плаценты — плацентарное кровообращение. Оно происходит следующим образом. Обогащенная кислородом и питательными веществами артериальная кровь поступает из плаценты матери в пупочную вену, которая входит в тело плода в области пупка и направляется вверх к печени, ложась в ее левую продольную борозду. На уровне ворот печени v. umbilicalis делится на две ветви, из которых одна тотчас впадает в воротную вену, а другая, называемая ductus venosus, дроходит по нижней поверхности печени до ее заднего края, где впадает в ствол нижней полой вены. Тот факт, что одна из ветвей пупочной вены доставляет печени через воротную вену чистую артериальную кровь, обусловливает относительно большую величину печени; последнее обстоятельство связано с необходимой для развивающегося организма функцией кроветворения печени, которая преобладает у плода и уменьшается после рождения. Пройдя через печень, кровь по печеночным венам вливается в нижнюю полую вену.  Таким образом, вся кровь из v. umbilicalis или непосредственно (через ductus venosus), или опосредованно (через печень) попадает в нижнюю полую вену, где примешивается к венозной крови, оттекающей по vena cava inferior от нижней половины тела плода. Смешанная (артериальная и венозная) кровь по нижней полой вене течет в правое предсердие. Из правого предсердия она направляется заслонкой нижней полой вены, valvula venae cavae inferioris, через foramen ovale (расположенно в перегородке предсердий) в левое предсердие. Из левого предсердия смешанная кровь попадает в левый желудочек, затем в аорту, минуя не функционирующий еще легочный круг кровообращения. В правое предсердие впадают, кроме нижней полой вены, еще верхняя полая вена и венозный (венечный) синус сердца. Венозная кровь, поступающая в верхнюю полую вену от верхней половины тела, далее попадает в правый желудочек, а из последнего в легочный ствол. Однако, вследствие того что легкие еще не функционируют как дыхательный орган, только незначительная часть крови поступает в паренхиму легких и оттуда по легочным венам в левое предсердие. Большая часть крови из легочного ствола по ductus arteriosus переходит в нисходящую аорту и оттуда к внутренностям и нижним конечностям. Таким образом, несмотря на то что вообще по сосудам плода течет смешанная кровь (за исключением v. umbilicalis и ductus venosus до его впадения в нижнюю полую вену), качество ее ниже места впадения ductus arteriosus значительно ухудшается. Следовательно, верхняя часть тела (голова) получает кровь, более богатую кислородом и питательными веществами. Нижняя же половина тела питается хуже, чем верхняя, и отстает в своем развитии. Этим объясняются относительно малые размеры таза и нижних конечностей новорожденного. Акт рождения представляет скачок в развитии организма, при котором происходят коренные качественные изменения жизненно важных процессов. Развивающийся плод переходит из одной среды (полость матки с ее относительно постоянными условиями: температура, влажность и пр.) в другую (внешний мир с его меняющимися условиями), в результате чего коренным образом изменяются обмен веществ, а также способы питания и дыхания. Вместо питательных веществ, получаемых ранее через кровь, пища поступает в пищеварительный тракт, где она подвергается пищеварению и всасыванию, а кислород начинает поступать не из крови матери, а из наружного воздуха благодаря включению органов дыхания. Все это отражается и на кровообращении. При рождении происходит резкий переход от плацентарного кровообращения к легочному. При первом вдохе и растяжении легких воздухом легочные сосуды сильно расширяются и наполняются кровью. Тогда ductus arteriosus спадается и в течение первых 8 — 10 дней облитерируется, превращаясь в ligamentum arteriosum. Пупочные артерии зарастают в течение первых 2 — 3 дней жизни, пупочная вена — несколько позднее (6 — 7 дней). Поступление крови из правого предсердия в левое через овальное отверстие прекращается тотчас после рождения, так как левое предсердие наполняется кровью, поступающей сюда из легких, и различие в давлении крови между правым и левым предсердиями выравнивается. Закрытие овального отверстия происходит значительно позднее, чем облитерация ductus arteriosus, и часто отверстие сохраняется в течение первого года жизни, а в 1/3 случаев — всю жизнь. Описанные изменения подтверждены исследованием на живом с помощью рентгеновских лучей.  Кровообращение новорожденного: После рождения ребенка совершаются процессы адаптации к постнатальной жизни. В этот период прекращается плацентарный кровоток, функция газообмена переходит к легким, и закрываются фетальные коммуникации. Малый и большой круги кровообращения становятся последовательными. Сопротивление легочных сосудов прогрессивно снижается из-за их раскрытия, а в артериальном русле — повышается (из-за потери плаценты, обладающей низким сопротивлением). После первого вдоха и начала легочной вентиляции резко возрастает легочный кровоток, перераспределяется сердечный выброс, меняется нагрузка на желудочки. Весь поток крови из легких теперь возвращается в левый желудочек, существенно превышая объем, попадавший в него внутриутробно; сразу после рождения левый желудочек увеличивает свой выброс в 3—6 раз больше, чем правый желудочек. Это сопровождается почти двухкратным возрастанием потребления кислорода организмом и максимальным сердечным выбросом на килограмм массы тела ребенка. К 6—8 неделям интенсивность работы сердца значительно снижается. При расчете сердечного выброса на 1 м2 поверхности тела ударный индекс (19±5 мл/м2) и сердечный индекс (2,6+0,7 л/мин/м2) у детей первых 2 мес. достоверно ниже, чем у детей старше 2 мес. (24,5±5 мл/м2 и 3,2±0,7 л/мин/м2 в среднем, р < 0,05). Последующее постепенное возрастание этих показателей отражает процесс созревания миокарда. После рождения устанавливаются также нормальные гемодинамические режимы работы желудочков — правого, нагнетающего кровь в легочные сосуды с относительно низким сопротивлением, и левого, нагнетающего кровь в большой круг кровообращения с высоким сосудистым сопротивлением, что сказывается на отношении времени ускорения (ВУ) и времени изгнания (ВИ) желудочков. Окончательные формальные параметры работы правого и левого отделов сердца приведены на рисунке. В норме реальное давление в правом желудочке и легочной артерии составляет 20—30% от системного давления, насыщение в правых отделах сердца колеблется от 65 до 80%, в левых — от 95 до 98%. У новорожденных или седатированных детей оно может быть ниже. Перестройка кровообращения влияет на морфологические характеристики правого и левого желудочков, которые претерпевают различную трансформацию. К концу первого года жизни толщина стенки левого желудочка становится почти в два раза больше, чем правого, а его полость практически не изменяется (рис. 1-9). Для правого желудочка динамика этих показателей противоположная: толщина стенки по сравнению с моментом рождения остается прежней, а полость увеличивается вдвое. Общее легочное сопротивление у новорожденного. Общее легочное сопротивление у новорожденного (ОЛС) в первые 24 часа после рождения уменьшается на -70% по сравнению с исходным, однако давление в легочной артерии все еще остается на уровне 60-85% от системного. Постепенная его нормализация происходит к 14 суткам, а может затягиваться и до 1,5 мес. Что касается морфологической постнатальной перестройки легочных сосудов, то она заканчивается к 2—3 месяцам. В процессе быстрого снижения ОЛС важную роль играют кислород и ряд вазоактивных субстанций, вырабатываемых в процессе родов. В экспериментах на животных доказано, что низкое р02 в легочной артерии во внутриутробном периоде поддерживает констрикцию легочных сосудов и низкий кровоток, а его повышение сопровождается увеличением легочного кровотока. На резистентность легочных сосудов влияют также продукты метаболизма арахидоновой кислоты, наиболее важными из которых являются простагландины (PGE, PGD) и простациклин (PGI2). К повышению продукции последнего приводят растяжение легких или их механическая стимуляция, действие брадикинина и ангиотензина-П. Кроме того, происходит дегрануляция тучных клеток, высвобождающих гистамин и PGD, которые у новорожденных вызывают снижение давления и сопротивления в легочных сосудах. Интересно, что гистамин и PGD в последующем действуют иначе и у взрослых вызывают вазоконстрикцию. Помимо функциональной релаксации стенки легочных сосудов происходят и ее структурные изменения. Уменьшение резистентности легких вследствие физиологического утончения медиального слоя легочных артериол продолжается вплоть до 8 недель жизни. Процесс снижения ОЛС может длиться и в последующие годы за счет увеличения количества функционирующих легочных альвеол и связанных с ними сосудов. 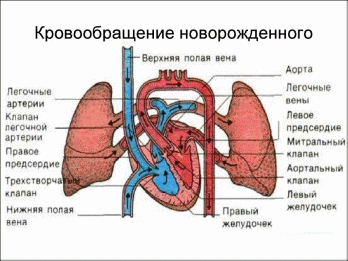 |
