|
|
ФУНКЦИОНАЛЬНАЯ БИОХИМИЯ. Функциональная биохимия
ФУНКЦИОНАЛЬНАЯ БИОХИМИЯ
Для выполнения всех необходимых жизненных функций организм человека содержит более 200 типов специализированных клеток. Комплекс морфологически однотипных клеток, выполняющих определенные функции, называется тканью. Ткани морфологически оформляются в органы - образования с определенными функциями в сложной биологической системе, какой является организм.
Функциональная биохимия выясняет связи между строением химических соединений и процессами их взаимоизменения с одной стороны, и функцией субклеточных частиц,специализированных клеток, тканей или органов, включающих в свой состав упомянутые вещества - с другой.
Молекулярные дефекты приводят к биохимическим сдвигам, клинически проявляющимися как заболевания, при которых изменяются нормальные биохимические показатели, имеющие диагностическое значение. Знание основ биохимии естественных процессов жизнедеятельности отдельных органов необходимо медику для выявления нарушений химических процессов, с последующим их устранением или исправлением.
БИОХИМИЯ ПЕЧЕНИ
Печень — центральная биохимическая лаборатория организма, в которой протекают разнообразные метаболические превращения веществ. Она также включается во все процессы обмена, происходящие и в периферических тканях. Химический состав печени: вода - 70%, белки - 12-24, липиды – 2-6, углеводы — 2-8, холестерин— 0,3-0,5, железо — 0,02% и другие минеральные вещества. У взрослого здорового человека масса печени составляет в среднем 1- 1,5 кг. Клеточный состав печени:
1) гепатоциты — 80%, расположены в два слоя и контактируют с одной стороны с желчью, а с другой- с кровью;
2) эндотелиальные клетки—15%;
3) клетки соединительной ткани — 5%.
Особенность кровоснабжения печени состоит в том, что в ней по синусоидам (расширенным капиллярам) циркулирует смешанная кровь (венозно-артериальная). 70— 80% общего объема крови поступает в нее по воротной вене (венозная кровь) от кишечника, а вместе с этой кровью поступают и продукты расщепления белков, липидов, полисахаридов и нуклеиновых кислот: глюкоза, аминокислоты, азотистые основания, хиломикроны и др. 30% крови доставляет в печень печеночная артерия (артериальная кровь), а вместе с ней доставляются метаболиты периферических тканей и органов: аланин, лактат, глутамин, ЛВП (зрелые), глицерин, кислород в виде калиевой соли оксигемоглобина и др. Печеночная вена выносит из печени в общий кровоток глюкозу, аминокислоты, белки плазмы крови, ферменты, кетоновые тела, ЛОНП, ЛВП-предшественники, мочевину и ряд других веществ.
Функции печени многочисленны и сложны, но наиболее важные из них биосинтетическая, регуляторно-гомеостатическая, гемостатическая, мочевинообразовательная и желчеобразоватильная, выделительная, катаболическая, детоксикационная.
Важнейшей функцией печени является биосинтетическая. В печени синтезируются следующие вещества: кетоновые тела, глюкоза, холестерин, эфиры холестерина, белки плазмы, белки свертывающей и антисвертывающей систем, заменимые аминокислоты, ВЖК, ФЛ, ТАГ (2-й ресинтез), ЛОНП, ЛВП-предшественники, биологически активные пептиды, ферменты глюконеогенеза, ферменты орнитинового цикла, ЛХАТ, гем, холин, креатин.
Часть метаболитов, образовавшихся в печени (глюкоза, холестерин, кетоновые тела, белки плазмы и др.) транспортируются далее в клетки других органов и тканей (т.е. «на экспорт»), где используются для энергетических и структурных целей, а часть откладывается в запас (например, гликоген, железо, жирорастворимые витамины) или выделяются из организма в случае неиспользования. Одной из функций печени является выделительная. В просвет ЖКТ печень выделяет холестерин, желчные кислоты, желчные пигменты, железо, другие вещества. В поддержании постоянства внутренней среды организма (гомеостатическая функция) роль печени уникальная, так как она является центром регуляции основных путей метаболизма: белков, углеводов, липидов, нуклеиновых кислот и нуклеотидов, витаминов, воды и электролитов.
Особенности обмена аминокислот, белков и других азотсодержащих веществ в печени
Печень играет центральную роль в поддержании азотистого баланса в организме, так как регулирует процессы утилизации азотистых веществ и выделение их метаболитов из организма. В печени протекают основные анаболические и катаболические процессы аминокислот (переаминирование, дезаминирование, декарбоксилирование). Только в печени синтезируются белки свертывающей (протромбин, фибриноген, проконвертин, проакцелерин) и антисвертывающей системы (кроме плазминогена). Печень является единственным органом синтеза альбуминов, церулоплазмина, трансферрина, ангиотензиногена. Печень обеспечивает через кровь другие органы сбалансированной смесью незаменимых и заменимых аминокислот, необходимых для биосинтеза их собственных белков. В печени синтезируются многие азотсодержащие вещества небелковой природы (креатин, холин, мочевая кислота, индикан, гем и др.), биологически активные пептиды (глутатион, карнозин, анзерин), а также происходит биосинтез и распад пуриновых и пиримидиновых азотистых оснований. Только в печени происходит образование мочевины — основной путь обезвреживания аммиака в организме.
Особенности обмена углеводов в печени
В печени протекают следующие метаболические процессы обмена углеводов: биосинтез и распад гликогена, необходимый для поддержания постоянства концентрации глюкозы в крови: глюконеогенез, аэробный гликолиз, пентозофосфаткый путь, обмен фруктозы и галактозы, цикл Кори, превращение глюкозы в ВЖК, биосинтез гетерополисахаридов. Печень является основным органом, поставляющим свободную глюкозу в кровь, так как в гепатоцитах печени имеется фермент глюкозо-6-фосфатаза, расщепляющий глюкозо-6-фосфат до свободной глюкозы.
Особенности обмена липидов в печени
Обмен липидов в печени наиболее интенсивно протекает по следующим метаболическим путям:
1) β - окисление ВЖК;
2) распад ТАГ, ФЛ, ХС, ЛВП-зрелых;
3) биосинтез транспортных форм липидов (ЛОНП, ЛВП-предшественни-ков);
4) биосинтез специфических ВЖК, ТАГ, ФЛ, холестерина, эфиров холестерина, кетоновых тел (ацетил-КоА →CH3COCH2COOH и
CH3-CHOH-CH2COOH).
Печень участвует в поддержании постоянного уровня жирных кислот в крови, если их количество увеличивается, то печень поглощает их и превращает в ТАГ, ФЛ, ЭХС, ЛОНП. Уменьшение биосинтеза фосфолипидов, уменьшение образования ЛОНП привод к увеличению биосинтеза ТАГ и накоплению их в гепатоцитах, что сопровождается жировой дегенерацией печени. Кетоновые тела (ацетоацетат, ацетон, β - гидроксибутират) синтезируются только в гепатоцитах печени из ацетил-КоА в ходе так называемого β-гидрокси-β-метилглутарил-КоА пути. При голодании, при пониженном содержании углеводов в пище, сахарном диабете возрастает скорость синтеза кетоновых тел (кетогенез). Из печени кетоновые тела током крови переносятся в периферические ткани и органы (мышцы, почки, мозг и т. д.), где они превращаются в ацетил-КоА и в цикле лимонной кислоты и ЦПЭ дают энергию. Печень играет важную роль в обмене стероидов, в частности холестерина (ХС). Общий путь ХС в печени составляет:
1. ХС, синтезируемый заново в печени из ацетил-КоА (эндогенный ХС);
2. ХС, образующийся из эфиров холестерина;
3. ХС, поступающий с артериальной кровью в составе зрелых ЛВП;
4. ХС, образовавшийся из деградированных форм ХМ и ЛОНП.
В печени ХС (80%) расходится на образование первичных желчных кислот (холевой и хенодезоксихолевой), для построения биомембран гепатоцитов, на формирование ЛОНП и ЛВП-предшественников, синтез эфиров ХС.
Кроме многочисленных функций в промежуточном обмене, печень играет важную в пищеварении, так как в ней образуется желчь.
Желчь — это жидкий секрет желтовато-коричневого цвета, который состоит из воды (97%), свободных и коньюгированных желчных кислот и солей (1%), билирубина и ХС, минеральных солей, фосфолипидов, ВЖК.
Различают печеночную желчь и пузырную, в которой образуются простые мицеллы, состоящие из фосфолипидов, холестерина и желчных кислот (2,5: 1: 12,5). Нерастворимый в воде холестерин удерживается в желчи в растворенном состоянии благодаря присутствию в ней солей желчных кислот и фосфатидилхолина. При недостатке желчных кислот в желчи холестерин выпадает в осадок, способствуя образованию камней. При нарушении желчеобразования или оттока желчи нарушаются переваривание липидов в ЖКТ, что приводит к стеаторее.
Печень играет важную роль в детоксикации чужеродных веществ или ксенобиотиков. Это имеет существенное значение для сохранения жизни организма. Чужеродные вещества попадают в организм с пищей, через кожу или с вдыхаемым воздухом и могут быть продуктами хозяйственной деятельности человека, веществами бытовой химии, лекарственным препаратами, этанолом. В печени инактивируются и токсические метаболиты распада азотсодержащих веществ: билирубина, продуктов распада аминокислот, биогенных аминов, аммиака, гормонов.
Гидрофильные ксенобиотики выводятся с мочой. Для удаления гидрофобных в процессе эволюции выработались механизмы, представляющие собой две фазы детоксикации: модификация и конъюгация. Возможные модификации: гидроксилирование (RH→ROH), сульфоокисление (R-S-R′→R-SO-R′), окислительное дезаминирование (RNH2→R=O+NH3) и т.д.
В печени наиболее активно микросомальное окисление (монооксигеназная система), отвечающее за обезвреживание ксенобиотиков (чужеродных веществ).
Гидроксилирование - чаще всего результат химической модификации токсичных веществ, происходящий в I - й фазе обезвреживания. Во II - фазе происходит реакция коньюгации, в результате обеих фаз образующиеся продукты, как правило, хорошо растворимы и легко удаляются из организма.
Основные ферменты, участвующие в окислительной системе: цитохром Р450-редуктаза – флавопротеин (кофермент ФАДН2 или ФМНН2), цитохром Р450, связывающий в активном центре липофильное вещество RH и молекулу кислорода. Один атом О2 присоединяет 2ē и переходит в форму О2-. Донором электронов и протонов является НАДФН+Н+, который окисляется цитохром – Р450 – редуктазой, О2- взаимодействует с протонами: О2-+2Н+→Н2О. Второй атом молекулы кислорода включается в гидроксильную группу вещества RH с образованием R-OH, в роли конъюгантов могут выступать глицин (при обезвреживании бензойной кислоты с образованием гиппуровой кислоты) ФАФС – донор остатка серной кислоты, УДФ – глюкуронид – донор остатка глюкуроновой кислоты. Последние два конъюганта используются при обезвреживании собственных метаболитов (индол через индоксил конъюгируется с ФАФС, давая животный индикан), а также лекарственных препаратов (аспирин после гидролитического отщепления ацетата конъюгируется с УДФ – глюкуронидом, образуя гидрофильный салицилглюкуронид, выносимый из организма с мочой).
Некоторые ксенобиотики (полициклические ароматические углеводороды, ароматические амины, афлатоксины) подвергаясь в печени изменениям ферментами монооксигеназной системы, превращаются в канцерогены. Они могут повреждать ДНК генов, мутации в которых способствуют превращению нормальной клетки в опухолевую. Экспрессия таких онкогенов приводит к неконтролируемой пролиферации, т.е. к развитию опухоли.
Так, образовавшийся в результате гидроксилирования бензанитрацена, эпоксид, ковалентно связывает гуанин, разрывая водородные связи в паре Г≡Ц, чем нарушает взаимодействие ДНК с белками.
Нитрозамины, образующиеся из азотистой кислоты и вторичных аминов (HNO2+R2NH→R2N-N=O) превращают цитозин в урацил, Г≡Ц становится ГУ. В комплементарной цепи уже будет СА, которая в результате мутаций может превратиться в ИА и комплементарная ей пара будет АТ, т.е. полностью изменился кодовый смысл ДНК.
Печень играет важную роль и в обезвреживании билирубина, который образуется в клетках РЭС в результате распада гемоглобина, миоглобина, каталазы, цитохромов и других гемопротеинов. Образовавшийся при этом билирубин нерастворим в воде, переносится с кровью в виде комплекса с альбумином и называется «непрямым» билирубином. В печени 1/4 часть непрямого билирубина вступает в реакцию коньюгации с УДФ-глюкуроновой кислотой, образуя диглюкуронид билирубина, называемого «прямым» билирубином.
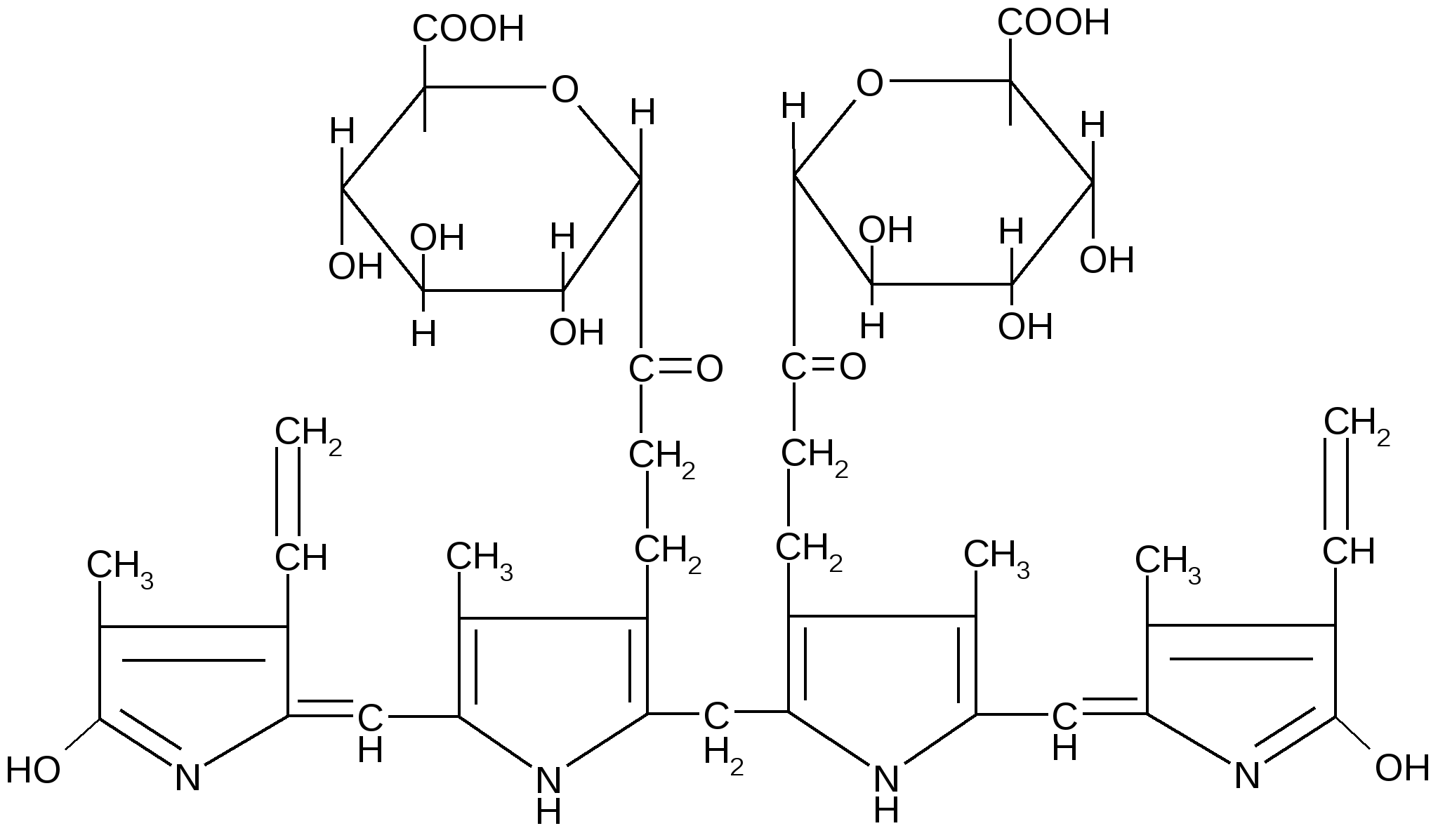
«Прямой» билирубин выводится из печени с желчью в тонкий кишечник, где происходит отщепление глюкуроновой кислоты под влиянием глюкуронидазы микробов кишечника с образованием свободного билирубина, который далее превращается с последующим образованием желчных пигментов: стеркобилиногена, стеркобилина, уробилиногена, уробилина. Показателем нарушения пигментного обмена в печени является содержание в крови «непрямого», «прямого» и общего билирубина. Повышение содержания билирубина в крови ведет к отложению его в тканях и вызывает желтухи различной этиологии. Основными причинами гипербилирубинемии являются: увеличение гемолиза эритроцитов, дефицит и дефект фермента глюкуронилтрансферазы, закупорка желчных протоков, нарушение равновесия между образованием и выведением билирубина, повреждение гепатоцитов (вирусами, токсическими гепатотропными веществами), гепатиты, цирроз печени и др.
В зависимости от причин гипербилирубинемии различают следующие основные виды желтухи: гемолитическую, паренхиматозную, обтурационную, наследственную, желтуху новорожденных и др.
Диагностическим тестом для определения происхождения желтухи являются следующие нормальные показатели:
1) «прямой» и «непрямой» билирубин в крови;
2) желчные пигменты в моче и кале.
В норме:
1) в крови содержится общего билирубина от 8 до 20 мкмолъ/л, при этом 25% (5 мкмоль/л) от общего билирубина приходится на «прямой» билирубин;
2) в моче — билирубина нет, уробилина — 1-4 мг/сутки;
3) в кале в сутки выделяется до 300 мг стеркобилина (окрашивает кал в коричневый цвет).
При гемолитической желтухе гипербилирубинемия возникает в основном вследствие усиленного гемолиза эритроцитов, в результате чего увеличивается:
1) в крови количество непрямого» (свободного) билирубина;
2) в моче количество уробилина (моча темная);
3) в кале количество стеркобилина (кал темный).
Кожа и слизистые окрашены в желтый цвет. При паренхиматозной (печеночно-клеточной) желтухе повреждаются клетки печени, вследствие чего увеличивается их проницаемость. Поэтому при паренхиматозной желтухе:
1) в крови увеличивается количество как «непрямого», так и «прямого» билирубина (желчь поступает прямо в кровь);
2) в моче уменьшается количество уробилина и обнаруживается «прямой» билирубин;
3) в кале уменьшается содержание стеркобилина.
При обтурационной (механической) желтухе нарушен отток желчи (закупорка общего желчного протока), что приводит:
1) в крови — к увеличению «прямого» билирубина;
2) в моче — к увеличению «прямого» билирубина и отсутствию уробилина;
3) в кале - к отсутствию желчных пигментов, кал обесцвечен.
Известно несколько заболеваний, при которых желтуха вызвана наследственными нарушениями метаболизма билирубина. Примерно у 5% населения диагностируют желтуху, вызванную генетическими нарушениями в структуре белков и ферментов, ответственных за захват непрямого билирубина в печень (синдром Жильбера), за его конъюгацию с глюкуроновой кислотой, обусловленной нарушением реакции глюкуронирования в печени (синдром Краглера-Найяра I и II типов), нарушением активного транспорта образованных в печени билирубинглюкуронидов в желчь (синдром Дабина-Ротора-Джонсона).
Дифференциальная диагностика наследственных желтух
Синдром
|
Дефект
|
Клинические проявления
|
Неконьюгированная гипербилируинемия
|
Криглера-Найяра-I-го типа* (врожденная негемолитическая желтуха)
|
Отсутствие активности, билирубин – УДФ - глюкуронилтрансферазы (не поддается лечению фенобарбиталом – индуктором гена УДФ-глюкуронилтрансферазы)
|
В крови о.б.↑, н.б.↑, к.б.↓, в моче у↓, к.б.↓, в кале с↓.
|
Криглера-Найяра-II-го типа
|
Нарушен синтез УДФ глюкуронилтрансферазы, катализирующей присоединение второй глюкуронильной группы (поддается лечению фенобарбиталом и фототерапией)
|
|
Жильбера
|
Гепатоциты не поглощают билирубин, снижена коньюгация
|
В крови о.б.↑, н.б.↑, к.б.N↓, в моче к.б.↓, у.↓, в кале с↓.
|
Коньюгированная гипербилирубинемия
|
Дабина-Ротора-Джонсона
|
Коньюгированный билирубин не поступает в желчь
|
В крови о.б.↑, н.б.↑, к.б.↑, в моче к.б.↓, у↓, в кале с↓.
|
о.б. – общий билирубин,
н.б. – неконьюгированный билирубин,
к.б. -. коньюированный билирубин,
с – стеркобилин,
у – уробилин.
* - дети умирают в раннем возрасте из-за развития билирубиновой энцефалопатии.
Семейная гипербилирубинемия новорожденных связана с наличием конкурентных ингибиторов коньюгации билирубина (эстрогена, свободных жирных кислот) в материнском молоке. При грудном вскармливании эти ингибиторы приводят к гипербилирубинемии (транзиторная гипербилирубинемия), которая исчезает при переводе на искусственное вскармливание.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ ПО БИОХИМИИ ПЕЧЕНИ
Цель занятия:
1. Знать основные функции печени, особенности путей обезвреживания ксенобиотиков и метаболитов в печени, образование и обезвреживание билирубина.
2. Уметь количественно определять концентрацию прямого и непрямого билирубина в сыворотке крови и желчных пигментов в моче для диагностики основных видов желтух.
3. Ознакомиться с видами наследственных желтух.
Принцип метода. Билирубин дает розовое окрашивание с диазореактивом Эрлиха. По интенсивности окрашивания судят о концентрации билирубина. Прямой билирубин (синонимы: билирубин-глюкуронид, коньюгированный билирубин, связанный билирубин) определяют цветной реакцией Эрлиха в отсутствии органических растворителей. Общий (прямой, непрямой) билирубин определяют в присутствии спирта, обеспечивающего взаимодействие всех форм билирубина с диазореактивом Эрлиха. Непрямой билирубин (синонимы: свободный билирубин, неконьюгированный билирубин) определяют по разнице между общим и прямым.
|
|
|
 Скачать 2.5 Mb.
Скачать 2.5 Mb.
