ФУНКЦИОНАЛЬНАЯ БИОХИМИЯ. Функциональная биохимия
 Скачать 2.5 Mb. Скачать 2.5 Mb.
|
|
Строение молекулы иммуноглобулина. Фибриноген. Белки-ферменты плазмы крови Молекулы всех классов иммуноглобулинов имеют сходное строение. Рассмотрим их строение на примере молекулы IgG. Иммуноглобулины - сложные белки, гликопротеины, о6ладают четвертичной структурой. Белковая часть иммyнoглобулина состоит из 4 пoлипeптидных цепей: 2 одинаковых легких (L) и 2 одинаковых тяжелых (H). Молекулярная масса легкой цепи 23 кДа, тяжелой - от 53 до 75 кДа. С помощью дисульфидных (-S-S-) связей (мостиков) тяжелые цепи соединены между собой и с легкими цепями. Классы иммуноглобулинов человека
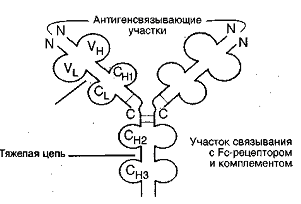 Рис. Доменное строение lgG Рис. Доменное строение lgGЛегкая цепь, начиная с N-конца, и такой же по длине участок H - цепи формируют вариабельный участок – Fab–фрагмент. Он может связываться с соответствующим антигеном cлaбыми типами связей. Именно этот участок обеспечивает специфичность связи иммуноглобулина со своим антигеном. В молекуле иммуноглобулина выделяют также Fс – фрагмент - константная (одинаковая) для всех иммуноглобулинов часть молекулы. Формируется за счет H-цепей. Fc-фрагмeнт обеспечивает прохождение иммуноглобулина через биолoгичeскую мембрану, например через плаценту. Взаимодействие Fab-фрагмента с антигеном приводит к значительному изменению конформации всей молекулы иммуноглобулина. При этом становится доcтyпным тот или иной участок в пределах Fс-фрагмента. Взаимодействие этого открывшегося центра с первым компонентом системы комплемента или с рецепторами клетки приводит к образованию иммунного комплекca «антиген - антитело». Число разных антител, которые могут синтезироваться в организме одного человека равно 107. Для любого из чужеродных веществ, которые могут попасть в организм, найдется среди 107 клонов лимфоцитов хотя бы один клон, антитела которого имеют центр связывания, комплементарный этому веществу. До встречи с антигеном концентрация антител к нему ничтожно мала. Гипотеза гаметных клонов и гипотеза соматических изменений генома лейкоцитов объясняет разнообразие иммуноглобулинов. Рекомбинация – транслокация генов, кодирующих вариабельные Н цепи (тяжелые) равно 4000, генов легких цепей тоже 4000 при образовании иммуноглобулинов Н и L цепи могут соединятся в различных сочетаниях, поэтому число иммуноглобулинов достигает 1,6 107. Фибриноген – белок, на который направлено действие системы свертывания крови. При свертывании крови фибринoгeн превращается в фибрин, который нерастворим в воде и выпадает в виде нитей. В этих нитях запутываются форменные элементы крови, формируя кровяной сгусток (тромб). Классификация белков-фементов плазмы крови: - ферменты плазмы - выполняют специфичные метаболические функции в плазме. Включают такие протеолитические системы, как система комплемента, система регуляции сосудистого тонуса; - ферменты, пoстyпающие в плазму в результате повреждения того или иного органа или ткани в результате разрyшения клеток. Представляют интерес в диагностических целях (трансаминазы, лактатдerидpoгeназа, креатинфосфокиназа). Органические нeбeлковые соединения плазмы: I гpyппa – азотсодержащие небелковые компоненты - азот промежуточных и конечных продуктов обмена простых и сложных белков (остаточный азот);
При некоторых заболеваниях почек, тяжелых ожогax небелковый азот крови повышается – возникает азотемия. Чаще нарушается не общее coдержание небелкового азота в крови, а соотнoшeние между отдельными кoмпoнeнтами небелкового азота. II гpyппa - безазотистые opгaнические вещества:
Главнейшие протеолитические системы крови Плазма крови содержит несколько протеолитических систем. В составе этих систем – протеиназы, участвующие в защитных и регуляторных реакциях организма. В отличие от тканевых, плазменные протеиназы пространственно не разделены. Поэтому они могут свободно взаимодействовать между собой. Активация плазменных протеиназ относится к группе процессов, объединенных под общим названием «гетерогенный катализ», и протекает эффективно при связывании с чужеродными поверхностями. К основным протеолитическими системам крови относятся кининовая и ренин-ангиотензиновая.
Эти системы обеспечивают различные функции, но в работе их соблюдаются общие принципы.
Система свертывания крови и фибринолиза Это единая система, которая выполняет следующие функции:
Гемостаз – сложный ферментативный процесс, в результате которого образуется кровяной сгусток. Выделяют 4 фазы гемостаза. I. Сокращение поврежденного сосуда, вследствие чего уменьшается кровоснабжение дистальной от травмы области. Система регуляции сосудистого тонуса В нашем организме есть две взаимосвязанные системы протеолитических ферментов, в результате работы которых регулируется сосудистый тонус. 1. Рении-ангиотензан - альдостероновая система (РААС-система). Работа этой системы направлена на повышение артериального давления. 2. Кининовая система направлена на понижение артериального давления. Активация обеих систем сводится к синтезу биологически активных низкомолекулярных пептидов из их предшественников путем реакций ограниченного протеолиза. Главная роль принадлежит РААС, которая регулирует сосудистый тонус и вводно-солевой обмен. В почках в клетках юкстагломерулярного аппарата (ЮГА) синтезируется ренин - протеолитический фермент. Ренин участвует в регуляции сосудистого тонуса, превращая ангиотензиноген в декапептид ангиотензин-I путем ограниченного протеолиза. Из ангиотензина-I под действием фермента карбоксикатепсина образуется (тоже путем ограниченного протеолиза) октапептид ангиотензин-II. Он обладает сосудосуживающим эффектом, а также стимулирует выработку гормона коры надпочечников – альдостерона. Адьдостерон усиливает реабсорбцию натрия и воды в почечных канальцах – это приводит к увеличению объема крови, циркулирующей в сосудах. В результате повышается артериальное давление. Когда молекула ангиотензина-II выполнит свою функцию, она подвергается тотальному протеолизу под действием группы специальных протеиназ-ангиотензиназ. Так работает ренин-ангиотензин-альдестероновая система. Выработка ренина зависит от кровоснабжения почек. Поэтому при снижении артериального давления выработка ренина увеличивается, а при повышении – снижается. При патологии почек иногда наблюдается повышенная выработка ренина и может развиваться стойкая гипертензия (повышение артериального давления). Ренин-ангиотензин-альдостероновая система работает в тесном контакте с другой системой регуляции сосудистого тонуса: калликреин-кининовой системой, действие которой приводит к понижению артериального давления. В почках синтезируется белок кининоген. Попадая в кровь, кининоген под действием сериновых протеиназ - калликреинов превращается в азоактивные пептиды – кинины: брадикинин и каллидин. Брадикинин и каллидин обладают сосудорасширяющим эффектом - понижают артериальное давление. Инактивация кининов происходит при участии карбоксикатепсина – этот фермент одновременно влияет на обе системы регуляции сосудистого тонуса, что приводит к повышению артериального давления. Ингибиторы карбоксикатепсина применяются в лечебных целях при лечении некоторых форм артериальной гипертензии. II. Образование тромбоцитарной пробки (белого тромба). В этом случае в участке поврежденного сосуда коллаген связывает тромбоциты, в результате их разрушения высвобождается тромбоксан и АДФ, которые присоединяют новые тромбоциты с образованием рыхлой временной пробки. III. Формирование красного кровяного сгустка, образующегося в областях замедленного кровотока вслед за инициирующей тромбоцитарной пробкой по внутреннему (контактному) пути. Инициация образования сгустка в ответ на повреждение ткани осуществляется по внешнему (прокоагулянтному) пути. IV. Частичное или полное растворение сгустка. Система свертывания крови- это многокомпонентная система, в состав которой входят белки, фосфолипиды, обломки клеточных мембран и ионы кальция. Компоненты системы свертывания крови принято называть факторами. Факторы бывают тканевыми, плазменными и тромбоцитарными. Тканевые и плазменные факторы обозначаются римскими цифрами, а тромбоцитарные – арабскими. Если фактор является активным, то за цифрой ставится буква «а». Например, переход неактивного двенадцатого фактора в активный можно обозначить так: фXII фXIIа (неактивный) (активный). С перечнем факторов свертывания было знакомство на физиологии. Ниже акцент делается на биохимическую сущность процесса. Большинство белков системы свертывания крови обладает ферментативной активностью. Все факторы свертывания крови, кроме фXIII, являются сериновыми протеиназами, которые катализируют реакции ограниченного протеолиза (II, VII, IX, X, XI, XII). В ходе реакций свертывания крови все белки-ферменты сначала выступают в роли субстрата, а затем – в роли фермента. Среди белков, участвующих в свертывании крови, есть такие, которые не обладают ферментативной активностью, но специфически ускоряют протекание ферментативной реакции. Они называются параферментами. Это фV, фVIII и фIII – тканевый тромбопластин – липопротеин. Большинство факторов свертывания крови синтезируется в неактивной форме в виде проферментов. Проферменты активируются и их действие направлено на протекание прямой реакции свертывания крови – на превращение фибриногена в фибрин, который является основой кровяного сгустка. Все факторы, кроме фосфолипидов и Са2+ - белки с различной молекулярной массой: 60-70 кда ( I, VII, IX, X); 300-400 кда (I, V, XII, XIII) и 4,5млн кда – VIII фактор. По структуре – I, II, VIII, IX, X, XI, XII, XIII, плазминоген являются гликопротеинами фIII, фVII и фV – липопротеины. Большинство факторов синтезируется в печени, фактор VIII также может синтезироваться в селезенке, почках, лейкоцитах, плазминоген синтезируется не в печени, а в кровяном русле. Протеинолитическая активность факторов выражается в гидролизе пептидных связей, подобно трипсину в основном после –арг-. Так, последняя гидролитическая реакция каскадного механизма, состоит в отщеплении А и В отрицательно заряженных пептидов от и цепей фибриногена под действием тромбина (фIIа) и от фибриногена остается незаряженный фибрин-мономер: 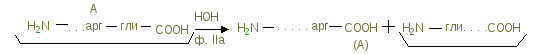 -цепь фибриногена -цепь фибрина В результате потери заряда в мономере фибрина с четвертичной структурой ()2 в центральном домине Е, откуда отщепились пептиды 2А и 2В открываются центры агрегации с боковыми доменами Д других мономеров в результате слабых взаимодействий. И образуется непрочный гель фибрина. Таким образом, краткое изображение схемы свертывания крови можно представить на рисунке: 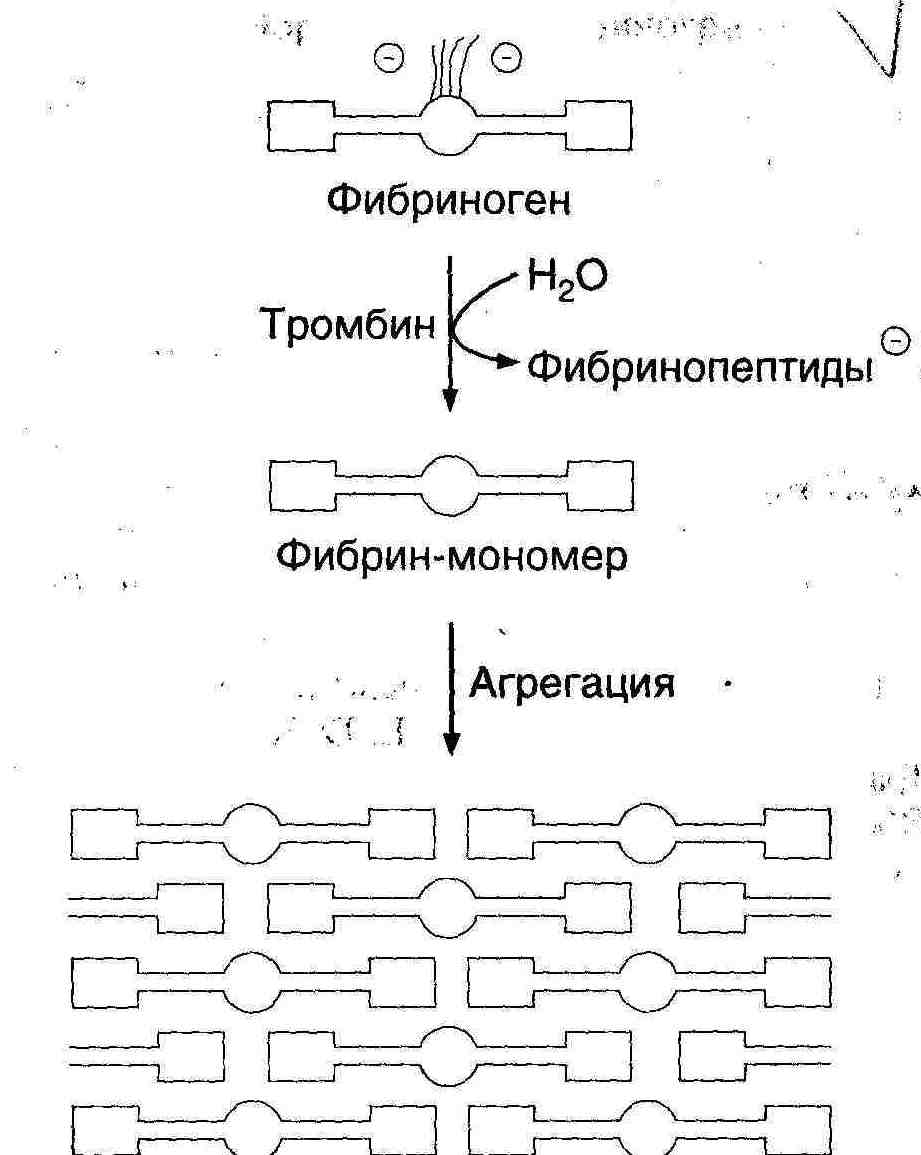 Есть два механизма свертывания крови – внешний и внутренний. Внешний механизм запускается с участием внешних (тканевых) факторов. Внутренний – при участии факторов, источником которых служит сама кровь, плазма, собственно ферменты и форменные элементы крови. Различаются внешний и внутренний механизмы только начальными стадиями до активации протромбина фII). Последующие стадии протекают одинаково и в том, и в другом случаях. Начальные стадии внешнего механизма (прокоагулянтный, время свертывания 15-20 сек). Для пуска внешнего механизма необходим первичный сигнал: повреждение тканей (клеток), оказавшихся в контакте с кровью, или эндотелия сосуда. При этом разрушаются клеточные мембраны и из клеток высвобождается тканевой тромбопластин (фIII). Он активирует фVII. фIII – парафермент, изменяет конформацию фVII, но не вызывает протеолиз. Активация фVII, а также все последующие реакции до активации протромбина протекают на матрице, которая состоит из липидопротеиновых осколков клеточных мембран. В ходе активации фактора VII происходит конформационная перестройка его молекулы, и формируется активный центр этого белка-фермента. Активный фVIIa образует комплекс с тканевыми фосфолипидами и ионом кальция. Этот комплекс обладает протеолитической активностью и вызывает активацию фактора Х, путем отщепления его части. Активный фактор Ха тоже обладает протеолитической активностью и активирует протромбин. Начальные стадии внутреннего (контактного) механизма (время свертывания 3-5 минут). Начальные стадии внутреннего механизма называются «контактная фаза» или «контактная стадия». Происходит контакт фХII с чужеродной поверхностью (например, игла шприца, лезвие ножа, стекло). В результате происходит конформационная перестройка фI) и он активируется – переходит в фXIIа. В результате изменения конформации фXII в комплексе с высокомолекулярным кининогеном (ВМК) протеолитически превращает прекалликреин в каллекриин, он в свою очередь по принципу положительной обратной связи частичным протеолизом активирует фXII. Активация фXII, а также последующие реакции внутреннего механизма так же, как и при внешнем механизме, протекают на матрице – тромбопластине, который освобождается при разрушении тромбоцитов. XIIа действует на XI, превращая его в XIа, отщепляя от него небольшой пептид. XIа действует на фIX (обязательно в присутствии ионов кальция!), и переводит его в фIXа, уменьшая его молекулу наполовину, способствует его превращению в активную форму. IXа образует комплекс с тромбоцитарными фосфолипидами, ионами кальция и параферментом – фVIIIa. В составе этого комплекса фIXа обладает протеолитической активностью и переводит фX в фХа. Фактор VIII синтезируется эндотелиальными клетками, активируется частичным протеолизом под действием тромбина, в крови находится в комплексе с фактором тромбоцитов фон Виллебранда. Фактор фон Виллебранда стабилизирует фактор VIII и в случае дефицита как фактора фон Виллебранда, так и фактора VIIIa развивается гемофилия А (классическая). Гемофилия А обусловлена мутацией гена фактора VIII, локализованного в Х-й хромосоме (80% всех случаев заболевания гемофилией). Это заболевание характерно для мужчин, т.к. дефект гена VIII фактора проявляется как рецессивный признак (1:10000). Больных лечат препаратами из донорской крови или полученными методами генной инженерии. В результате сложного взаимодействия перечисленных факторов внешнего и внутреннего пути, ионов кальция и параферментов, образуется ряд комплексов с участием факторов VII, IX, X, II, активность которых зависит от витамина К. На N- концах их полипептидных цепей содержатся остатки -карбоксиглутаминовой кислоты, образуюшейся в результате посттрансляционной модификации этих белков в ЭР гепатоцитов под действием монооксигеназы с участием витамина К и карбоксилазы. Окисление восстановленной формы витамина К идет с использованием одного атома кислорода с образованием эпоксида, а второй «оттягивает» водород от С глутаминовой кислоты, когда внедряется СО2 с образованием -СООН: 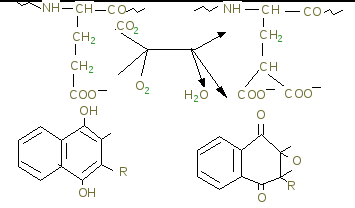 С образованием дополнительных отрицательных групп облегчается образование комплексов ионами кальция, который приближает профермент к отрицательно заряженной внешней мембране тромбоцитов (ввиду экспонирования фосфолипидов). Следующие стадии, начиная с активации протромбина (фII), протекают одинаково для обоих механизмов свертывания крови. Протромбин(норма в крови – 1,4-2,1 мкмоль/л) – белок, который синтезируется в печени. Для синтеза протромбина необходим витамин К. Реакция образования тромбина катализируется комплексом, состоящим из активного фХа, фосфолипидов, иона кальция и парафермента Vа. На мембране тромбоцита содержится фактор Va, котрый служит рецептором для Ха, осуществляющий протеолиз протрамбина, превращающегося в активный фIIа, который превращает фиброген в фибрин-мономер как указано выше. 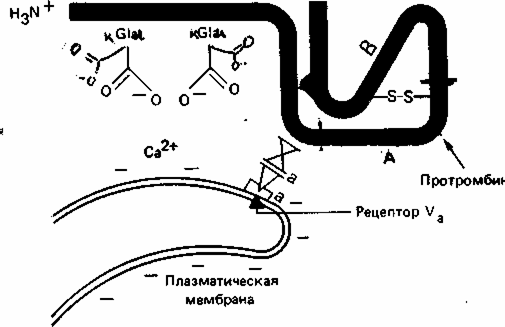 Таким образом, краткое изображение схемы свертывания крови можно представить на рисунке: 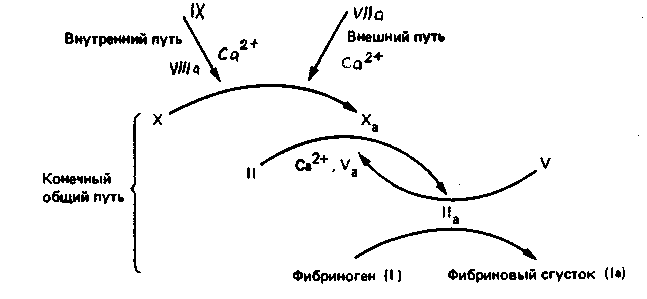 Недостаточность витамина К приводит к дефектности факторов II, IX, X, VII, что сопровождается кровоточивостью, подкожными и внутренними кровоизлияниями. Структурные аналоги витамина К – дикумарол и варфарин являются ингибиторами превращения витамина К и применяются для предупреждения тромбозов. В ходе этой реакции резко уменьшается сродство данного комплекса к матрице и активный тромбин, или фIIа, освобождается с матрицы и гидролизует пептидные связи между аргинином и глутаминовой кислотой в молекуле своего субстрата - фибриногена, превращая его в фибрин-мономер. На следующей стадии мономеры спонтанно реагируют с образованием регулярной полимерной структуры «мягкого» сгустка растворимого фибрин-полимера. При этом происходит захват фибрин-полимером компонентов крови – формируется тромб (сгусток). Сначала сгусток рыхлый и мягкий, связи между молекулами фибрин-полимера слабые (нековалентные). Но затем под действием активного фXIIIа (фибриназа) (активируется фактором IIа – тромбином) происходит прочная ковалентная «сшивка» (см. рисунок) молекул фибрин-полимера. 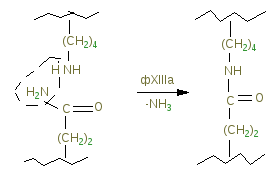 Образуются межмолекулярные связи между карбоксильными группами глутамина и аминогруппами лизина: так растворимый фибрин-полимер переходит в нерастворимый фибрин-полимер. При контактном механизме участвует большее количество факторов, поэтому кровь свертывается медленнее, чем при прокоагулярном механизме. После образования нитей фибрина происходит их сокращение (ретракция кровяного сгустка), которое происходит с затратой АТФ. Фактор XIII – трансглутаминаза активируется в свою очередь частичным протеолизом под действием тромбина. Сжатие (ретракцию) геля обеспечивает трамбостенин (8-й фактор тромбоцитов), обладая АТФ-азной активностью при своем освобождении из тромбоцитов. Это предупреждает полную закупорку сосудов, создавая возможность восстановления кровотока. Процесс тромбообразования постоянно контролируется антитромбином III – ингибитором сериновых протеиназ. Кроме того, протекание большинства реакций свертывания крови на матрице обеспечивает: 1. высокую эффективность процесса в результате каскадного механизма; 2. локальность процесса - процесс свертывания протекает только в месте повреждения (это предотвращает процесс диссеминированного внутрисосудистого свертывания (ДВС-синдром). Скорость свертывания крови зависит не только от работы системы свертывания, но и от присутствия естественных антикоагулянтов – веществ, предотвращающих свертывание крови. Образовавшийся тромб существует 3-7 дней. Считается, что система свертывания крови работает всегда: одновременно происходит образование и растворение фибриновых сгустков благодаря тому, что работа системы свертывания крови уравновешивается работой системы фибринолиза. Фибринолиз – это расщепление фибринполимера на отдельные пептиды, которое катализируется плазмином. Плазмин – сериновая протеиназа, способен гидролизовать фибрин, фибриноген и др. Сам плазмин образуется из плазминогена под действием активатора плазминогена. Тканевой активатор плазминогена неактивен до тех пор, пока не вступит в контакт с фибрином. Контактируя с фибрином, он приобратает способность активировать плазминоген. Когда фибрин будет гидролизован плазмином, активатор плазминогена теряет свою активность. Функциональноые особенности системы свертывания крови и фибринолиза. 1. Система саморегулируется по принципу обратной связи. Наблюдается положительная обратная связь на начальных стадиях работы системы, что позволяет многократно усиливать первично слабый сигнал (факторы Х и VII). Отрицательная обратная связь чаще встречается на конечных стадиях (цель - самоограничение процесса: тромбин и протромбин). 2. На автономную регуляцию процесса накладывается нейрогормональная. Адреналин вызывает освобождение тромбопластина и тканевого активатора плазминогена из эндотелия сосудов, а также превращение фХII в фXIIa. 3. Система свертывания крови представляет собой каскад реакций, а ферменты фибринолиза находятся вне этого каскада. Смысл: система фибринолиза и система свертывания крови работают у нас в организме постоянно, но с чрезвычайно низкой скоростью. В норме у человека уравновешены процессы свертывания и фибринолиза. Это обеспечивает постоянную готовность организма ответить на действие различных повреждающих факторов. В случае травмы организм может очень быстро усилить работу системы свертывания крови. При этом система фибринолиза не может обеспечить значительного прироста активности плазмина и он не успевает гидролизовать фибрин. Благодаря этому осуществляется гемостаз. В последнее время научные исследования в этой области стали помогать в лечении больных. В годы Великой Отечественной войны группой ученых под руководством Палладина был синтезирован викасол – водорастворимый аналог витамина К. Некоторое время назад был синтезирован антивитамин К. Он используется для лечения больных со склонностью к тромбообразованию. Сейчас разработаны препараты фXIII и фIХ для лечения больных. Недавно из мочи выделена урокиназа. Этот фермент катализирует превращение плазминогена в плазмин, который обладает высокой протеолитической активностью. |
